Содержание
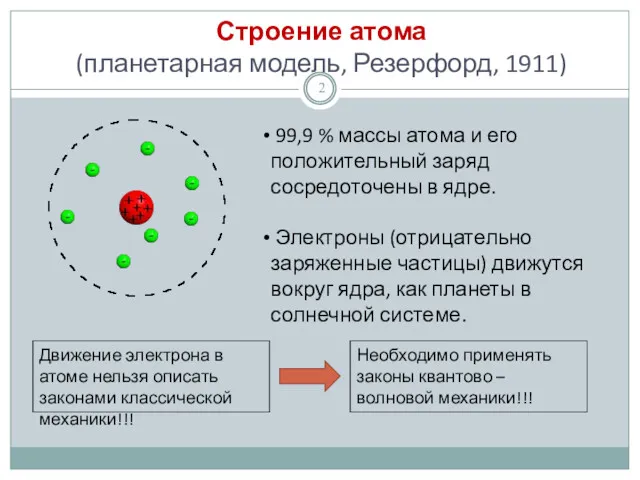
- 2. Строение атома (планетарная модель, Резерфорд, 1911) 99,9 % массы атома и его положительный заряд сосредоточены в
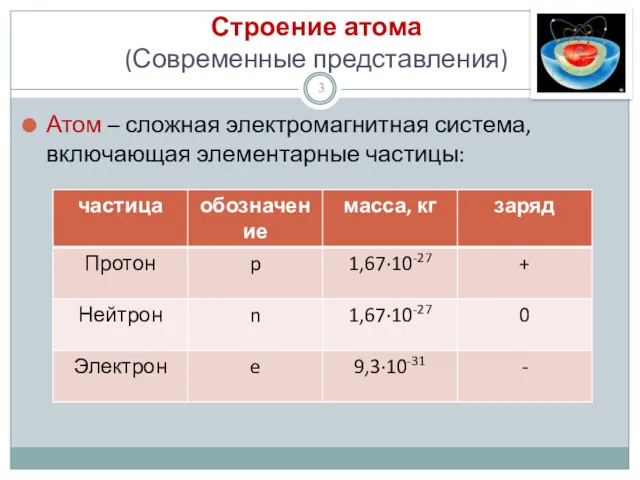
- 3. Строение атома (Современные представления) Атом – сложная электромагнитная система, включающая элементарные частицы:
- 4. АО - это часть атомного пространства, где вероятность пребывания электрона > 90%. Характеристики атомной орбитали: Размер
- 5. Квантовые числа
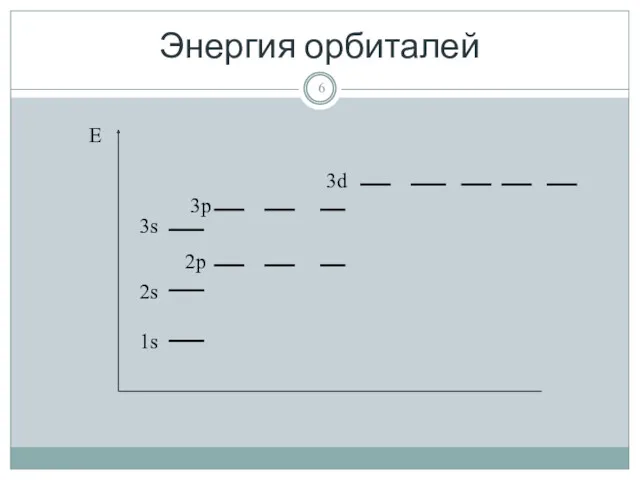
- 6. Энергия орбиталей
- 7. Принципы заселения орбиталей электронами Принцип наименьшей энергии (правило Клечковского) Принцип Паули Правило Гунда
- 8. Электроны заселяют орбитали так, чтобы их общая энергия была минимальной. Общая энергия электрона отражается суммой двух
- 9. Валентные электроны Валентные электроны – это электроны внешнего уровня и незавершенного предвнешнего подуровня они определяют химические
- 10. Конфигурации валентных электронов атома определяются положением элемента в таблице Менделеева. При этом используются: - номер периода
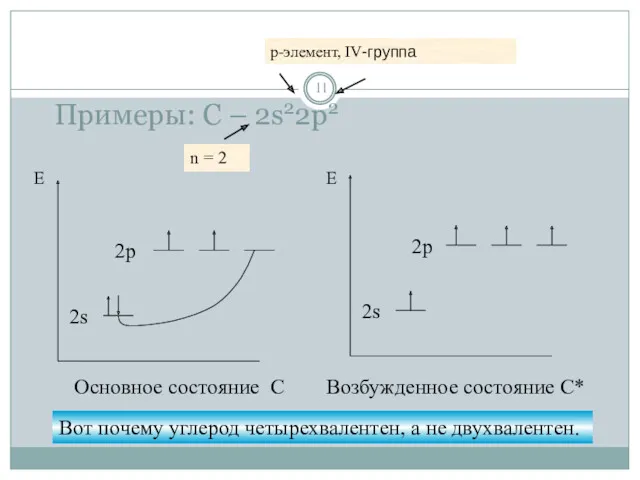
- 11. Примеры: С – 2s22p2 n = 2 p-элемент, IV-группа
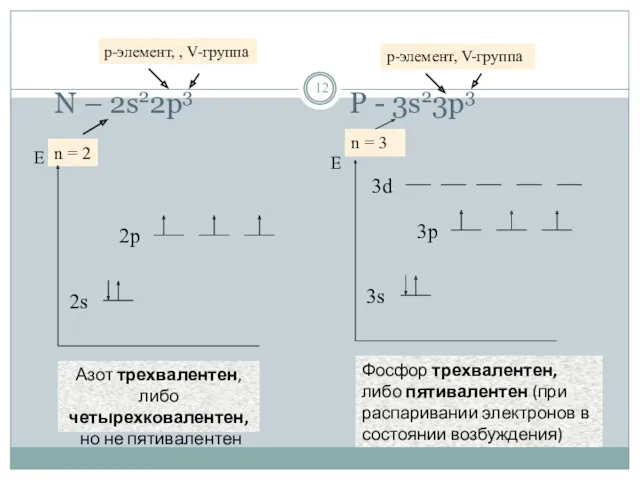
- 12. N – 2s22p3 P - 3s23p3
- 13. Химическая связь ХИМИЧЕСКАЯ СВЯЗЬ - это электростатическое взаимодействие между атомами с участием валентных электронов, сопровождаемое выделением
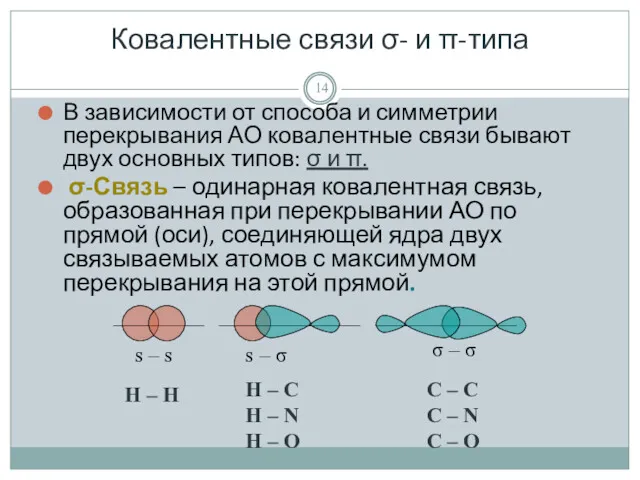
- 14. Ковалентные связи σ- и π-типа В зависимости от способа и симметрии перекрывания АО ковалентные связи бывают
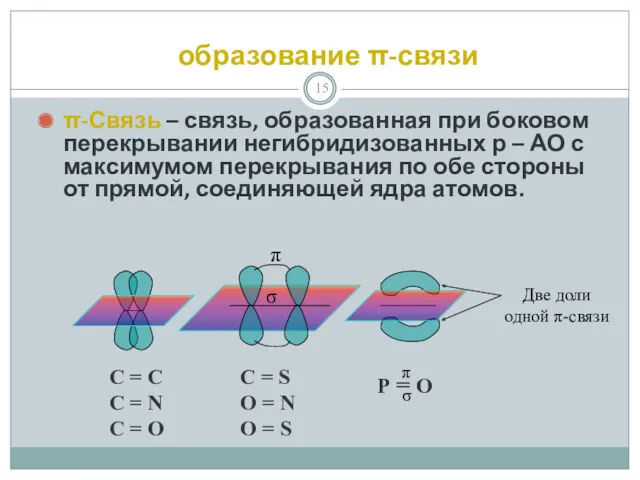
- 15. образование π-связи π-Связь – связь, образованная при боковом перекрывании негибридизованных р – АО с максимумом перекрывания
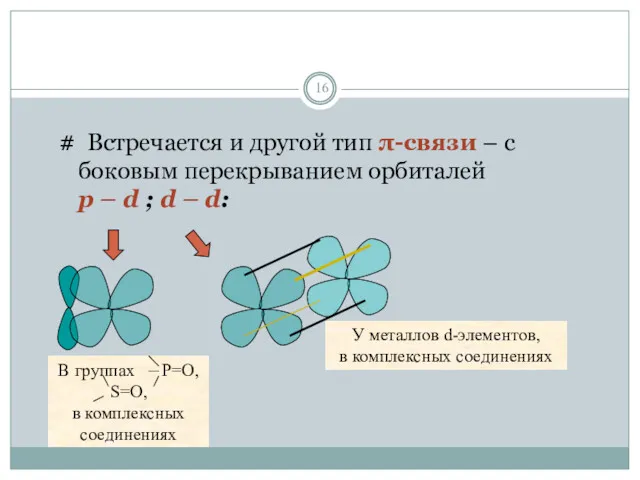
- 16. # Встречается и другой тип π-связи – c боковым перекрыванием орбиталей p – d ; d
- 17. Свойства ковалентной связи ЭНЕРГИЯ СВЯЗИ – это энергия, выделяющаяся при образовании связи или необходимая для разрыва
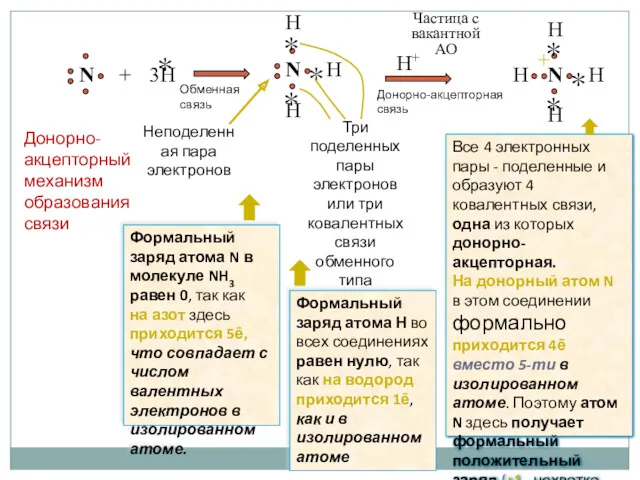
- 18. Донорно – акцепторные и другие типы связей Донорно – акцепторная (координационная) связь – это ковалентная связь,
- 19. H Неподеленная пара электронов Три поделенных пары электронов или три ковалентных связи обменного типа Частица с
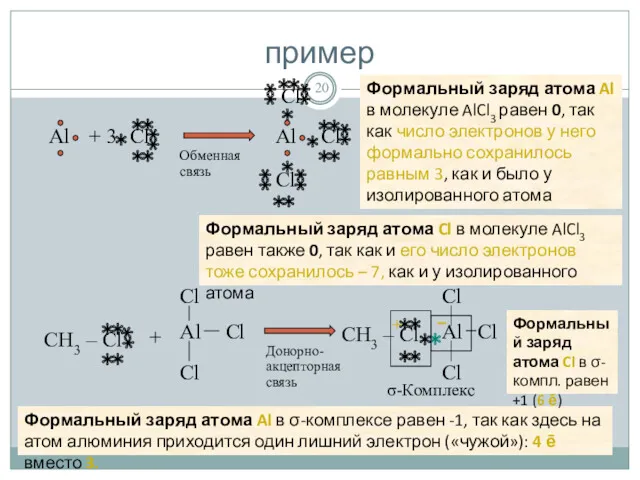
- 20. пример Формальный заряд атома Cl в молекуле AlCl3 равен также 0, так как и его число
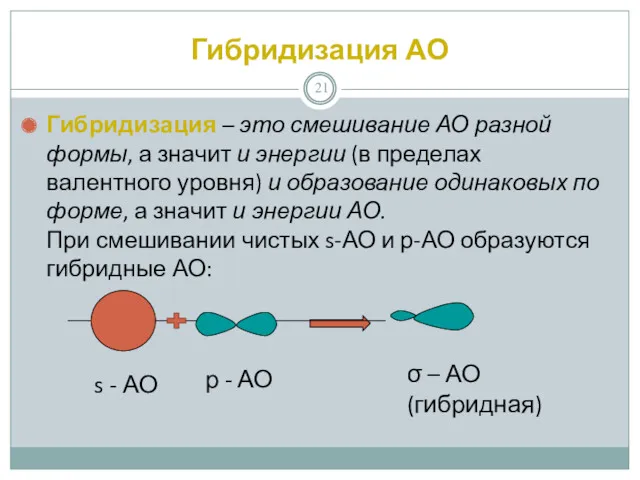
- 21. Гибридизация АО Гибридизация – это смешивание АО разной формы, а значит и энергии (в пределах валентного
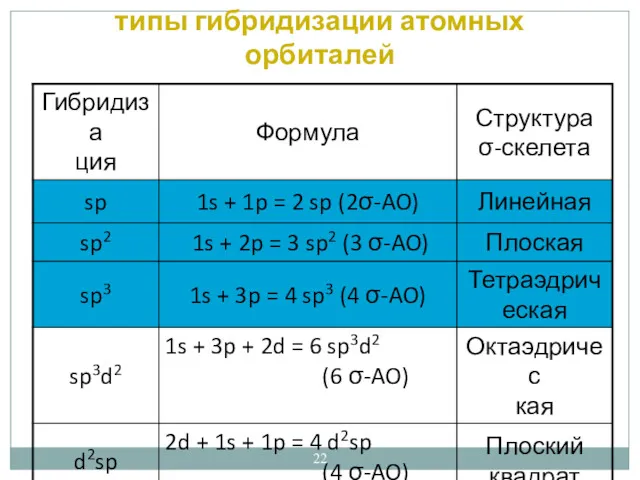
- 22. типы гибридизации атомных орбиталей
- 23. Рис. Энергетическая схема гибридизации АО элементов второго периода (В, С, N, О, F ) Е рz
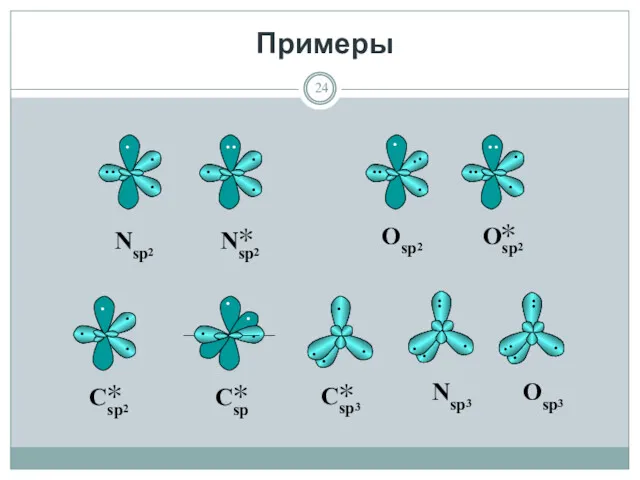
- 24. Примеры
- 25. Одноэлектронные σ-АО идут на образование обменных σ-связей; Одноэлектронные р-АО идут на образование обменных π -связей; Двухэлектронные
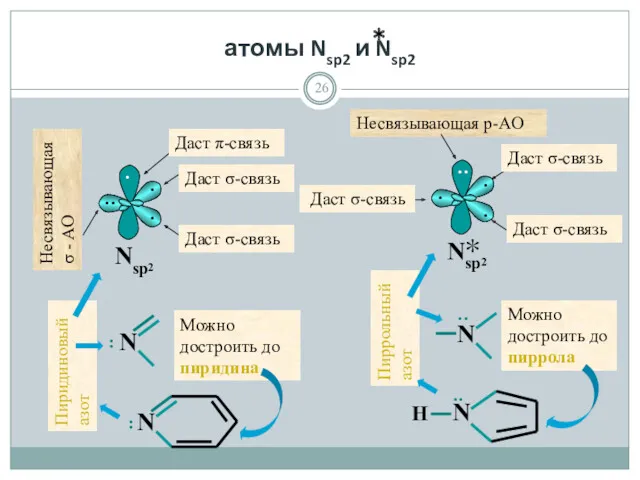
- 26. атомы Nsp2 и Nsp2 · · ·· · Nsp2 Несвязывающая σ - АО Даст σ-связь Даст
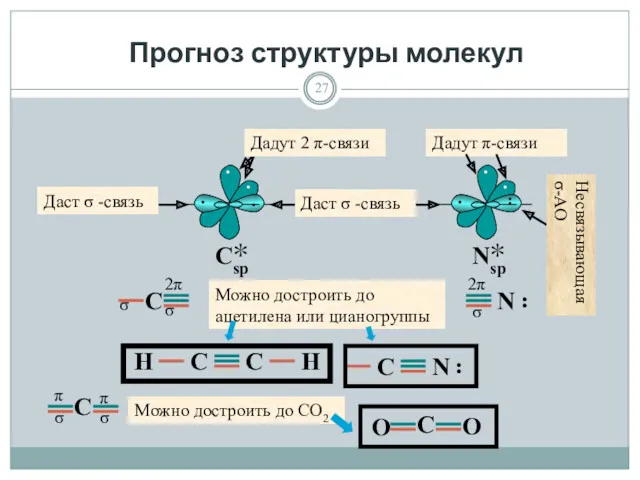
- 27. Прогноз структуры молекул Дадут 2 π-связи Даст σ -связь Даст σ -связь Можно достроить до ацетилена
- 28. Определение типа гибридизации Гибридизация определяется по правилу Тернея: Считают число объектов вокруг атома. - 4 объекта
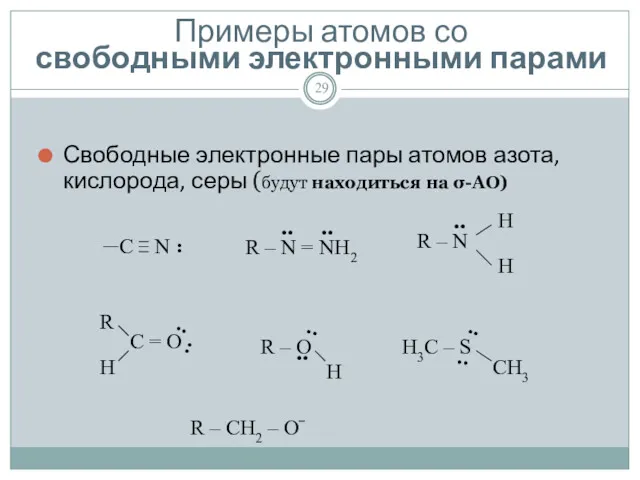
- 29. Примеры атомов со свободными электронными парами Свободные электронные пары атомов азота, кислорода, серы (будут находиться на
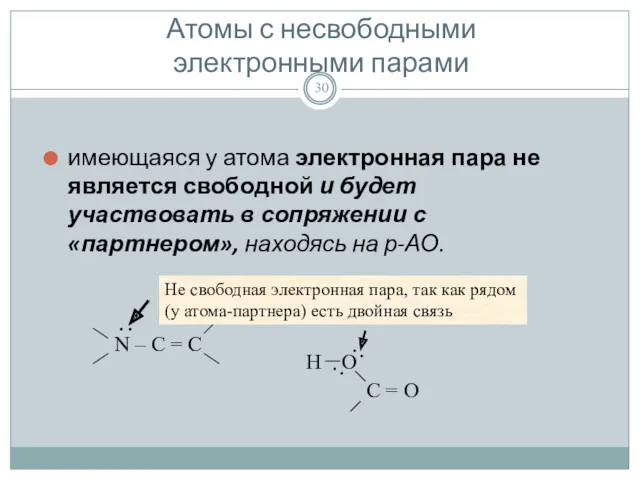
- 30. Атомы с несвободными электронными парами имеющаяся у атома электронная пара не является свободной и будет участвовать
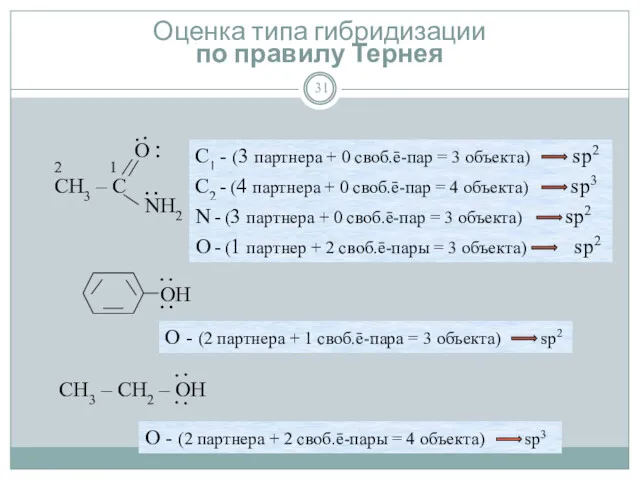
- 31. Оценка типа гибридизации по правилу Тернея ∙ ∙
- 33. Скачать презентацию












 Влияние состава вещества на эффективность таяния льда и замерзания водных растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных растворов Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Основные понятия и законы химии
Основные понятия и законы химии Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Смоги и их влияние на человека
Смоги и их влияние на человека Изомерия. Виды изомерии
Изомерия. Виды изомерии Углерод
Углерод Спирты. Определение. Классификация
Спирты. Определение. Классификация Гидролиз солей
Гидролиз солей Игра - викторина
Игра - викторина Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Crystal defects
Crystal defects Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Химические свойства металлов
Химические свойства металлов В чём соль соли
В чём соль соли Спирты. Классификация спиртов
Спирты. Классификация спиртов Химические свойства металлов. Коррозия металлов
Химические свойства металлов. Коррозия металлов Химические уравнения
Химические уравнения Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Мытье головы
Мытье головы Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Циклические углеводороды
Циклические углеводороды Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы