Содержание
- 2. Химическая связь - Это взаимодействие 2 или нескольких атомов, приводящее к перестройке их электронных оболочек и
- 3. Различают 3 вида межатомной связи: Ковалентная (полярная и неполярная) Ионная Металлическая
- 4. Ионная связь Число электронов на внешнем энергетическом уровне = номеру группы. У атомов элементов металлов на
- 5. Схема образования ионной связи Х (отдает электроны) + У (принимает электроны) = ХУ Х – металл
- 6. Ионы - Заряженные частицы, полученные из атомов путем присоединения или отдачи электронов. Каждый ион имеет заряд,
- 7. Ковалентная связь Полярная Образуется между атомами разных элементов Неполярная Образуется между атомами одного элемента
- 8. Ковалентная неполярная связь образуется по средствам общей электронной пары
- 9. Механизм образования ковалентной неполярной связи: 1. Записать знак элемента. Определить по номеру группы число электронов на
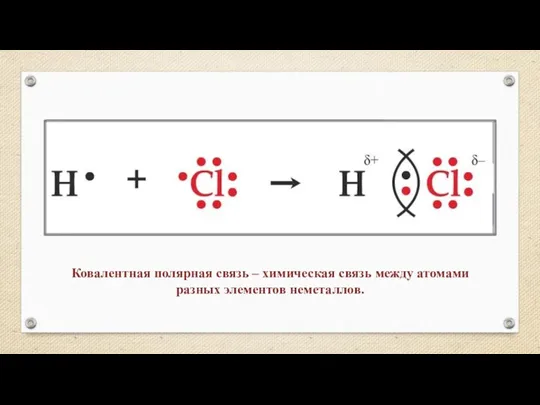
- 10. Ковалентная полярная химическая связь Электроотрицательность (ЭО) – способность атомов химических элементов смещать к себе общие электронные
- 11. Самый электроотрицательный элемент в ПС – фтор!
- 12. Ковалентная полярная связь – химическая связь между атомами разных элементов неметаллов.
- 13. Алгоритм записи ковалентной полярной связи: 1. Составить схему строения атома химического элемента и его электронную формулу.
- 14. Металлическая связь Это связь в металлах и сплавах между ионами атомов по средствам обобщенных электронов. Металлическая
- 15. Домашнее задание: Записать в тетрадь таблицу Записать механизм образования связи следующих молекул: O2, N2, KCl, H2S
- 17. Скачать презентацию













 Элементы группы галогенов
Элементы группы галогенов Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов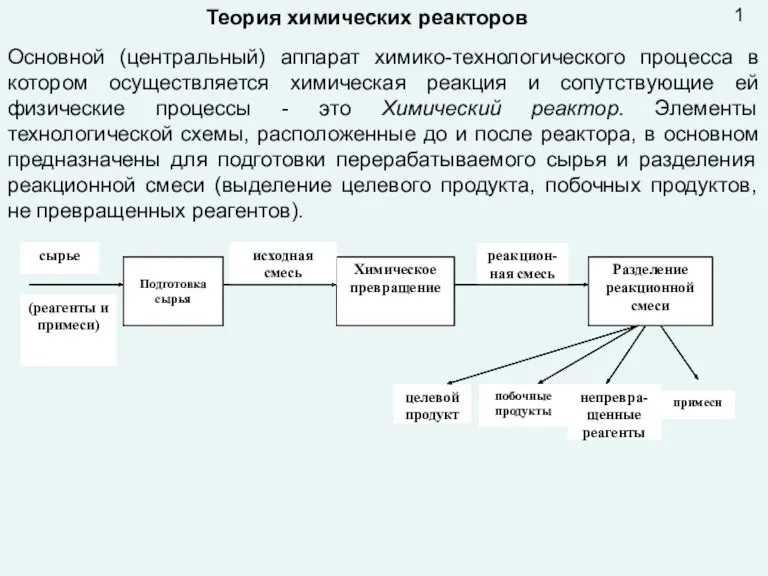 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Три кити нанохімії
Три кити нанохімії Углепластики
Углепластики Растворы. Концентрация растворов
Растворы. Концентрация растворов Арены. Бензол
Арены. Бензол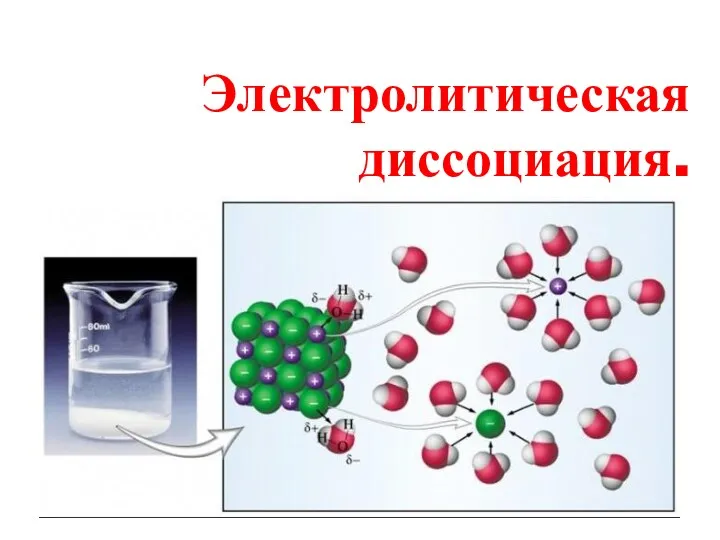 Электролитическая диссоциация
Электролитическая диссоциация Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Закон сохранения массы вещества
Закон сохранения массы вещества Жесткость воды
Жесткость воды Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Склад і властивості нафти
Склад і властивості нафти Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Основания. Названия оснований
Основания. Названия оснований Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Обмен липидов-1
Обмен липидов-1 Химическая реакция. Признаки химической реакции. Химические и нехимические явления
Химическая реакция. Признаки химической реакции. Химические и нехимические явления Классификация и свойства оксидов
Классификация и свойства оксидов