Содержание
- 2. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 3. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
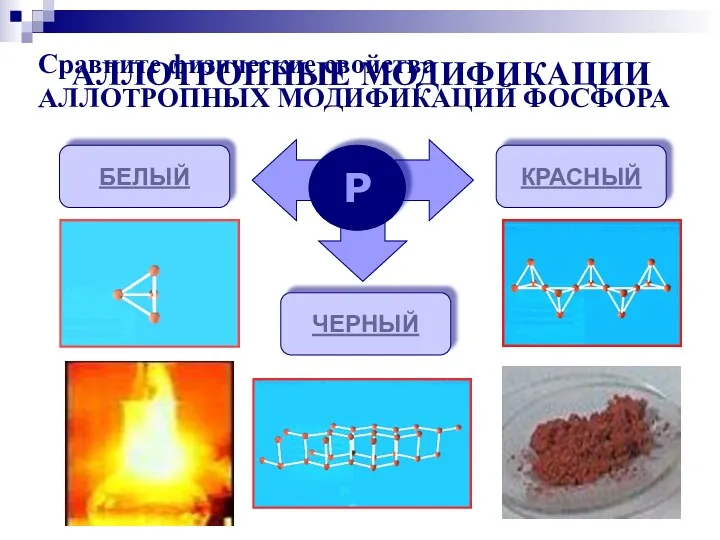
- 4. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 5. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
- 6. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
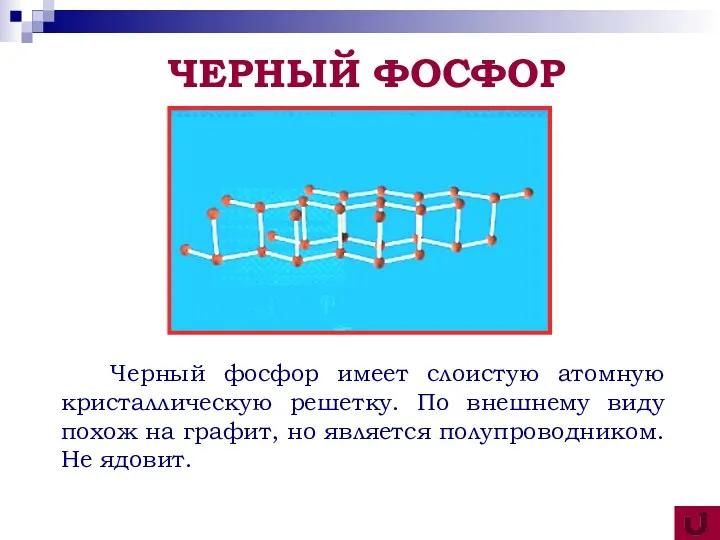
- 7. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 8. С металлами: Ca + P = C неметаллами: P + O2 = P + S =
- 9. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
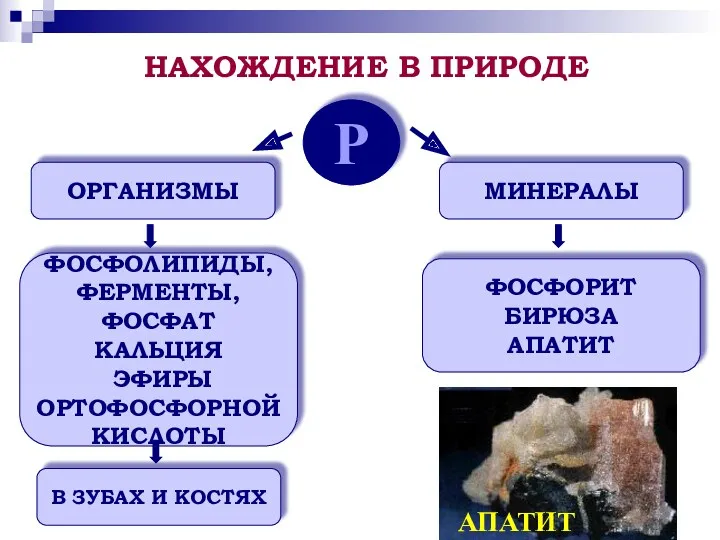
- 10. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 11. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
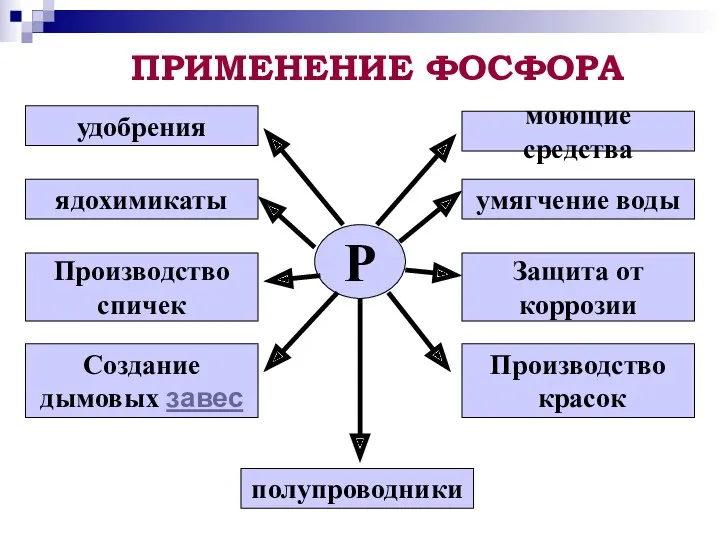
- 12. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 14. Скачать презентацию







 Металлы
Металлы Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Углеводы - 2
Углеводы - 2 Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) Генетическая связь между классами неорганических веществ. Химический тренажёр
Генетическая связь между классами неорганических веществ. Химический тренажёр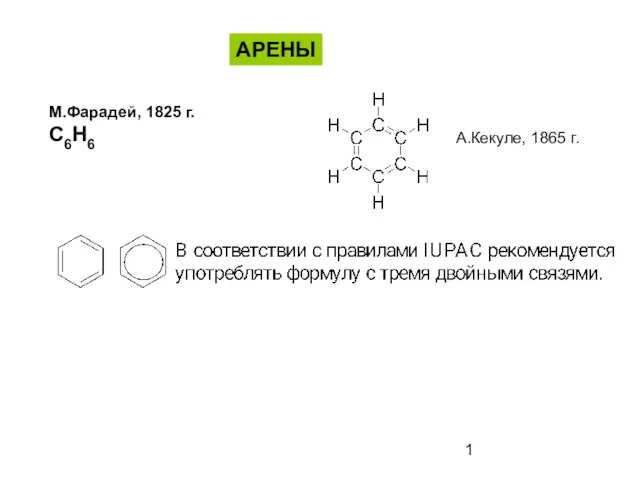 Ароматические соединения - арены
Ароматические соединения - арены Диффузия вокруг нас
Диффузия вокруг нас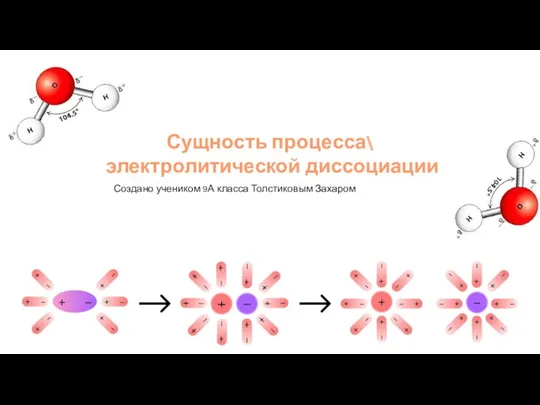 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Строение и функции биополимеров
Строение и функции биополимеров Aditivii alimentari: inofensivi sau poluanţi
Aditivii alimentari: inofensivi sau poluanţi Арены. Бензол
Арены. Бензол Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Электролиз. Электролизеры
Электролиз. Электролизеры Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации) Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Enantioselective Total Synthesis
Enantioselective Total Synthesis Аминокислоты и белки. 9 класс
Аминокислоты и белки. 9 класс Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Общая характеристика неметаллов
Общая характеристика неметаллов Летучие органические соединения (ЛОС)
Летучие органические соединения (ЛОС) Применение спиртов
Применение спиртов Горечи. Лекция 3
Горечи. Лекция 3 Химические свойства кислот
Химические свойства кислот Пластмаси. Пластичні маси
Пластмаси. Пластичні маси