Содержание
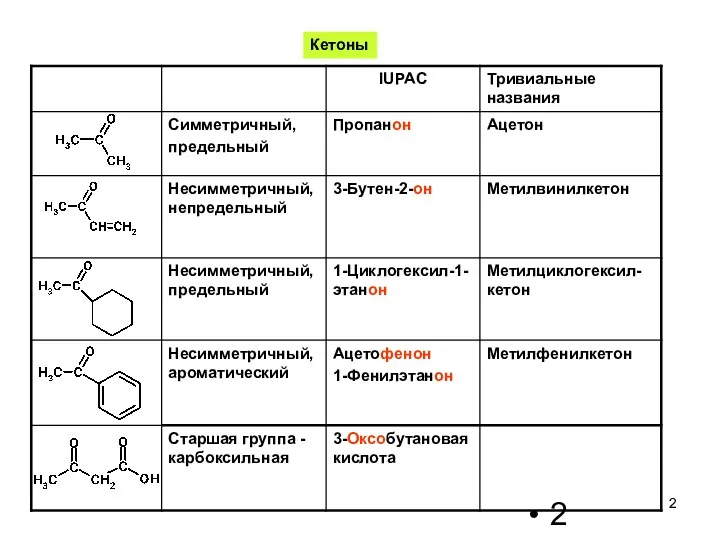
- 2. Кетоны
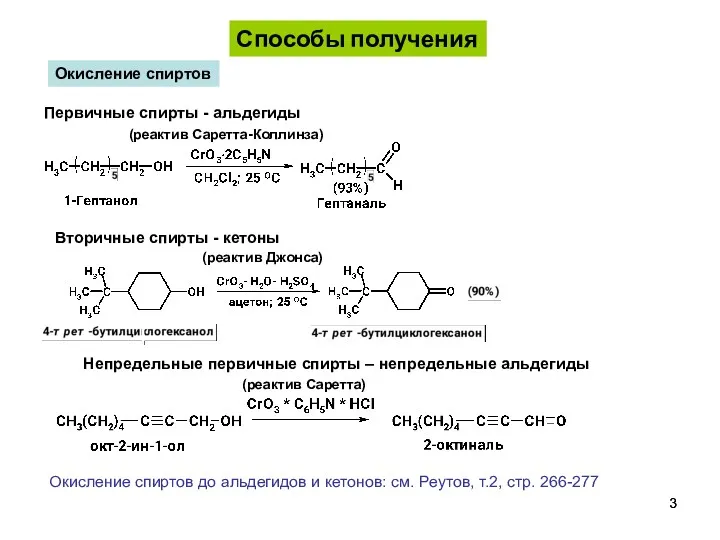
- 3. Способы получения Окисление спиртов Первичные спирты - альдегиды (реактив Саретта-Коллинза) Вторичные спирты - кетоны Непредельные первичные
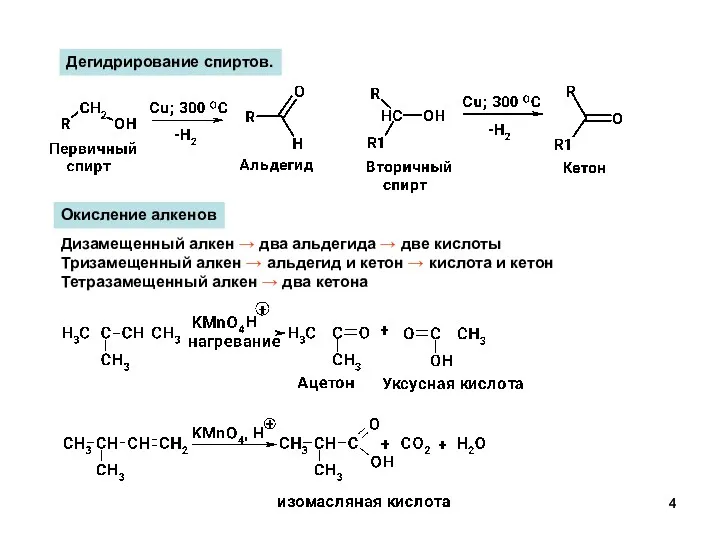
- 4. Дегидрирование спиртов. Окисление алкенов Дизамещенный алкен → два альдегида → две кислоты Тризамещенный алкен → альдегид
- 5. Дизамещенный алкен – два альдегида Тризамещенный алкен – альдегид и кетон Тетразамещенный алкен – два кетона
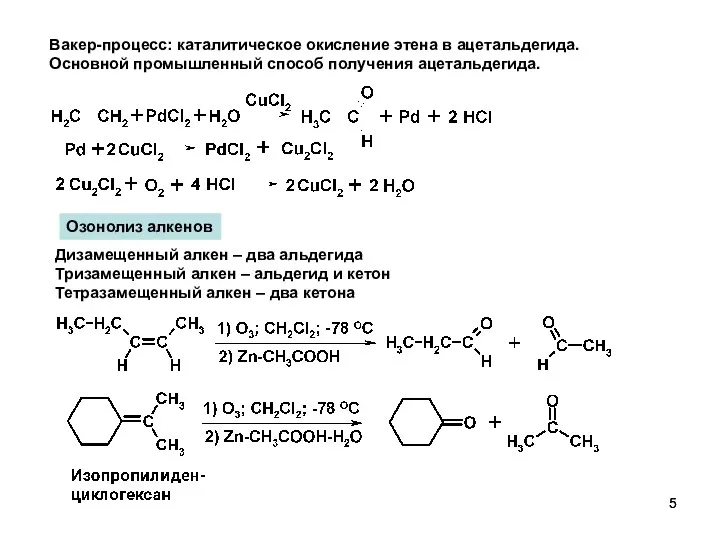
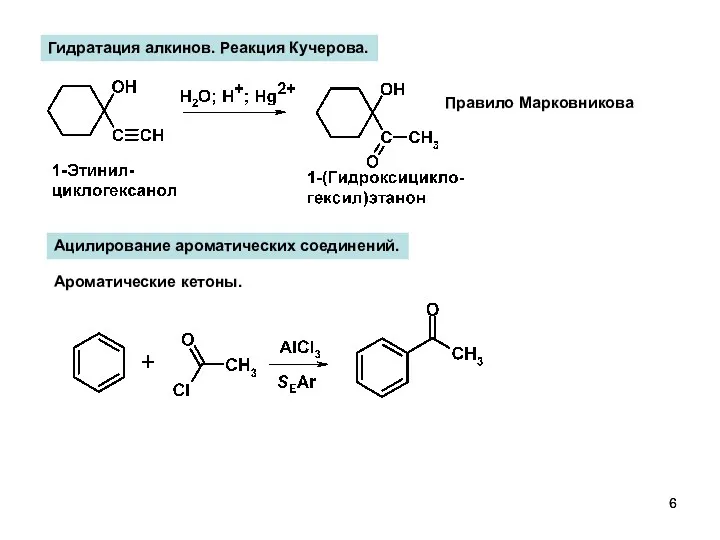
- 6. Гидратация алкинов. Реакция Кучерова. Правило Марковникова Ацилирование ароматических соединений. Ароматические кетоны.
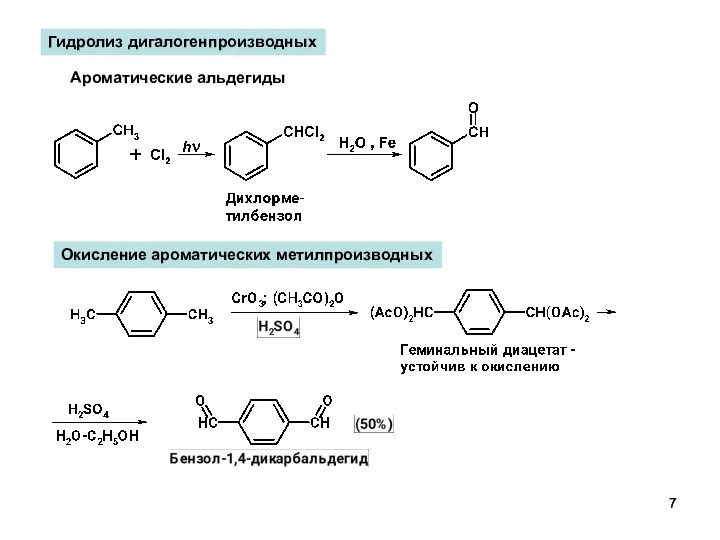
- 7. Гидролиз дигалогенпроизводных Ароматические альдегиды Окисление ароматических метилпроизводных
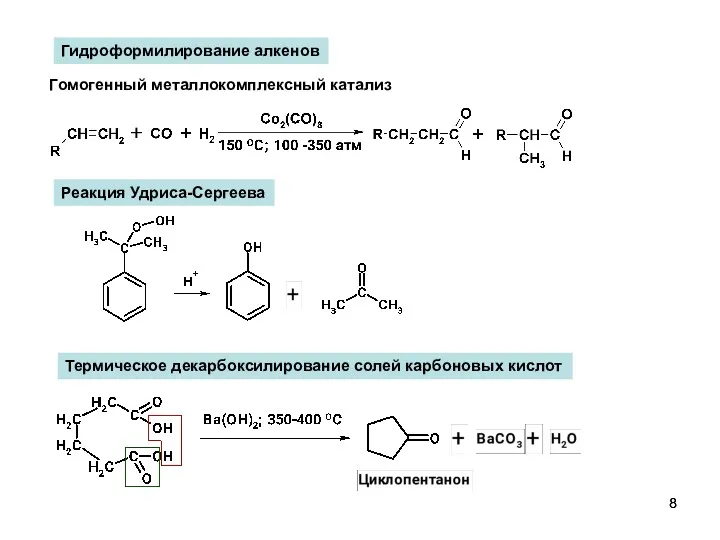
- 8. Гидроформилирование алкенов Гомогенный металлокомплексный катализ Реакция Удриса-Сергеева Термическое декарбоксилирование солей карбоновых кислот
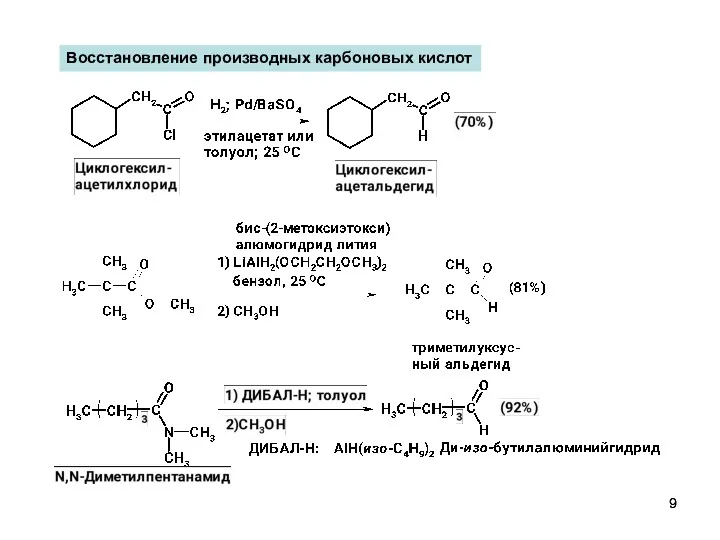
- 9. Восстановление производных карбоновых кислот
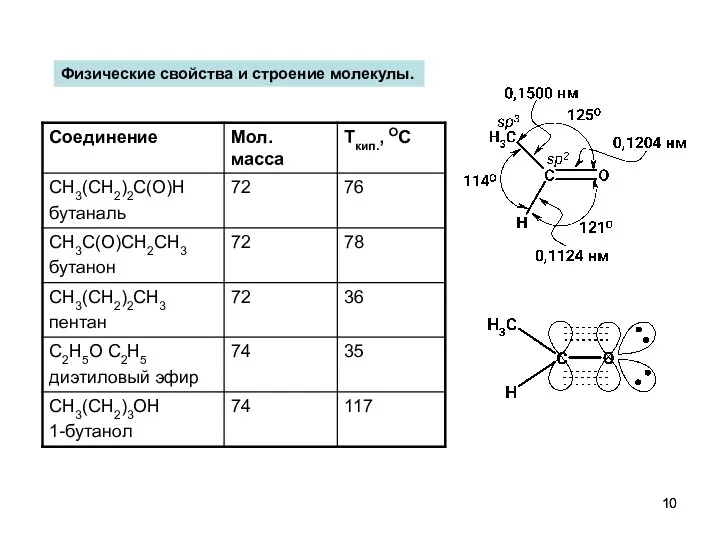
- 10. Физические свойства и строение молекулы.
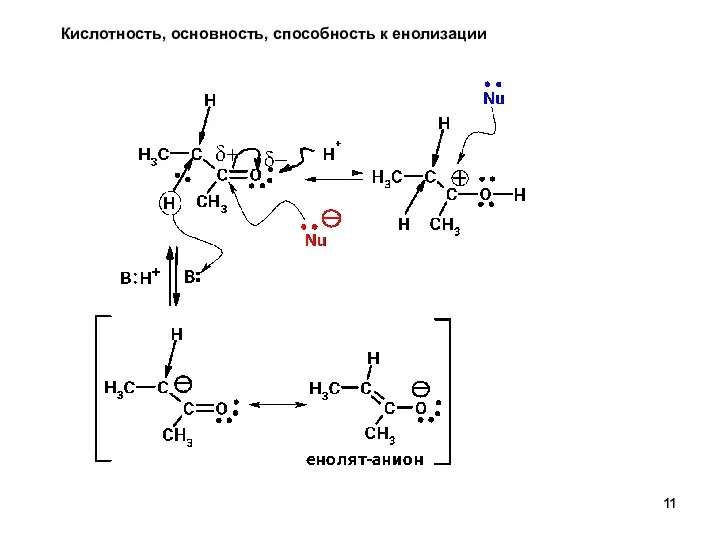
- 11. Кислотность, основность, способность к енолизации
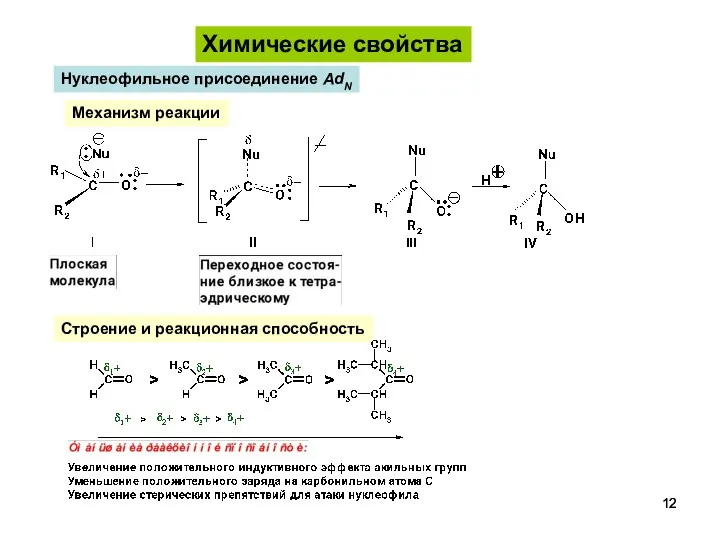
- 12. Химические свойства Нуклеофильное присоединение AdN Строение и реакционная способность Механизм реакции
- 13. Присоединение цианид-иона. Образование циангидринов. Механизм AdN2 v=k[CC=O] [CСN-]
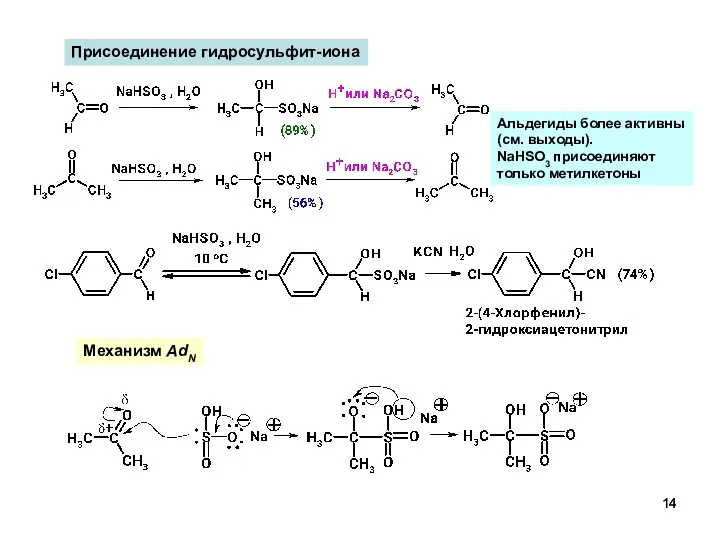
- 14. Присоединение гидросульфит-иона Механизм AdN Альдегиды более активны (см. выходы). NaHSO3 присоединяют только метилкетоны
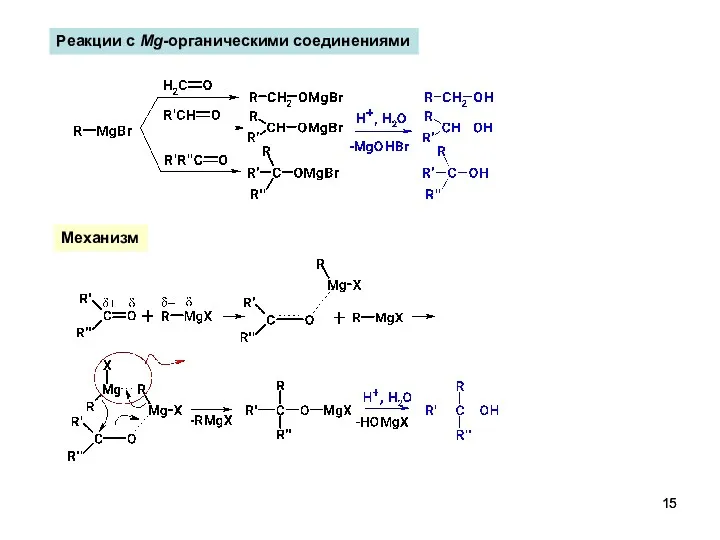
- 15. Реакции с Mg-органическими соединениями Механизм
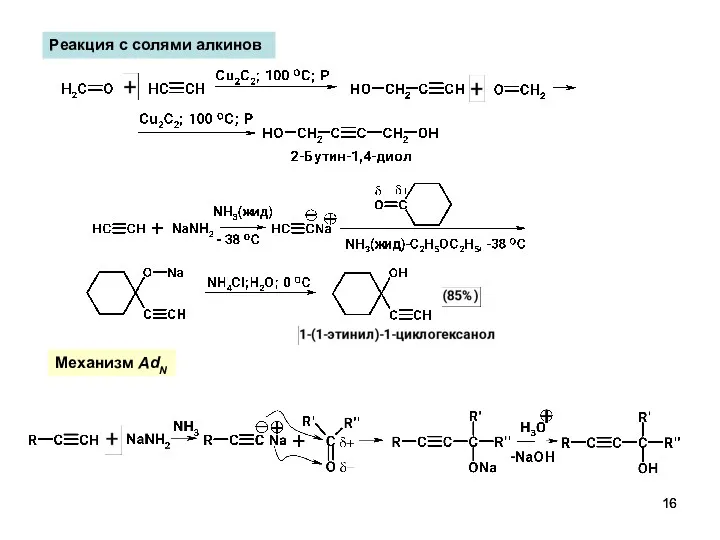
- 16. Реакция с солями алкинов Механизм AdN
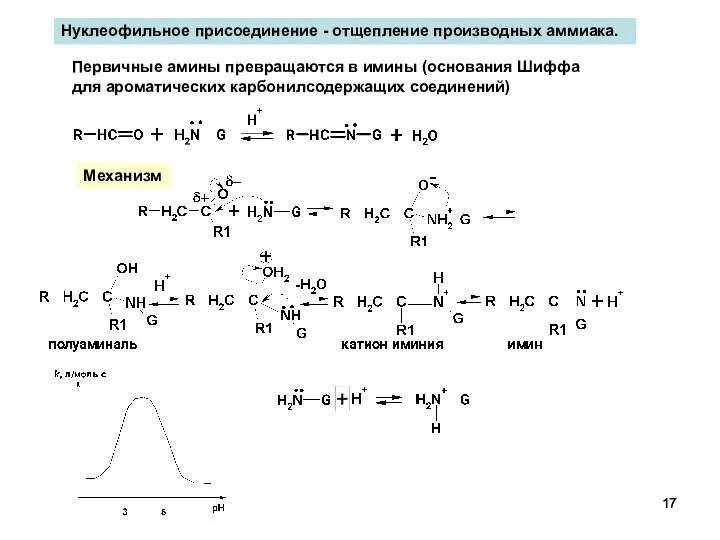
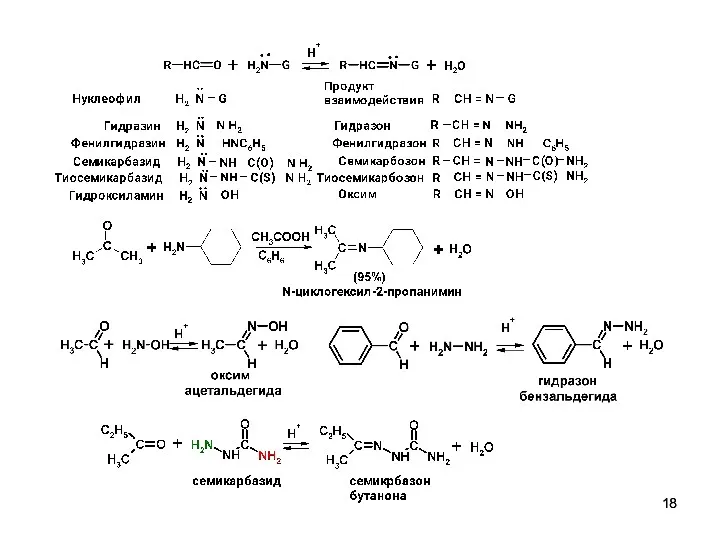
- 17. Нуклеофильное присоединение - отщепление производных аммиака. Первичные амины превращаются в имины (основания Шиффа для ароматических карбонилсодержащих
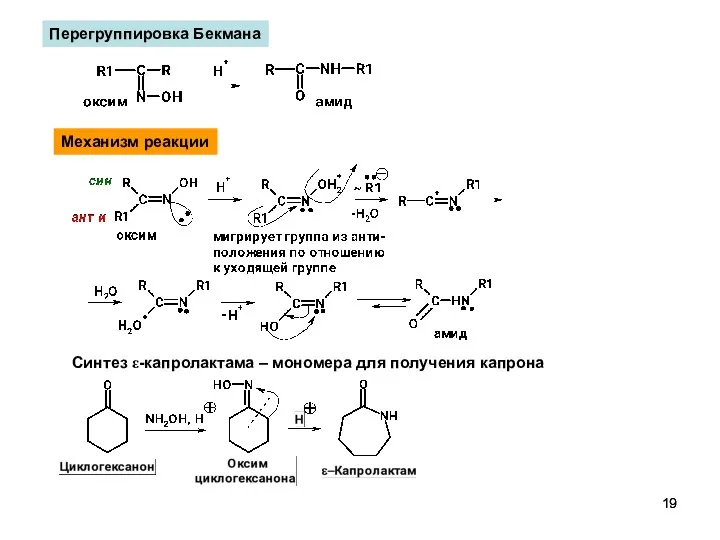
- 19. Перегруппировка Бекмана Синтез ε-капролактама – мономера для получения капрона Механизм реакции
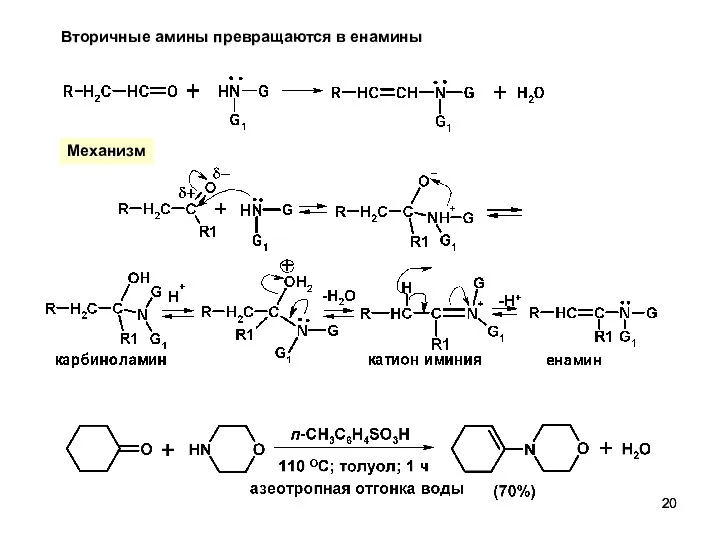
- 20. Вторичные амины превращаются в енамины Механизм
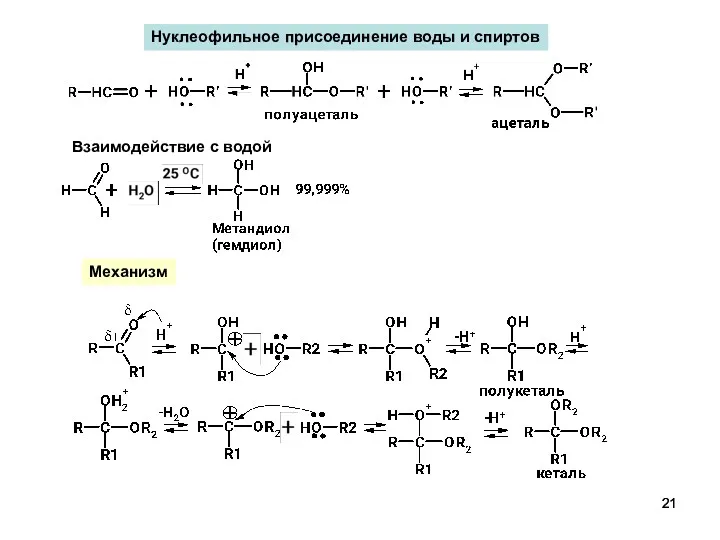
- 21. Нуклеофильное присоединение воды и спиртов Взаимодействие с водой Механизм
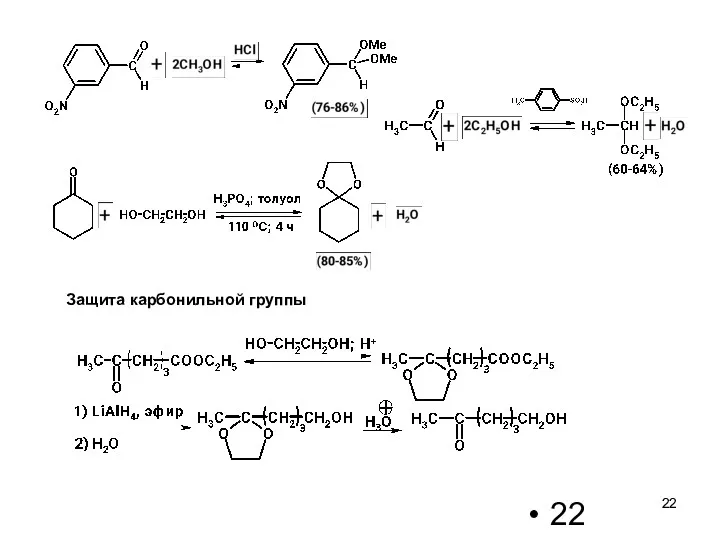
- 22. Защита карбонильной группы
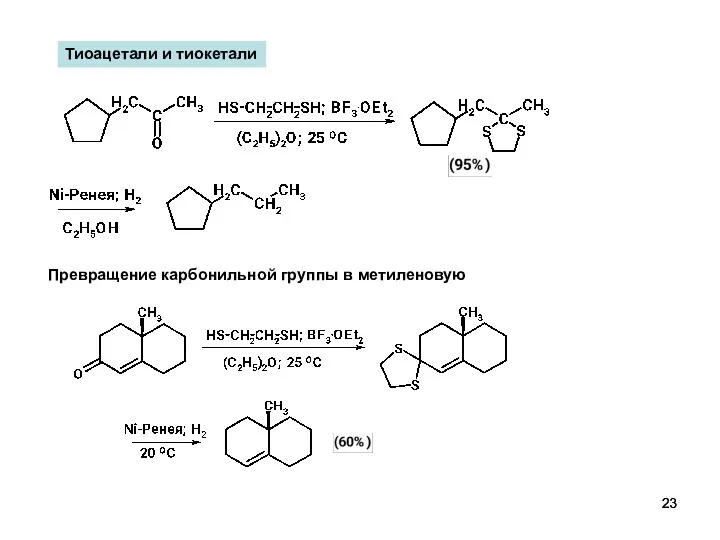
- 23. Тиоацетали и тиокетали Превращение карбонильной группы в метиленовую
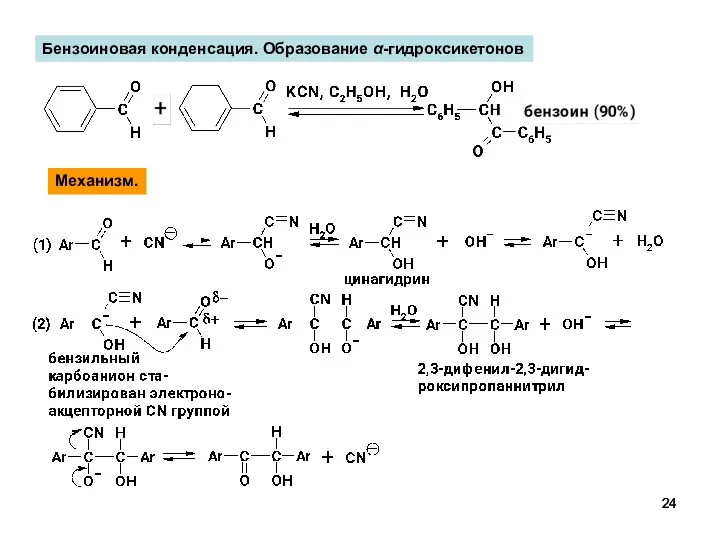
- 24. Бензоиновая конденсация. Образование α-гидроксикетонов Механизм.
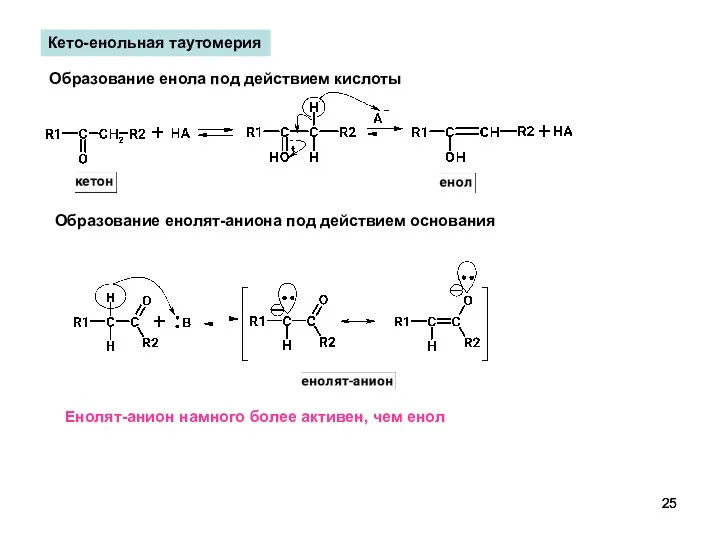
- 25. Кето-енольная таутомерия Образование енола под действием кислоты Образование енолят-аниона под действием основания Енолят-анион намного более активен,
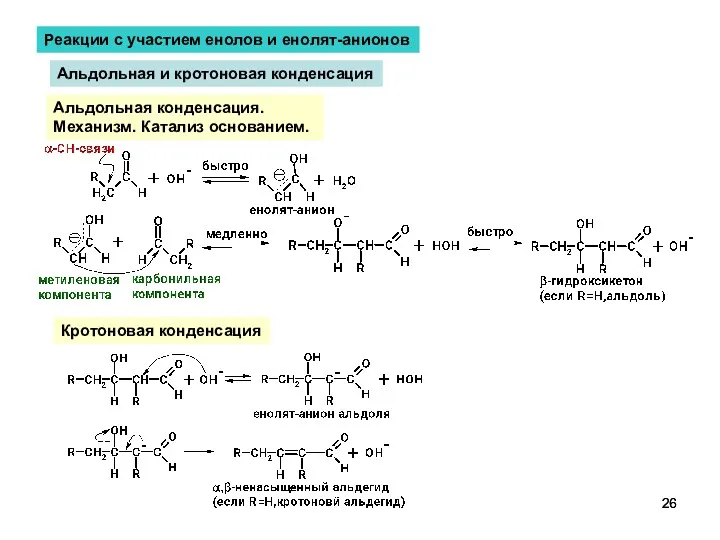
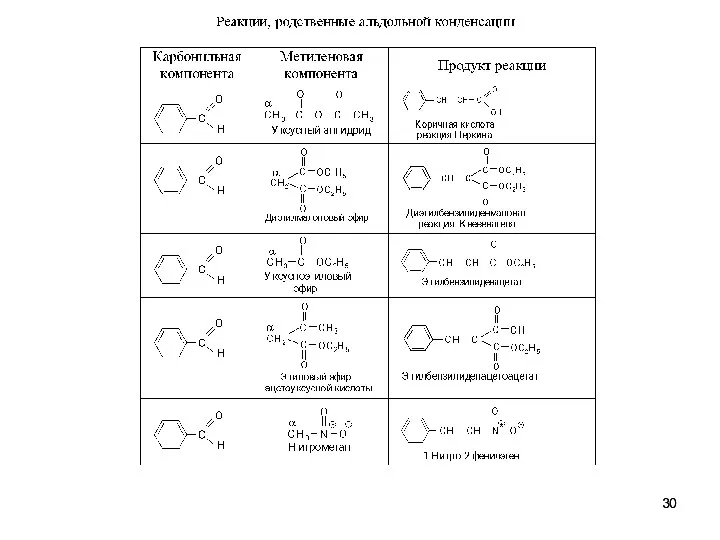
- 26. Реакции с участием енолов и енолят-анионов Альдольная и кротоновая конденсация Альдольная конденсация. Механизм. Катализ основанием. Кротоновая
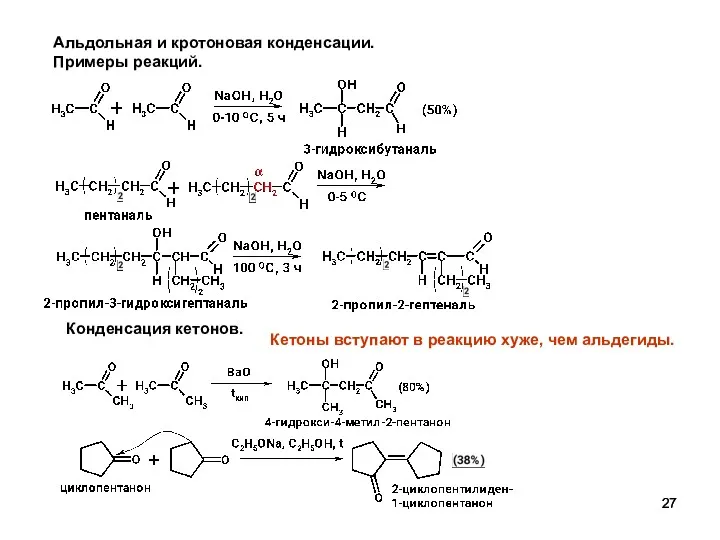
- 27. Альдольная и кротоновая конденсации. Примеры реакций. Конденсация кетонов. Кетоны вступают в реакцию хуже, чем альдегиды.
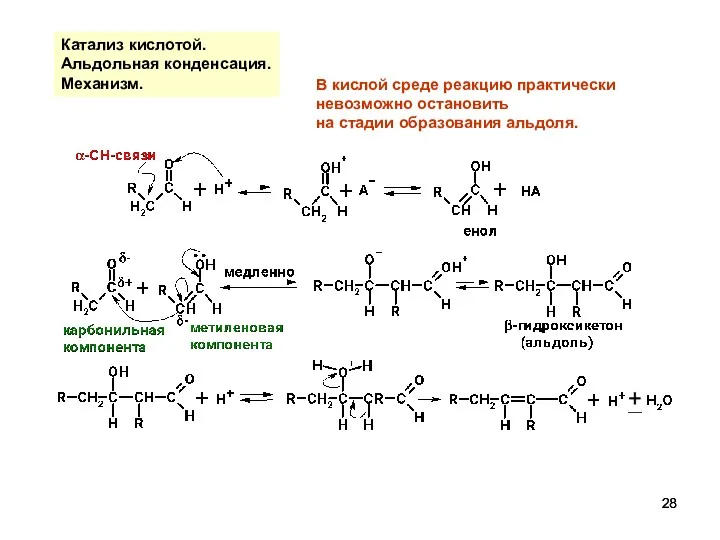
- 28. Катализ кислотой. Альдольная конденсация. Механизм. В кислой среде реакцию практически невозможно остановить на стадии образования альдоля.
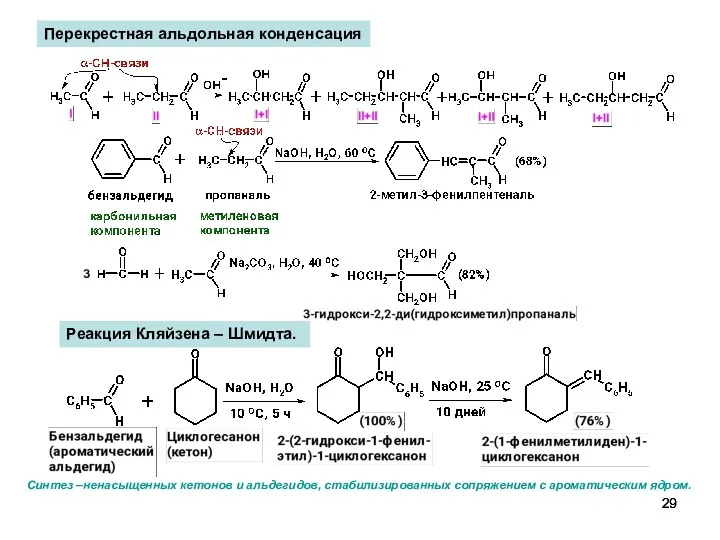
- 29. Перекрестная альдольная конденсация Реакция Кляйзена – Шмидта. Синтез –ненасыщенных кетонов и альдегидов, стабилизированных сопряжением с ароматическим
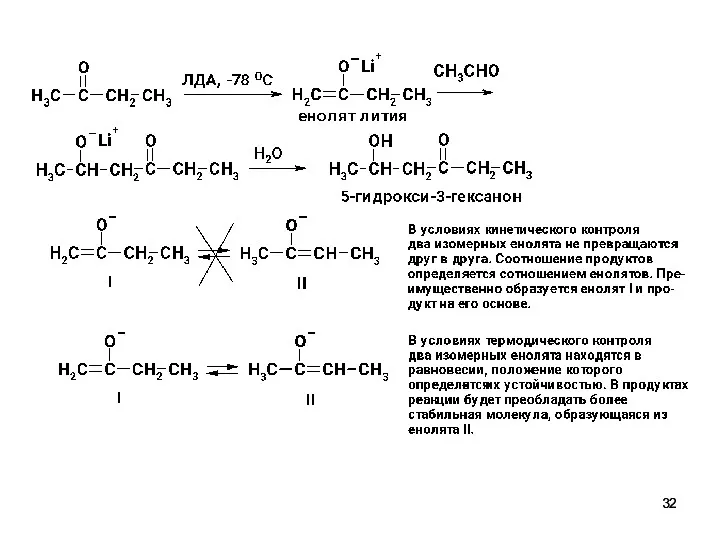
- 31. Региоселективная перекрестная альдольная конденсация В условиях кинетического контроля (низкая температура), применения апротонного растворителя и стерически затрудненного
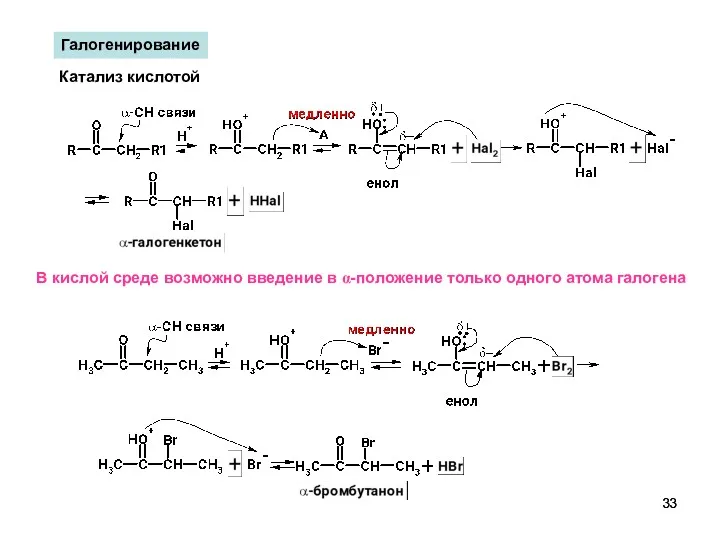
- 33. Галогенирование Катализ кислотой В кислой среде возможно введение в α-положение только одного атома галогена
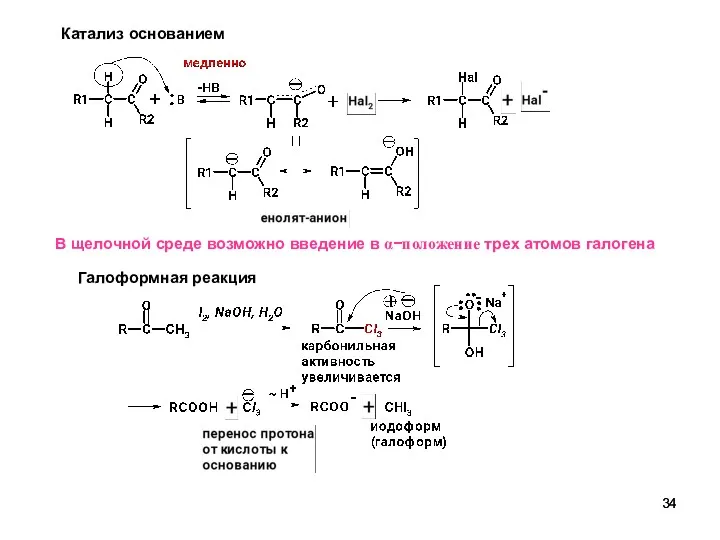
- 34. Катализ основанием В щелочной среде возможно введение в α−положение трех атомов галогена Галоформная реакция
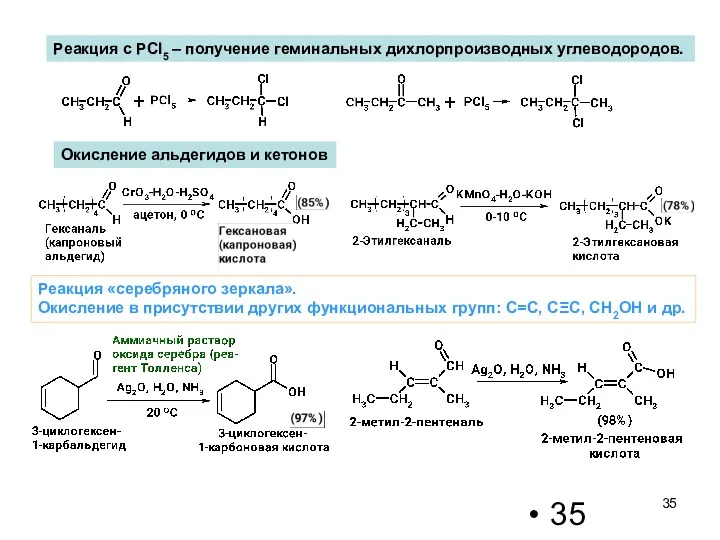
- 35. Окисление альдегидов и кетонов Реакция с PCl5 – получение геминальных дихлорпроизводных углеводородов. Реакция «серебряного зеркала». Окисление
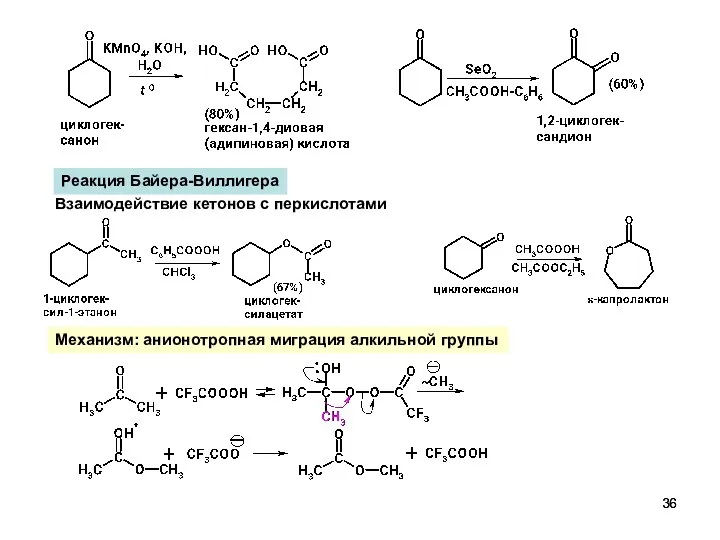
- 36. Реакция Байера-Виллигера Взаимодействие кетонов с перкислотами Механизм: анионотропная миграция алкильной группы
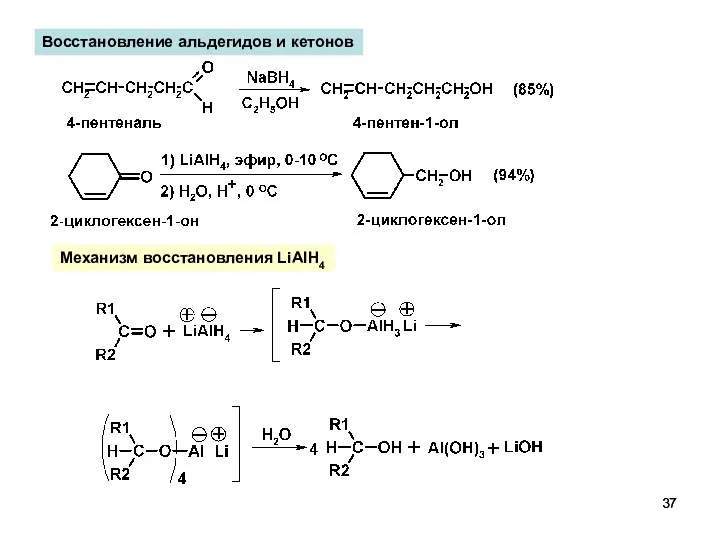
- 37. Восстановление альдегидов и кетонов Механизм восстановления LiAlH4
- 38. Реакция С.Канницаро (окисление-восстановление) Альдегиды, не имеющие α-C-H-связей, в присутствии щелочи подвергаются реакции диспропорционирования: Механизм v=k[ArCHO]2.[OH- ]
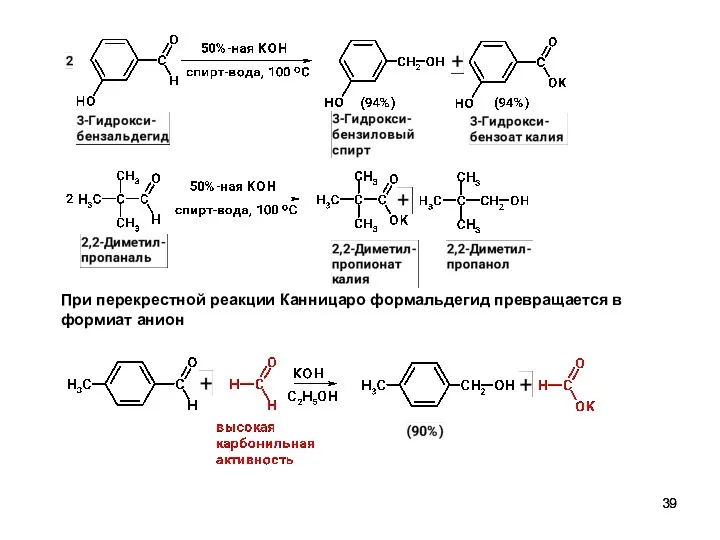
- 39. При перекрестной реакции Канницаро формальдегид превращается в формиат анион
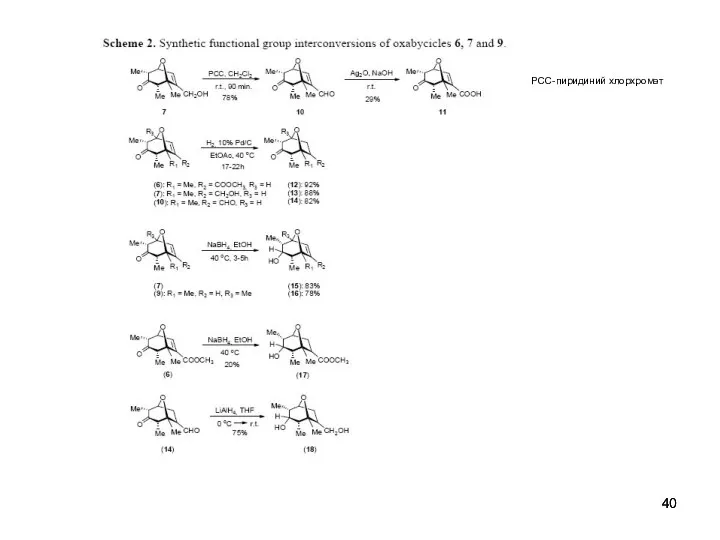
- 40. PCC-пиридиний хлорхромат
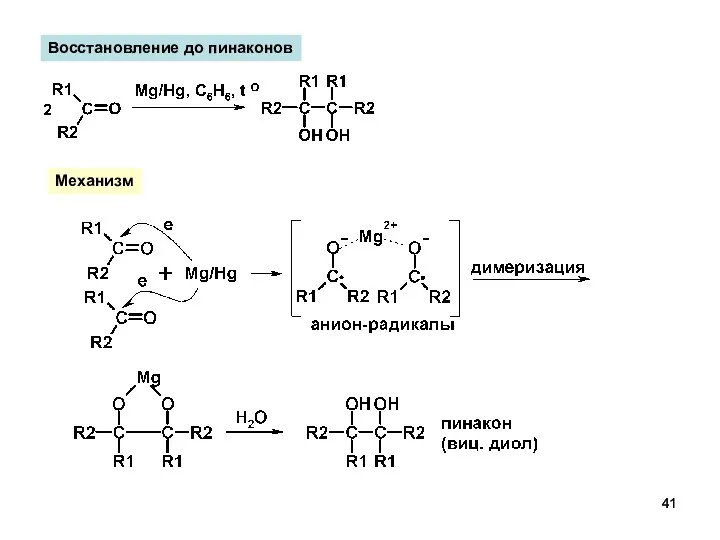
- 41. Восстановление до пинаконов Механизм
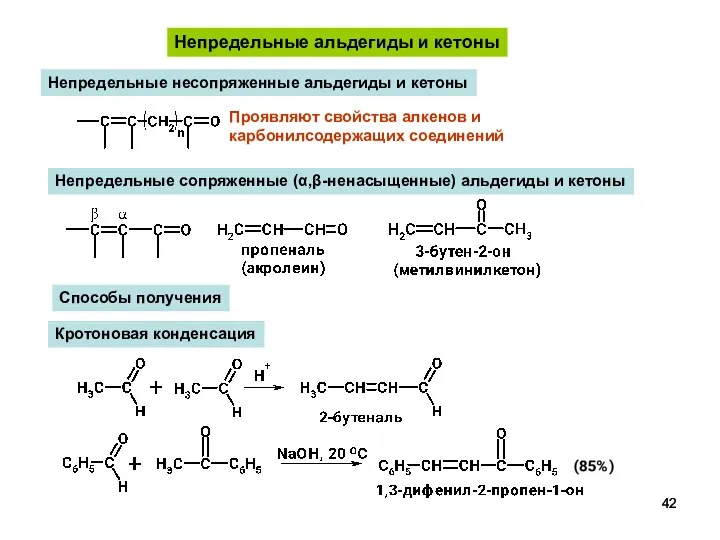
- 42. Непредельные альдегиды и кетоны Непредельные несопряженные альдегиды и кетоны Проявляют свойства алкенов и карбонилсодержащих соединений Непредельные
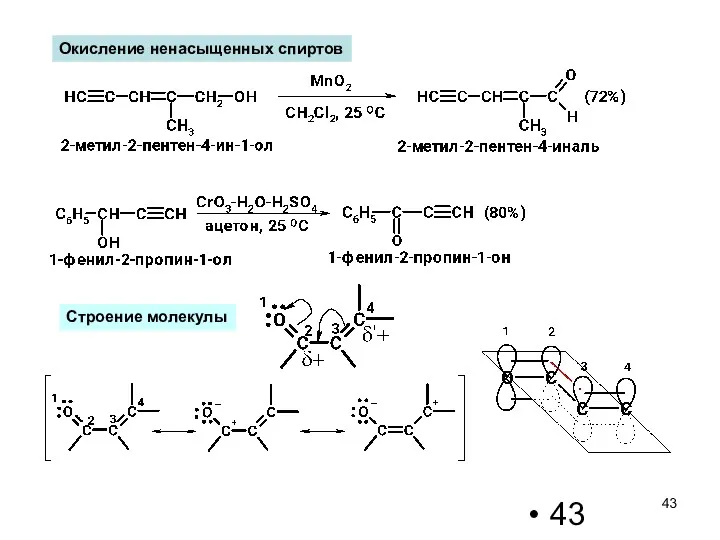
- 43. Окисление ненасыщенных спиртов Строение молекулы
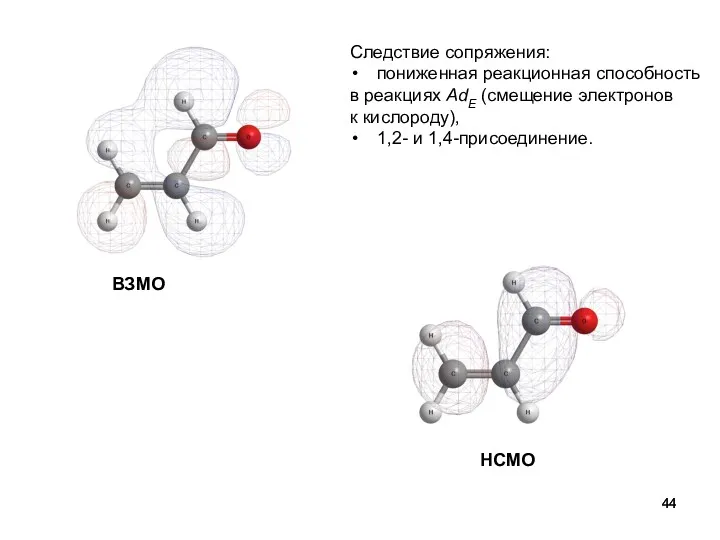
- 44. ВЗМО НСМО Следствие сопряжения: пониженная реакционная способность в реакциях AdE (смещение электронов к кислороду), 1,2- и
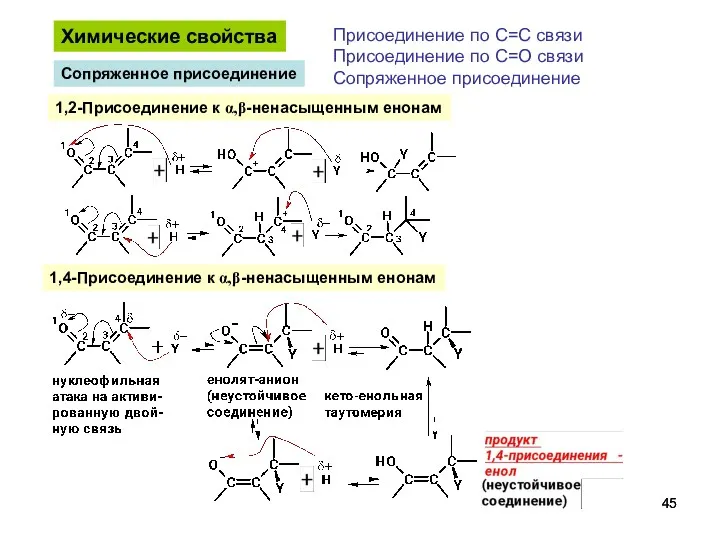
- 45. Химические свойства Присоединение по С=С связи Присоединение по С=О связи Сопряженное присоединение 1,2-Присоединение к α,β-ненасыщенным енонам
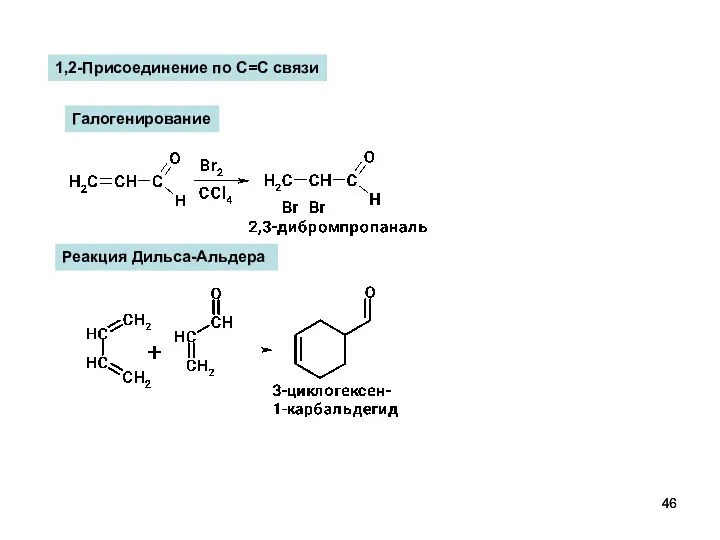
- 46. Реакция Дильса-Альдера Галогенирование 1,2-Присоединение по С=С связи
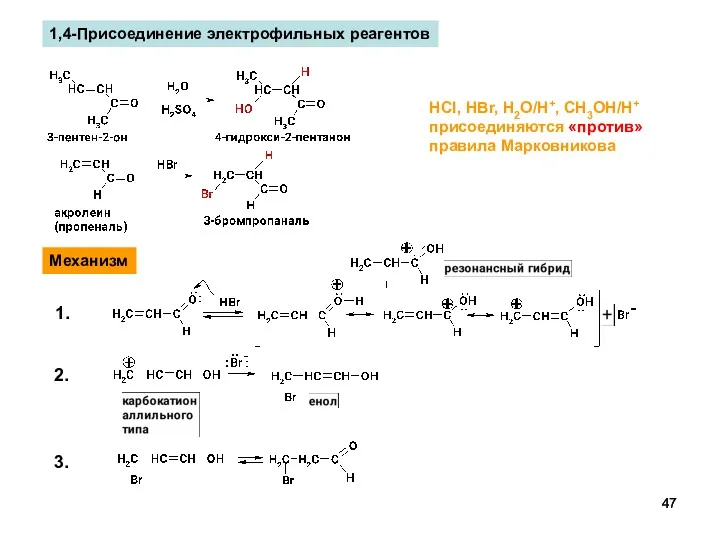
- 47. 1,4-Присоединение электрофильных реагентов HCl, HBr, H2O/H+, CH3OH/H+ присоединяются «против» правила Марковникова Механизм 1. 2. 3.
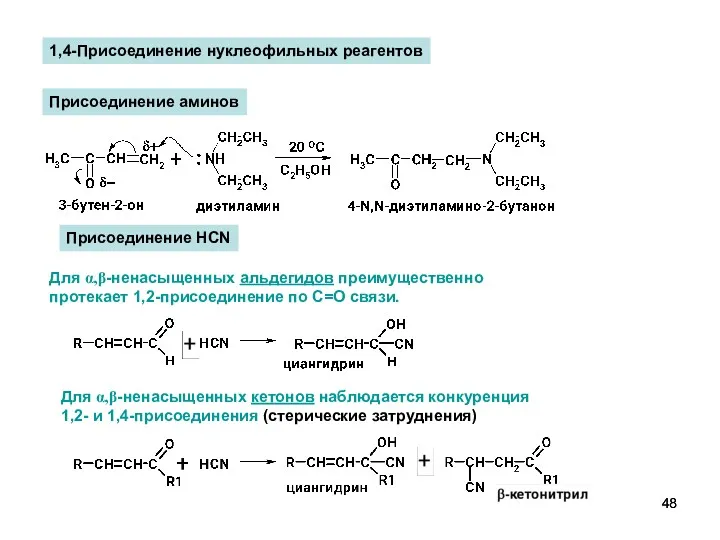
- 48. Присоединение HCN Для α,β-ненасыщенных альдегидов преимущественно протекает 1,2-присоединение по С=О связи. Для α,β-ненасыщенных кетонов наблюдается конкуренция
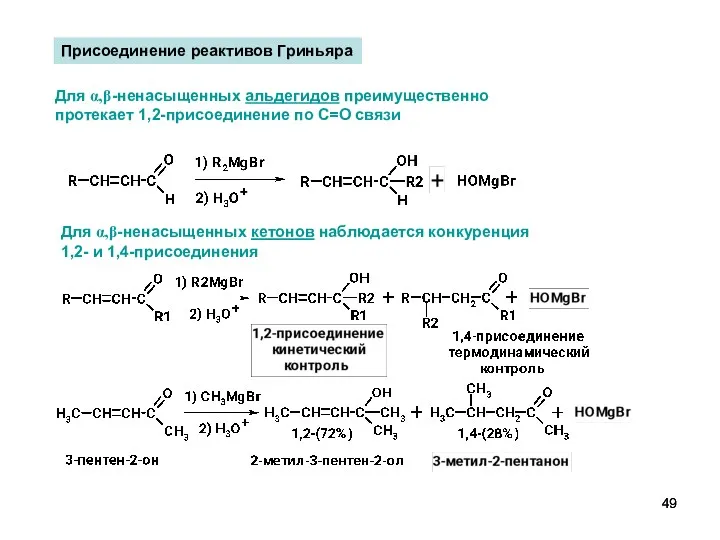
- 49. Для α,β-ненасыщенных кетонов наблюдается конкуренция 1,2- и 1,4-присоединения Присоединение реактивов Гриньяра Для α,β-ненасыщенных альдегидов преимущественно протекает
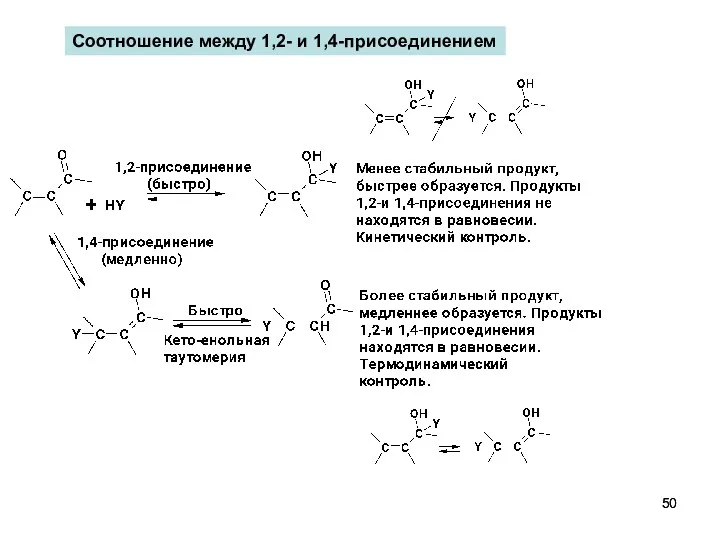
- 50. Соотношение между 1,2- и 1,4-присоединением
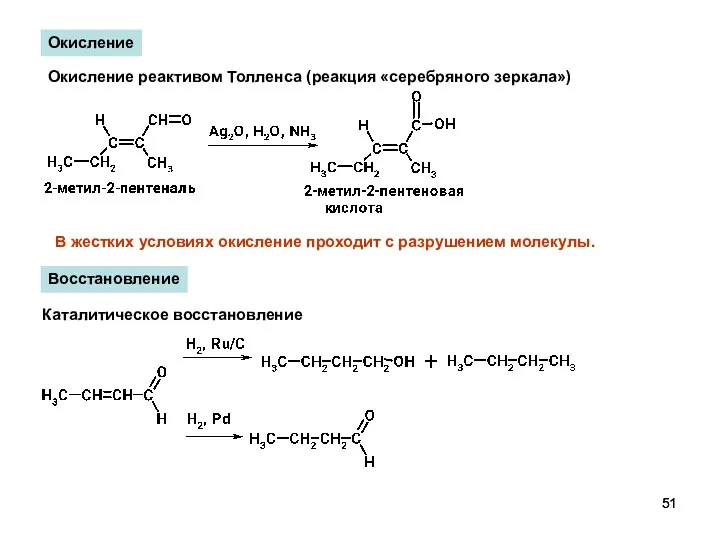
- 51. Окисление Окисление реактивом Толленса (реакция «серебряного зеркала») В жестких условиях окисление проходит с разрушением молекулы. Восстановление
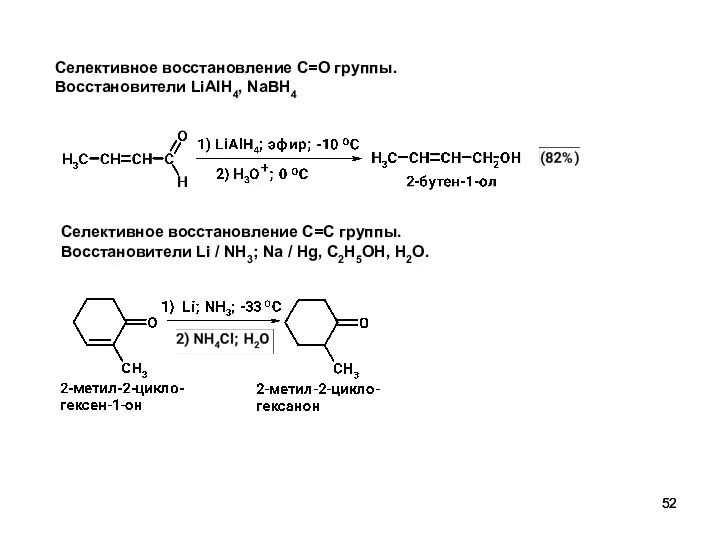
- 52. Селективное восстановление C=O группы. Восстановители LiAlH4, NaBH4 Селективное восстановление C=С группы. Восстановители Li / NH3; Na
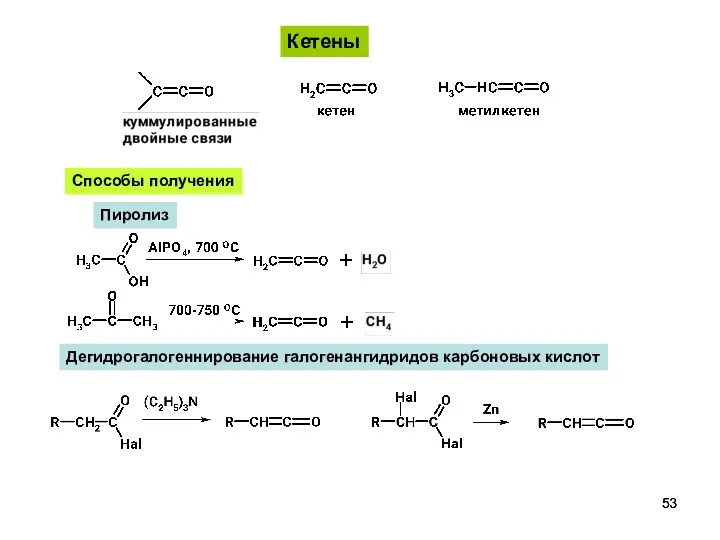
- 53. Кетены Способы получения Пиролиз Дегидрогалогеннирование галогенангидридов карбоновых кислот
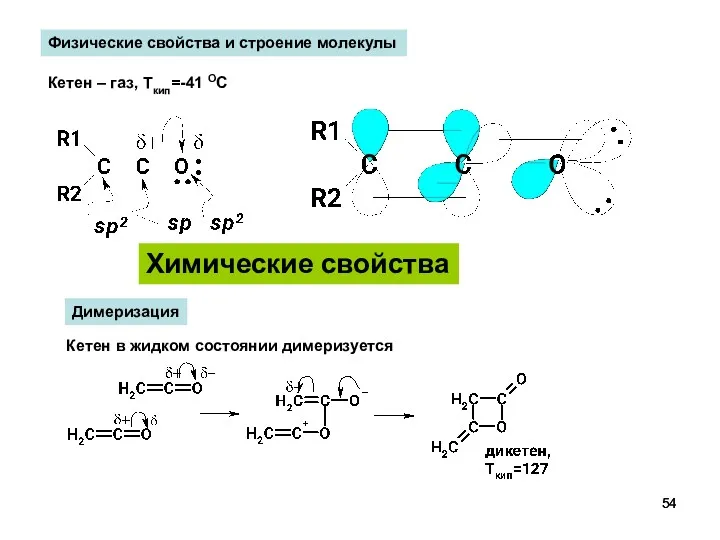
- 54. Химические свойства Физические свойства и строение молекулы Кетен – газ, Ткип=-41 ОС Димеризация Кетен в жидком
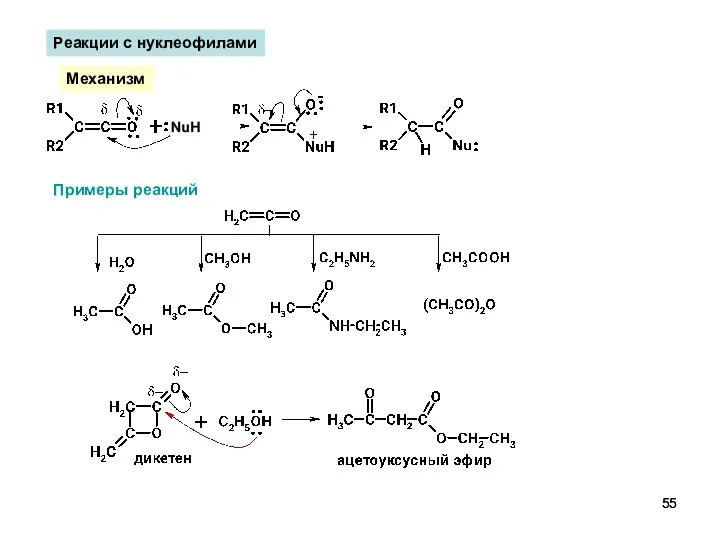
- 55. Реакции с нуклеофилами Механизм Примеры реакций
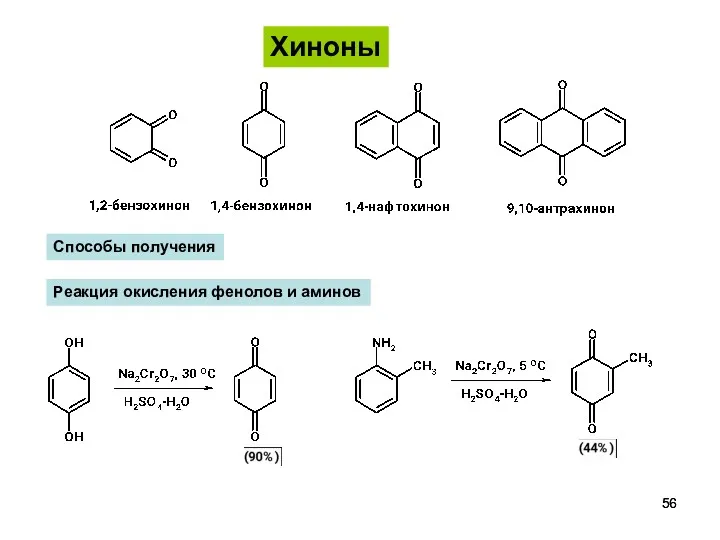
- 56. Хиноны Способы получения Реакция окисления фенолов и аминов
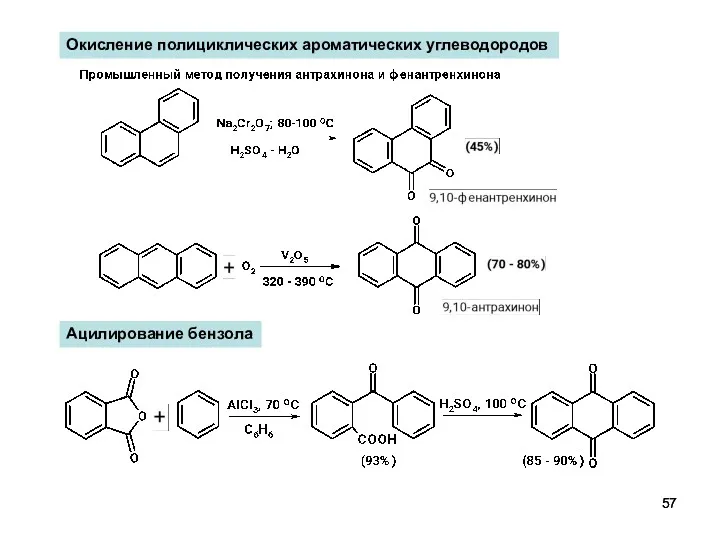
- 57. Окисление полициклических ароматических углеводородов Ацилирование бензола
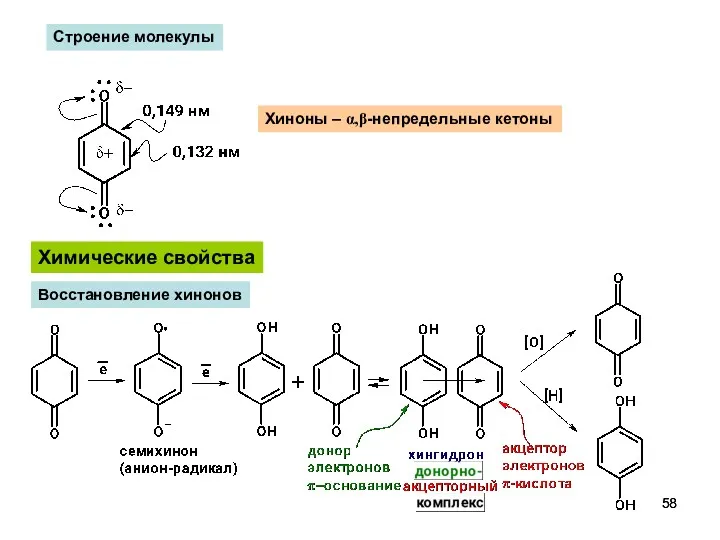
- 58. Химические свойства Восстановление хинонов Хиноны – α,β-непредельные кетоны Строение молекулы
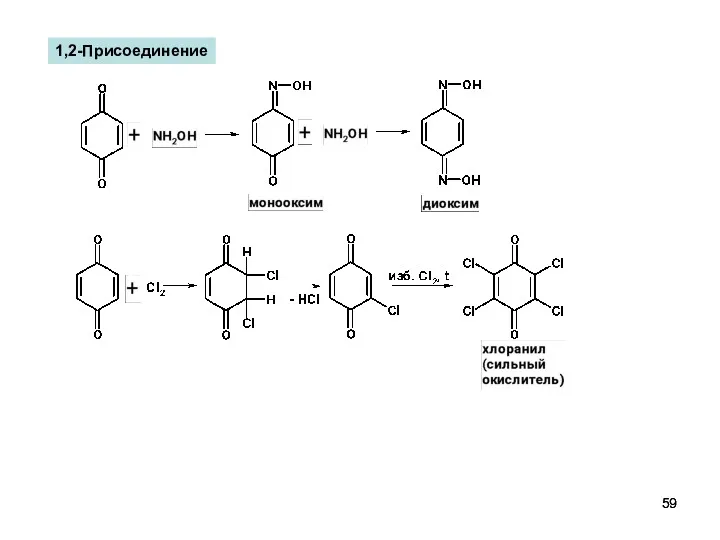
- 59. 1,2-Присоединение
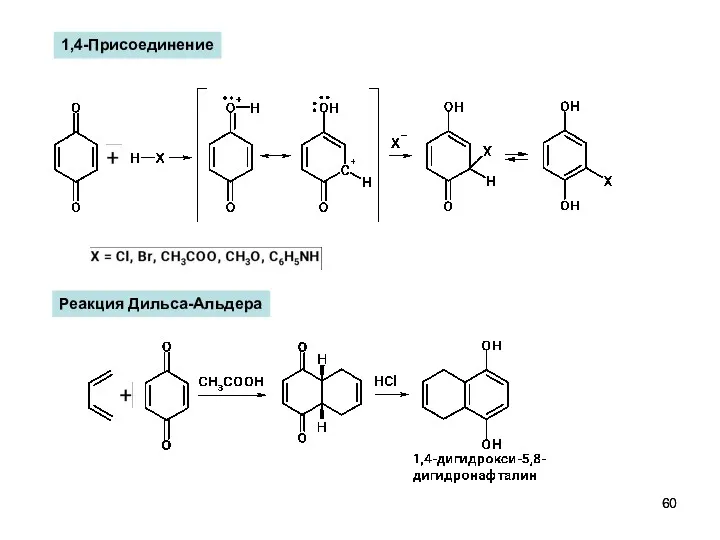
- 60. 1,4-Присоединение Реакция Дильса-Альдера
- 62. Скачать презентацию
![Присоединение цианид-иона. Образование циангидринов. Механизм AdN2 v=k[CC=O] [CСN-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/283454/slide-12.jpg)

![Реакция С.Канницаро (окисление-восстановление) Альдегиды, не имеющие α-C-H-связей, в присутствии щелочи подвергаются реакции диспропорционирования: Механизм v=k[ArCHO]2.[OH- ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/283454/slide-37.jpg)
 Химия нефти и газа
Химия нефти и газа Ацидиметрия. Стандартизация
Ацидиметрия. Стандартизация Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31
Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31 Геохимические показатели техногенеза
Геохимические показатели техногенеза Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов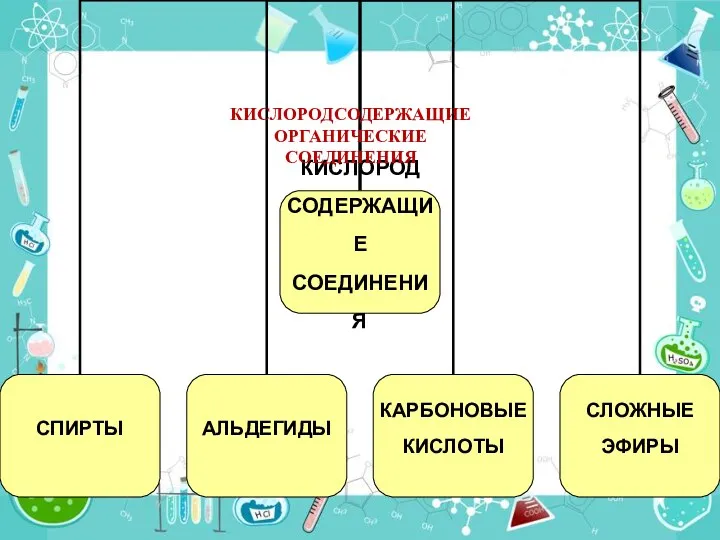 Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс альдегиды, свойства, получение
альдегиды, свойства, получение Углерод, аллотропные модификации
Углерод, аллотропные модификации Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Что такое алмаз
Что такое алмаз Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических Алкадиены
Алкадиены Азотная кислота и ее соли
Азотная кислота и ее соли Синтетические моющие средства
Синтетические моющие средства Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14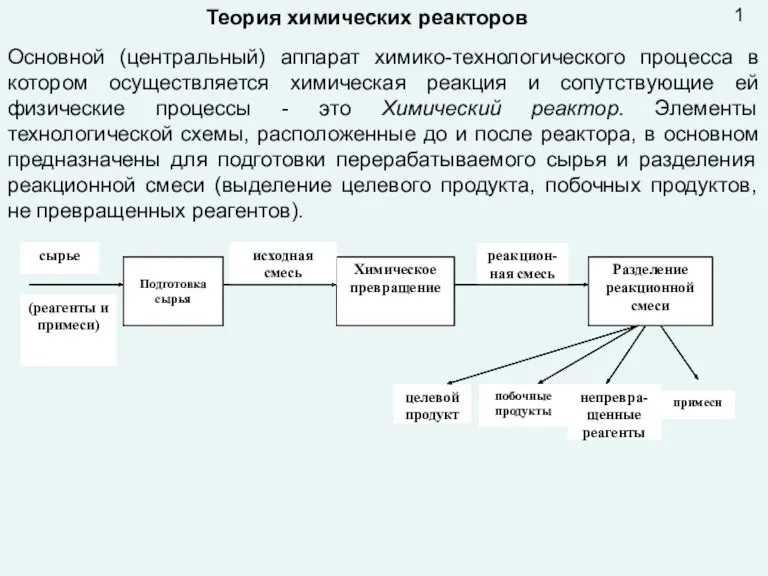 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Азотная кислота
Азотная кислота Основные классы неорганических соединений
Основные классы неорганических соединений Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Аммиак. 9 класс
Аммиак. 9 класс Полимеры. Мономер
Полимеры. Мономер Чистые вещества и смеси
Чистые вещества и смеси Спирти
Спирти