Содержание
- 2. Медико-биологическое значение темы Растворы играют большую роль в процессах жизнедеятельности. Важнейшие физиологические жидкости – кровь, лимфа,
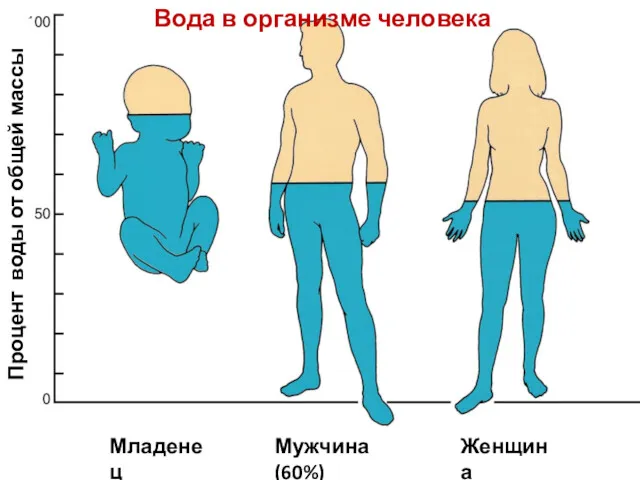
- 3. Вода в организме человека
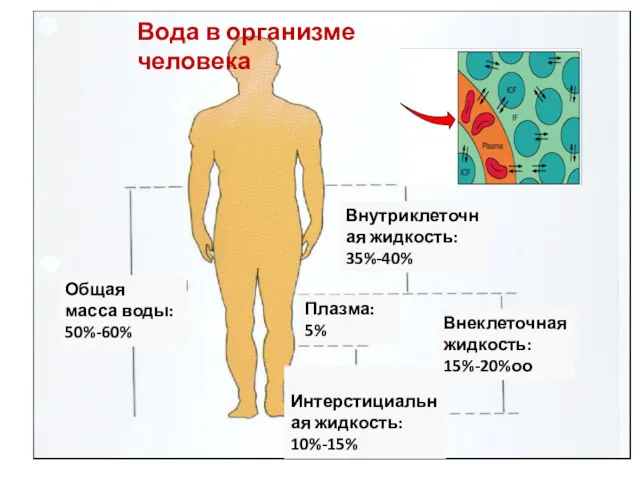
- 4. Общая масса воды: 50%-60% Интерстициальная жидкость: 10%-15% Плазма: 5% Внеклеточная жидкость: 15%-20%оо Внутриклеточная жидкость: 35%-40% Вода
- 5. Медико-биологическое значение темы Процессы усвоения пищи, действие ферментов, лекарственных препаратов и др. реакции в организме обычно
- 6. Раствор – физико-химическая система, состоящая из двух или большего числа веществ и имеющая переменный состав в
- 7. Растворы Растворы занимают промежуточное положение между смесями веществ и химическими соединениями. С механическими смесями растворы сближает
- 8. Растворы Компоненты раствора Растворитель Растворенное вещество Среда Вещество, равномерно распределяемое в растворителе в виде молекул и
- 9. С термодинамической точки зрения растворителем считается тот компонент, который в чистом виде существует в том же
- 10. Растворимость вещества В растворах электролитов независимо от концентрации электролит рассматривается как растворенное вещество. Например, в 70%-ном
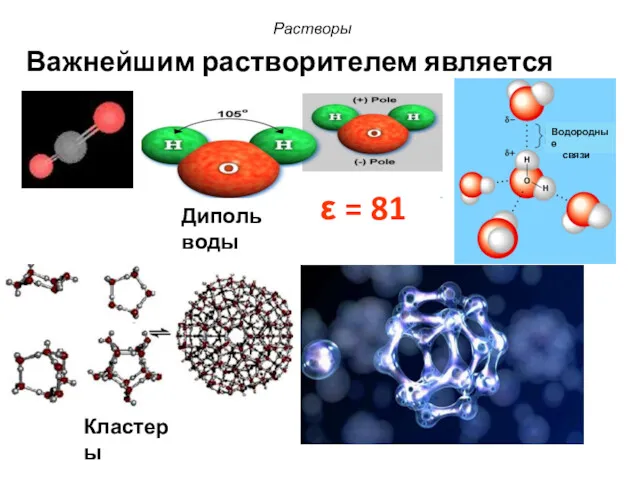
- 11. Растворы Важнейшим растворителем является вода. Водородные связи ε = 81 Диполь воды Кластеры
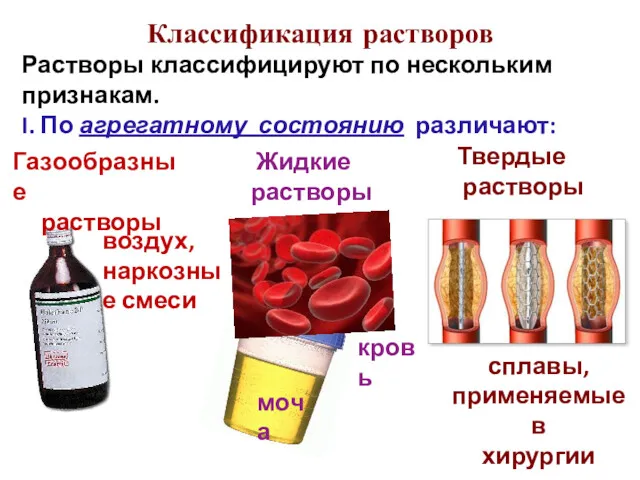
- 12. Классификация растворов Растворы классифицируют по нескольким признакам. I. По агрегатному состоянию различают: кровь моча воздух, наркозные
- 13. II. По молярной массе растворенного вещества различают: М(Х) Главной особенностью растворов ВМВ является существенное различие в
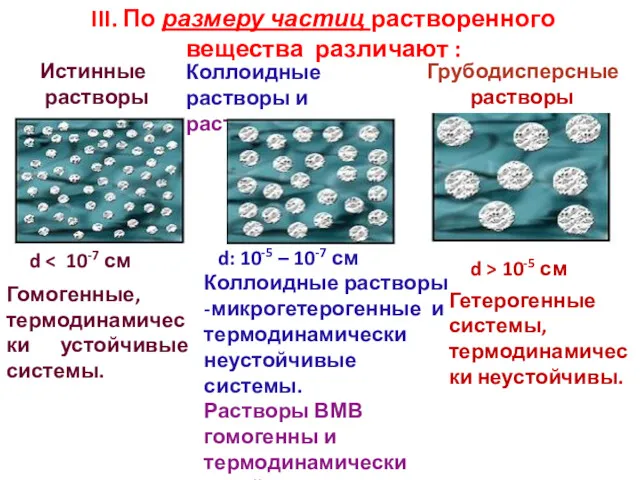
- 14. III. По размеру частиц растворенного вещества различают : Грубодисперсные растворы d Гомогенные, термодинамически устойчивые системы. Гетерогенные
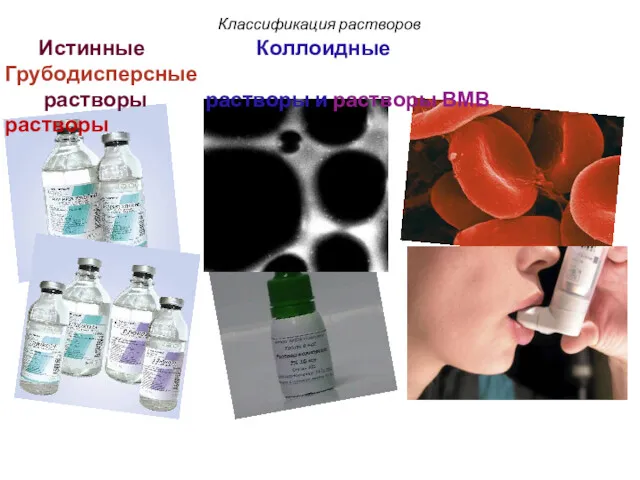
- 15. Классификация растворов Истинные Коллоидные Грубодисперсные растворы растворы и растворы ВМВ растворы
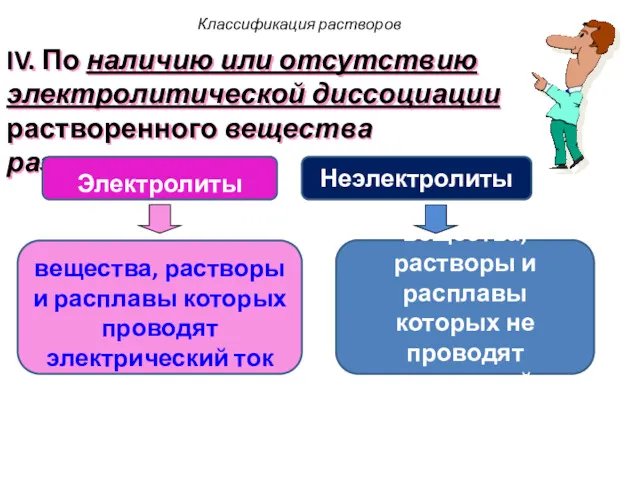
- 16. IV. По наличию или отсутствию электролитической диссоциации растворенного вещества различают: Классификация растворов вещества, растворы и расплавы
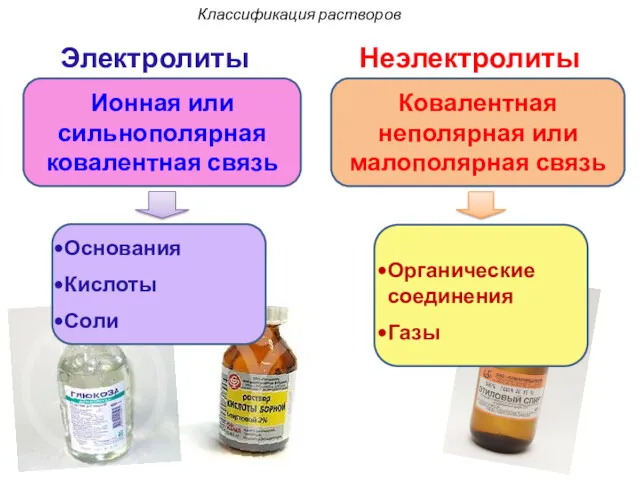
- 17. Электролиты Неэлектролиты Ионная или сильнополярная ковалентная связь Ковалентная неполярная или малополярная связь Основания Кислоты Соли Органические
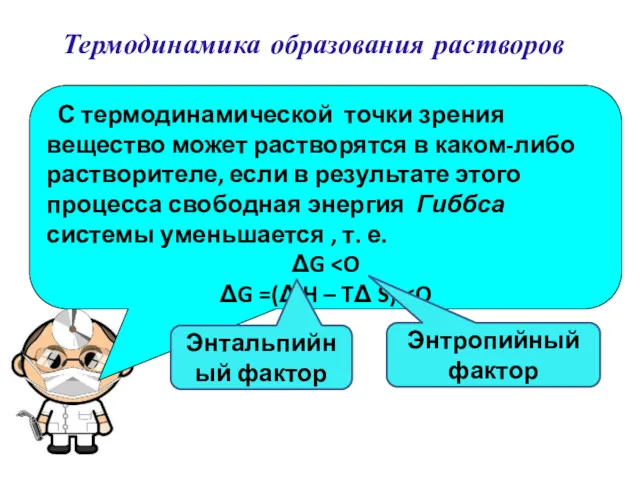
- 18. Термодинамика образования растворов С термодинамической точки зрения вещество может растворятся в каком-либо растворителе, если в результате
- 19. Термодинамика образования растворов 1. Влияние энтальпийного фактора Теплота, выделяемая или поглощаемая при растворении 1 моль вещества,
- 20. Как известно, ΔH зависит от изменения объема системы: ΔH = ΔE + pΔV. При растворении твердых
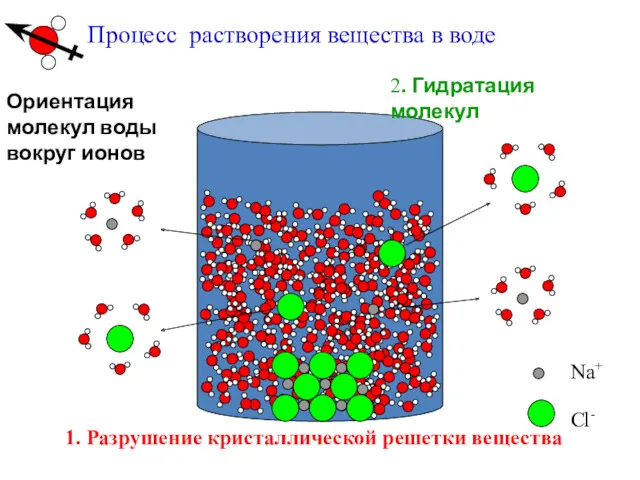
- 21. Процесс растворения вещества в воде 1. Разрушение кристаллической решетки вещества 2. Гидратация молекул Ориентация молекул воды
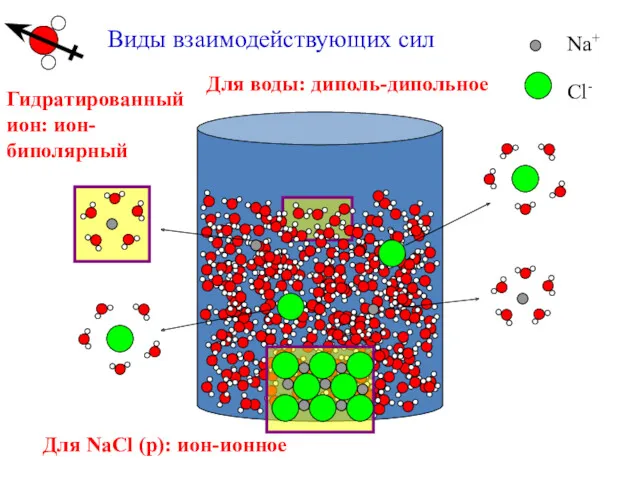
- 22. Виды взаимодействующих сил Для воды: диполь-дипольное Для NaCl (р): ион-ионное Гидратированный ион: ион-биполярный
- 23. Термодинамика образования растворов Процесс растворения вещества складывается из нескольких стадий: 1. Разрушение кристаллической структуры растворяемого вещества,
- 24. Термодинамика образования растворов ΔHраств = ΔHфп + ΔHсол Если ΔHфп > ΔНсол – то процесс эндотермический,
- 25. Термодинамика образования растворов При растворении газообразных веществ ΔH фп = 0, поэтому энтальпия растворения ΔН раств
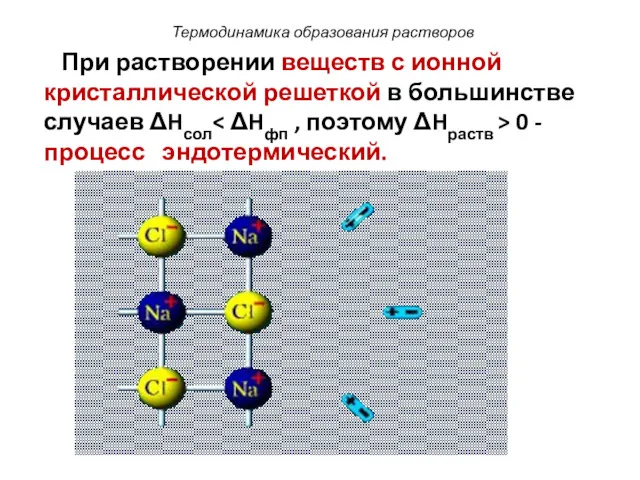
- 26. При растворении веществ с ионной кристаллической решеткой в большинстве случаев ΔHсол 0 - процесс эндотермический. Термодинамика
- 27. Термодинамика образования растворов 2. Влияние энтропийного фактора При переходе вещества из упорядоченного твердого или жидкого состояния
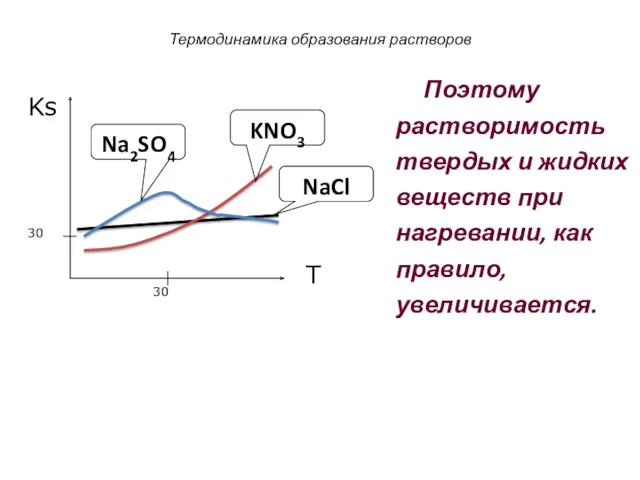
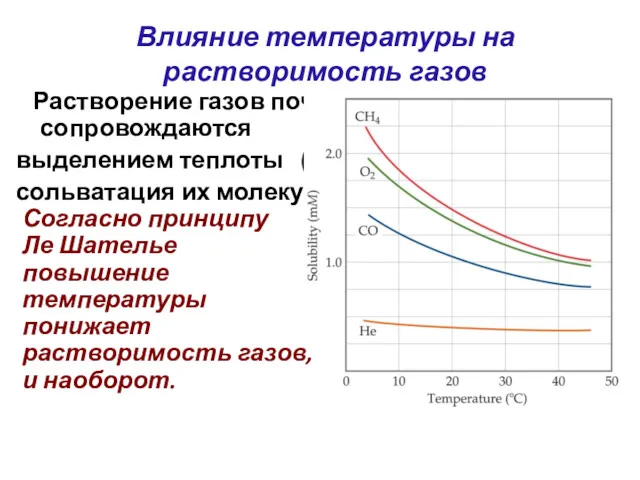
- 28. Термодинамика образования растворов Поэтому растворимость твердых и жидких веществ при нагревании, как правило, увеличивается.
- 29. Термодинамика образования растворов При переходе из газообразного состояния в растворенное в системе наблюдается возрастания упорядоченности из-за
- 30. Растворимость веществ Растворимость - свойство данного вещества растворяться в том или ином растворителе.
- 31. Растворимость веществ Процесс растворения протекает самопроизвольно до тех пор, пока в системе установится состояние равновесия и
- 32. Растворимость веществ Количественно растворимость характеризуют концентрацией насыщенного раствора при определенной температуре и давлении (коэффициент растворимости); выражают
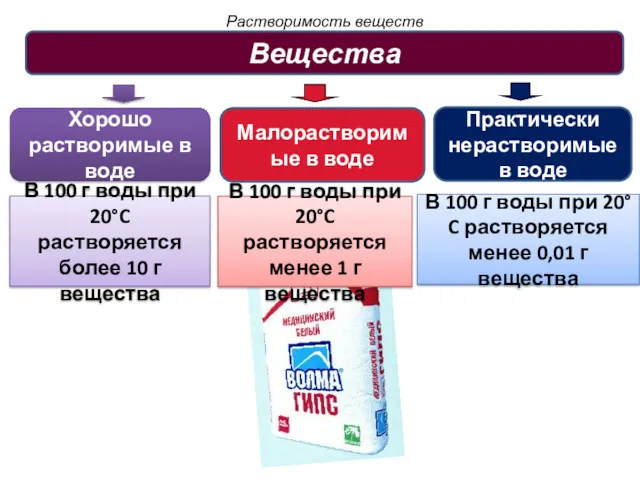
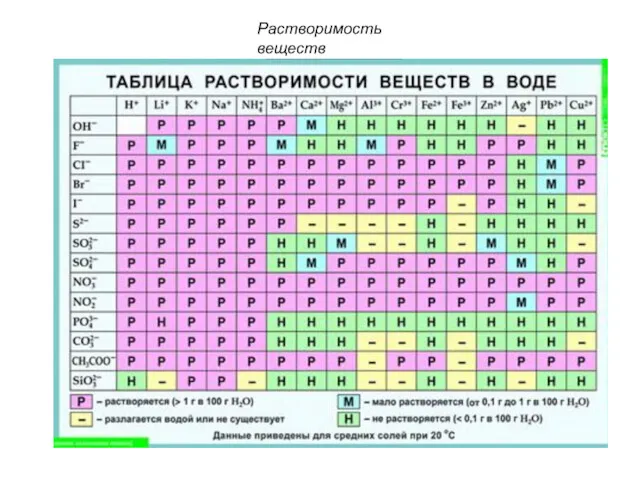
- 33. Растворимость веществ Вещества Хорошо растворимые в воде Практически нерастворимые в воде В 100 г воды при
- 34. Растворимость веществ
- 35. Растворимость веществ Растворимость вещества зависит от ряда факторов. 1. Влияние на растворимость природы компонентов. Природа вещества
- 36. Растворимость веществ На растворимость органических соединений в воде оказывает влияние наличие в их молекулах гидрофильных полярных
- 37. Растворимость веществ 2. Влияние на растворимость внешних условий (давления, температуры): Так как при образовании насыщенного раствора
- 38. Растворимость веществ Большое значение имеет влияние давления и температуры на растворимость газов в организме.
- 39. Влияние температуры на растворимость газов Растворение газов почти всегда сопровождаются выделением теплоты (ΔНраств сольватация их молекул.
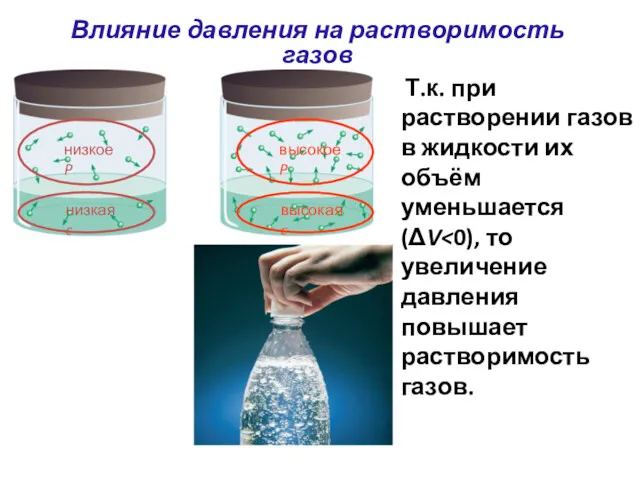
- 40. Т.к. при растворении газов в жидкости их объём уменьшается (ΔV Влияние давления на растворимость газов
- 41. Растворимость вещества Количество газа, растворенное при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально
- 42. Растворимость веществ При растворении в жидкости смеси газов растворимость каждого из них пропорциональна его парциальному давлению
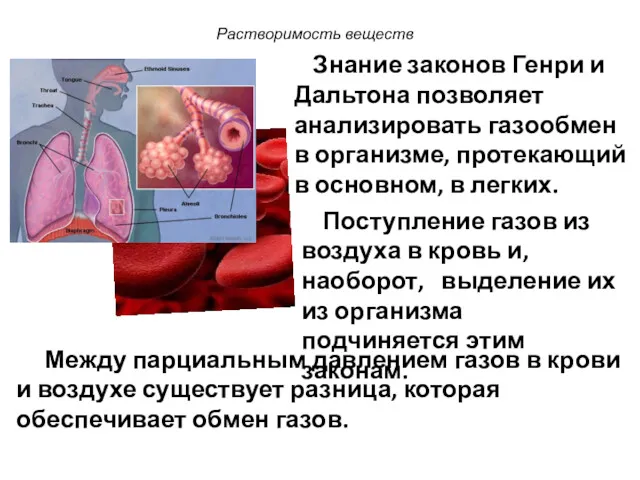
- 43. Растворимость веществ Знание законов Генри и Дальтона позволяет анализировать газообмен в организме, протекающий в основном, в
- 44. Растворимость веществ Законы Генри-Дальтона позволяют так же объяснить патологию организма, связанную с работой человека либо в
- 45. Растворимость веществ В первом случае развивается т.к. горная болезнь в следствии кислородной недостаточности (гипоксии), т.к. на
- 46. Растворимость веществ Во втором случае наблюдается кессонная болезнь, как проявление закона Генри. На глубине ≈ 40
- 47. Растворимость веществ При быстром подъёме человека с глубины растворённые газы выделяются в кровь пузырьками и вызывают
- 48. Для лечении кессонной болезни больных помешают в барокамеры, где создается повышенное давление (оксигенобаротерапия). При этом газы
- 49. Растворимость веществ Оксигенобаротерапию применяют для лечения некоторых видов анемии, газовой гангрены и других заболеваний.
- 50. Закон И.М. Сеченова: растворимость газов в растворах электролитов меньше, чем в чистых растворителях. 3. Влияние электролитов
- 51. Растворимость веществ Математическое выражение закона Сеченова: С(Х) - растворимость газа Х в растворе электролита; С0(Х) -
- 52. Растворимость веществ В крови, желудочном содержимом, моче и других физиологических жидкостях содержаться такие электролиты, как NaCl,
- 54. Скачать презентацию































 Уравнение состояния идеального газа
Уравнение состояния идеального газа Оксидтер
Оксидтер Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)
Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1) Основные электрохимические процессы
Основные электрохимические процессы Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Аллотропные модификации алмаза
Аллотропные модификации алмаза Химические элементы в организме человека
Химические элементы в организме человека Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Классы неорганических веществ
Классы неорганических веществ Физические и химические свойства оснований
Физические и химические свойства оснований Спирты. Классификация спиртов
Спирты. Классификация спиртов Химический элемент Алюминий
Химический элемент Алюминий Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Установка по переработке углеводородов
Установка по переработке углеводородов Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Серная кислота и её свойства. 9 класс
Серная кислота и её свойства. 9 класс Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь Благородные металлы
Благородные металлы Химический элемент титан
Химический элемент титан Кремний и его соединения. К уроку химии в 9 классе
Кремний и его соединения. К уроку химии в 9 классе Квантовая механика – теоретическая основа современной химии
Квантовая механика – теоретическая основа современной химии 20231028_kislorod
20231028_kislorod Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Подгруппа азота
Подгруппа азота