Содержание
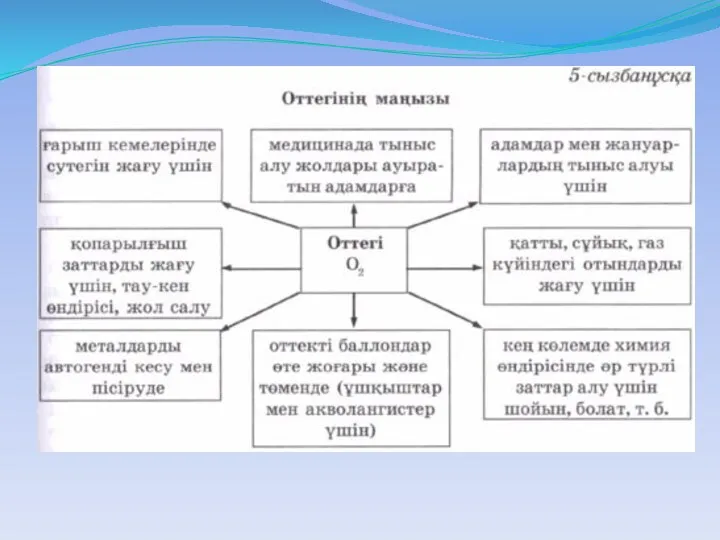
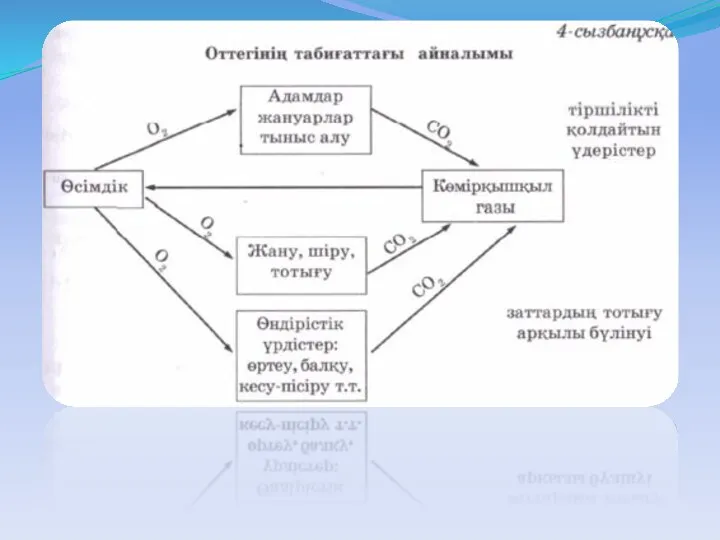
- 2. Жоспар: Оксидтер Оксидтердің жіктелуі Оксидтердің қолданылуы Оксидтердің алынуы Оттектің физикалық қасиеті Оксидтің түстері Оттегінің маңызы Оттегінің
- 3. Күрделі қосылыстардың үлкен бір тобы (класы) - оксидтер. Оксидтер үшке бөлінеді: қышқылдық, негіздік, екідайлы (амфотерлі). Қышқылдық
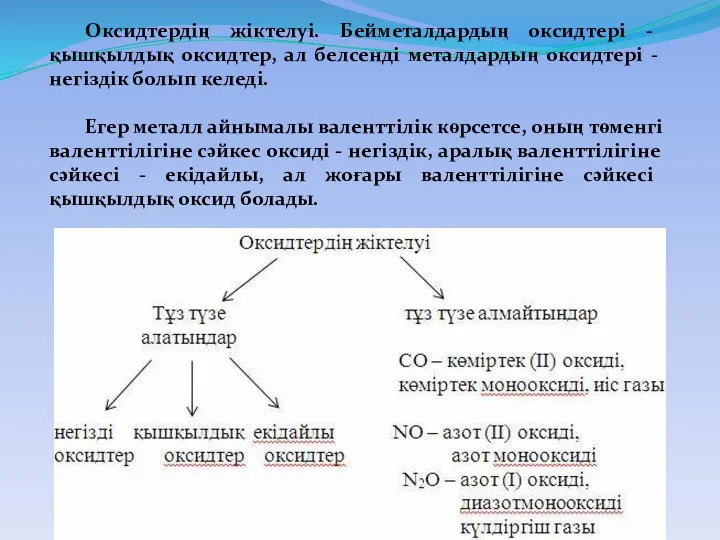
- 4. Оксидтердің жіктелуі. Бейметалдардың оксидтері - қышқылдық оксидтер, ал белсенді металдардың оксидтері - негіздік болып келеді. Егер
- 5. Оксидтердің жіктелуі
- 6. Оксидтердің қолданылуы Н2O
- 7. Fe2O3 Гематит
- 8. SiO2 хрусталь, кварц
- 9. СаO Сөндірілмеген әк
- 10. Оксидтердің алынуы 1.Жай заттардың оттекпен тікелей әрекеттесуі арқылы: C + O2 = CO2 2Cu + O2
- 11. мысалы, CuO, CaO, Fe2O3, P2O5 - қатты заттар; CO2, SO2, NO2 - газдар; H2O, N2O3(t
- 12. Оксидтердің түстері де әр түрлі: Ғе2О3 - қызыл-қоңыр, CuO - кара, Сr2O3 - жасыл, ZnO, MgO
- 16. Скачать презентацию










 Своя игра по химии
Своя игра по химии Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Равновесные электрохимические системы
Равновесные электрохимические системы Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Белки. Определение
Белки. Определение Химическая термодинамика. Фазовые равновесия
Химическая термодинамика. Фазовые равновесия Первичная переработка нефти
Первичная переработка нефти Азотистая кислота
Азотистая кислота Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева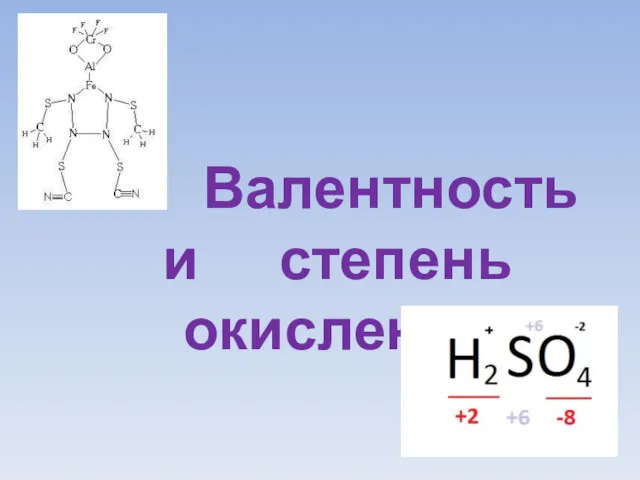 Валентность и степень окисления атомов в молекуле
Валентность и степень окисления атомов в молекуле Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Основные понятия и законы химии
Основные понятия и законы химии Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Понятие биогенности химических элементов
Понятие биогенности химических элементов Реакции ионного обмена
Реакции ионного обмена Умные полимеры в биотехнологии и медицине
Умные полимеры в биотехнологии и медицине Неорганическая химия
Неорганическая химия Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Прикладная геохимия. Вторичные ореолы
Прикладная геохимия. Вторичные ореолы Химия и война. Альманах
Химия и война. Альманах Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12
Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12 Фосфор и его соединения
Фосфор и его соединения Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее? Переработка угля
Переработка угля Знаки вторичной переработки
Знаки вторичной переработки Серная кислота H2SO4
Серная кислота H2SO4 Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов