Содержание
- 2. Все многообразие химических реакций можно разделить на две группы: 1. Реакции, протекающие без изменения степени окисления
- 3. 1.2. Некоторые реакции соединения, например, реакция взаимодействия раствора гидроксида кальция (известковой воды) Са(ОН)2 с углекислым газом
- 4. 1.3. Некоторые реакции разложения, например, обжиг известняка, приводящий к получению негашеной извести CaO и углекислого газа:
- 5. 2. Окислительно-восстановительными реакциями называются реакции, сопровождающиеся изменением степени окисления реагирующих веществ. К данному типу относятся большое
- 6. 2.3. Реакции замещения, например, вытеснение менее активных металлов из растворов их солей более активным металлом: 0
- 7. Степень окисления Степень окисления количественно характеризует состояние атома в соединении. При определении степени окисления принято считать,
- 8. Условия, принятые для определения степени окисления
- 9. Значение степеней окисления изменяются в интервале от − 4 до + 7. ⎯⎯⎯→ процесс окисления повышение
- 10. Основные положения теории окисления - восстановления Современная теория окисления - восстановления основана на следующих основных положениях.
- 11. 2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Степени окисления при этом понижаются, например:
- 12. Например, в реакции 0 +2 0 +2 C + PbO = Pb + CO элементарный углерод
- 13. Итак, окисление всегда сопровождается восстановлением; восстановление всегда связано с окислением: восстановитель - е- ↔ окислитель окислитель
- 14. Важнейшие окислители и восстановители 1. Группа восстановителей Восстановителями могут быть - нейтральные атомы металлов (например, щелочные
- 15. Примеры: Углерод. Широко применяется для восстановления металлов из оксидов. C + ZnO = Zn + CO
- 16. Железо, цинк, алюминий и олово. Применяются в качестве восстановителей в производстве органических веществ, главным образом, при
- 17. Тиосульфат натрия. Применяется в качестве восстановителя в красильном деле с целью освобождения отбеливаемого материала от избытка
- 18. Электрический ток. Катод при электролизе является восстановителем, при этом электрический ток является самым сильным восстановителем, поэтому
- 19. Рассмотрим электролиз расплава иодида калия. В расплаве (1500-2000 град С) данная соль диссоциирует на ионы К+
- 20. 2. Группа окислителей Окислителями могут быть - нейтральные атомы и молекулы ( например, галогены и кислород);
- 21. Окислители, имеющие наибольшее значение в технике и лабораторной практике Кислород. Применяется для интенсификации производственных процессов в
- 22. Характер взаимодействия азотной кислоты с металлами представлен на схеме:
- 23. Серная кислота (концентрированная). Тяжелая, бесцветная маслянистая жидкость, гигроскопична. Сравнительно сильный окислитель, особенно при высокой температуре. В
- 24. Электрический ток. Анод при электролизе является окислителем. При этом электрический ток - самый сильный окислитель (с
- 25. Примеры решения задач Пример 1. Определите, какая из приведенных реакций является окислительно-восстановительной: 1) 2Na2CrO4 + H2SO4
- 26. Определим степени окисления атомов элементов, входящих в состав реагирующих веществ в первой реакции: +1 +6 -2
- 27. Степени окисления атомов элементов, входящих в состав реагирующих веществ во второй реакции. +4 -2 +1 -1
- 28. Пример 2. Для окислительно-восстановительной реакции, протекающей по схеме KMnO4 + HCl → KCl + MnCl2 +
- 29. Решение. Одним из методов подбора коэффициентов в окислительно-восстановительных реакциях является метод электронного баланса, основанный на том,
- 30. +1+7 -2 +1-1 +1-1 +2 -1 0 +1 -2 KMnO4 + HCl → KCl + MnCl2
- 31. 3. Определите число электронов, принятых и отданных атомами этих элементов. Напишите электронные уравнения процессов: +7 +2
- 32. 4. Уравняйте число принятых и отданных электронов, определив таким образом коэффициенты в уравнении реакции перед соединениями,
- 33. 5. Укажите тип каждого процесса: окисление или восстановление, тип каждого вещества: окислитель или восстановитель: вещество KMnO4
- 34. 6. Подберите коэффициенты для всех остальных участников реакции следующим образом: Уравняйте: - число атомов металлов, число
- 35. Уравняем число атомов металла (калия) и число кислотных остатков (Cl−1): 2KMnO4 + 16HCl →2KCl + 2MnCl2
- 36. Домашнее задание. Из предложенных схем реакций (вариант в табл.) определите, какие реакции являются окислительно-восстановительными. Уравняйте их
- 38. Скачать презентацию



































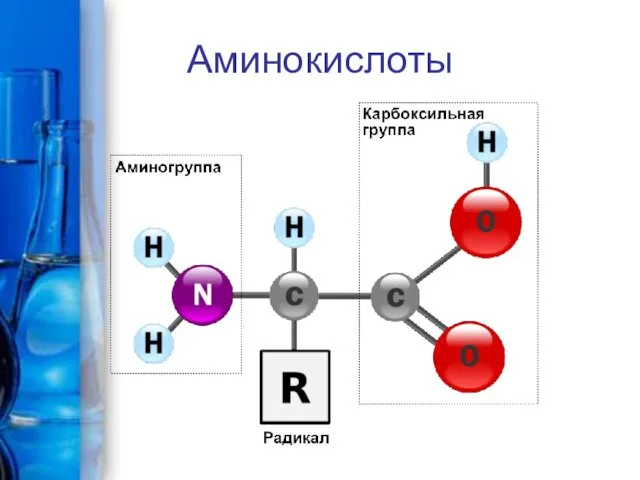 Аминокислоты и белки
Аминокислоты и белки Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Азот қышқылы
Азот қышқылы Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Сера и её соединения
Сера и её соединения Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Хромопротеиды: биологическая роль. Синтез и распад гема. Метаболизм билирубина
Хромопротеиды: биологическая роль. Синтез и распад гема. Метаболизм билирубина Химический элемент цинк
Химический элемент цинк Химическая промышленность
Химическая промышленность Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии 20230816_himiya_spirty
20230816_himiya_spirty Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Классы неорганических веществ
Классы неорганических веществ Химическая организация клетки
Химическая организация клетки Химические соединения в организме человека
Химические соединения в организме человека Физические свойства минералов
Физические свойства минералов Аммиак
Аммиак Инструментальный метод анализа
Инструментальный метод анализа Происхождение, состав и свойства минералов
Происхождение, состав и свойства минералов Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Электролитическая диссоциация
Электролитическая диссоциация Периодическая система элементов, предсказание химических свойств элементов на основе таблицы
Периодическая система элементов, предсказание химических свойств элементов на основе таблицы Непредельные углеводороды
Непредельные углеводороды Углерод. Аллотропные модификации
Углерод. Аллотропные модификации