Содержание
- 2. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ Хімічний диктант Записати рівняння реакцій, вказати їх типи. 1 варіант 2 варіант 1.
- 3. 1.1 CaCO3 + 2CH3COOH = Ca(CH3COO)2 + H2O + CO2 розчинення перлини в виноградному оцеті C+O2
- 4. 1.3 Слід пам’ятати, що … Ступінь окиснення атома Флуора в будь-яких сполуках завжди -1. Ступені окиснення
- 5. 1.2 Дайте відповіді на запитання: Що ми називаємо хімічними реакціями? За якими ознаками класифікують хімічні реакції?
- 6. Вкажіть реакцію, що є окисно-відновною 1.4 CaO+CО2=CaCO3 NaOH+HCl=NaCl+H2O Fe+CuSO4=FeSO4+Cu Na3SiO3+2HCl=2NaCl+H2SiO3 ! Окисно-відновні реакції - реакції, що
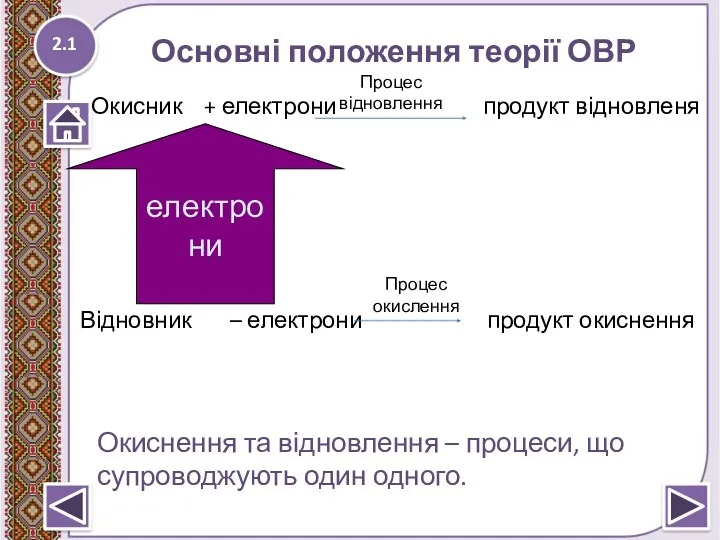
- 7. Основні положення теорії ОВР 2.1 Окисник + електрони продукт відновленя Відновник – електрони продукт окиснення електрони
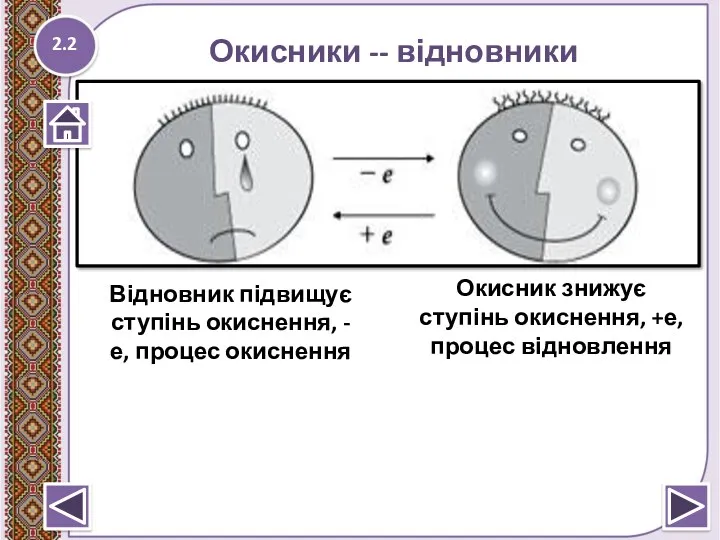
- 8. Окисники -- відновники 2.2 Відновник підвищує ступінь окиснення, -е, процес окиснення Окисник знижує ступінь окиснення, +е,
- 9. 2.3 Алгоритм складання окисно – відновних реакцій методом електронного балансу Записати схему хімічної реакції. Визначити і
- 10. 2.4 Доберіть коефіцієнти у схемах окисно – відновних реакцій методом електронного балансу, вкажіть окисник і відновник,
- 11. 3.1 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Лісові пожежі C +
- 12. 3.2 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Фотосинтез CO2 + H2O
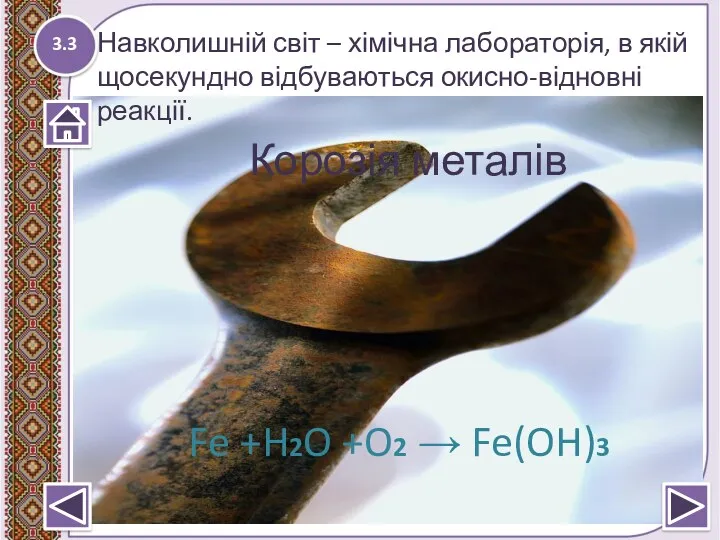
- 13. 3.3 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Корозія металів Fe +H2O
- 14. 3.4 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Виверження вулканів S +
- 15. 3.5 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Згоряння палива
- 16. 3.6 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Бродіння глюкози C6H12O6 →
- 17. 3.7 Навколишній світ – хімічна лабораторія, в якій щосекундно відбуваються окисно-відновні реакції. Грозові розряди N2 +
- 18. Окисно-відновні реакції в хімічних виробництвах 3.8 ! * Виробництво Металів Органічних речовин Виготовлення кисломолочних продуктів Лікарських
- 19. Окисно-відновні реакції в побуті 3.9 ! * Хімічна завивка волосся Відбілювання і дезінфекція Почорніння срібних виробів
- 20. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ 3і списку рівнянь реакцій учні повинні вибрати окисно-відновні та скласти електронний баланс.
- 22. Скачать презентацию
















 Бензин. Производство бензина
Бензин. Производство бензина Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Азотсодержащие органические соединения
Азотсодержащие органические соединения Органическая химия. Лекция 13
Органическая химия. Лекция 13 Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Изотопный обмен
Изотопный обмен Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса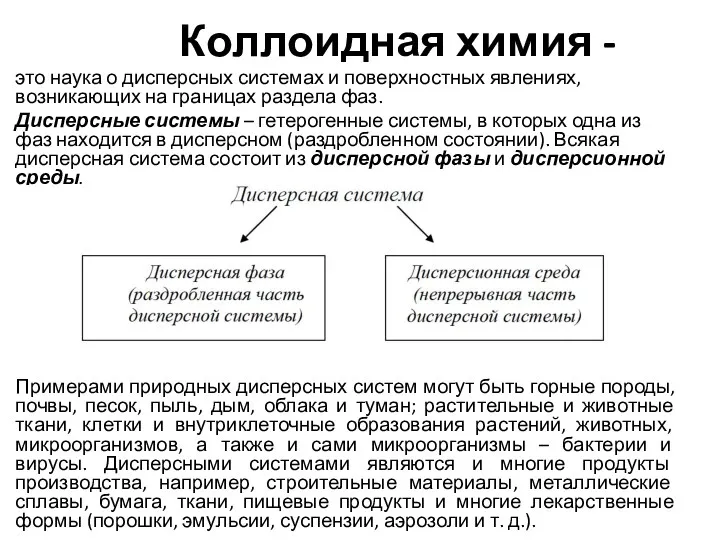 Коллоидная химия
Коллоидная химия Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Nucleic acids
Nucleic acids Общая и медицинская химия
Общая и медицинская химия Создание косметических средств
Создание косметических средств Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Алюминий и бор
Алюминий и бор Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа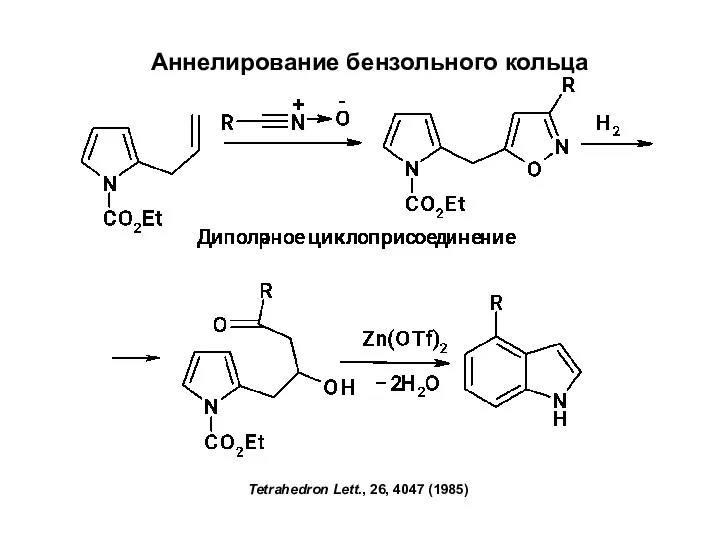 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение атома. Теории строения атома
Строение атома. Теории строения атома Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Многоатомные спирты
Многоатомные спирты Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Азот и его свойства
Азот и его свойства Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Процесс электролиза
Процесс электролиза