Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7 презентация
Содержание
- 2. Потенциальная теория Поляни Модель: Адсорбат – однокомпонентная система, находящаяся в потенциальном поле поверхностных сил адсорбента; Адсорбент
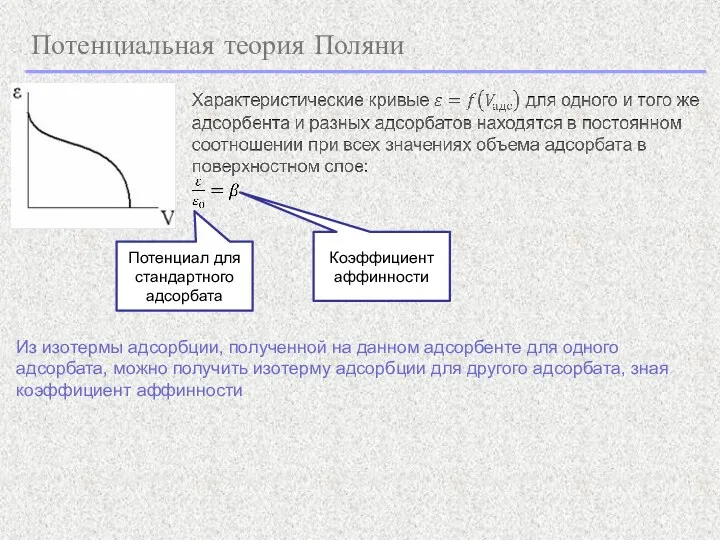
- 3. Потенциальная теория Поляни Из изотермы адсорбции, полученной при одной температуре, можно рассчитать изотерму адсорбции при любой
- 4. Потенциальная теория Поляни Из изотермы адсорбции, полученной на данном адсорбенте для одного адсорбата, можно получить изотерму
- 5. Пористость открытые (проходные, сквозные) несквозные закрытые
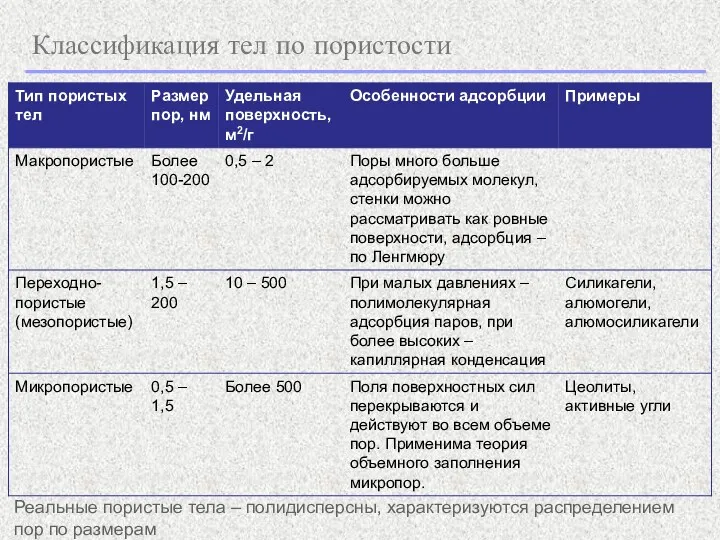
- 6. Классификация тел по пористости Реальные пористые тела – полидисперсны, характеризуются распределением пор по размерам
- 7. Адсорбция на мезопористых сорбентах
- 8. Адсорбция на мезопористых сорбентах
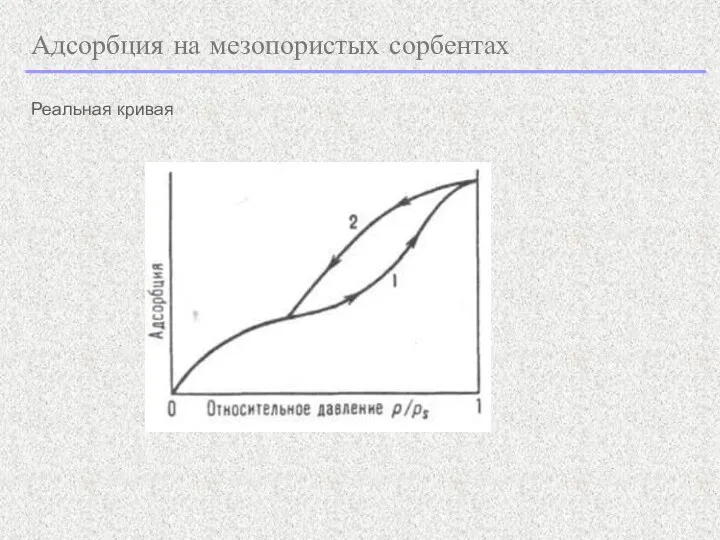
- 9. Адсорбция на мезопористых сорбентах Реальная кривая
- 10. Теория объемного заполнения микропор Потенциал Поляни Характеристическая энергия адсорбции
- 11. Теория объемного заполнения микропор Максимальная величина адсорбции При n=1 и n=2 получаются уравнения Дубинина - Радушкевича
- 12. Адсорбция из растворов Особенности адсорбции из растворов: при помещении адсорбента в раствор на нем нет свободных
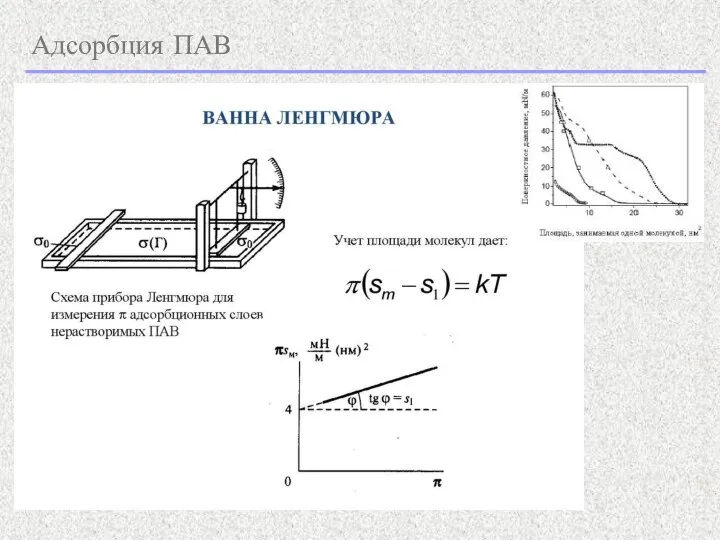
- 13. Адсорбция ПАВ - уравнение Гиббса для предельно разбавленной бинарной системы ПАВ: - закон Генри только при
- 14. Адсорбция ПАВ уравнение состояния двумерного поверхностного газа Работает только при низких концентрациях!!! Похоже на уравнение Менделеева
- 15. Адсорбция ПАВ При больших концентрациях в паре с уравнением Гиббса используем уравнение Ленгмюра: - уравнение Шишковского
- 16. Адсорбция ПАВ - уравнение Шишковского Разложим логарифм в ряд и ограничимся первым слагаемым. Тогда: - уравнение
- 17. Адсорбция ПАВ
- 18. Адсорбция ПАВ
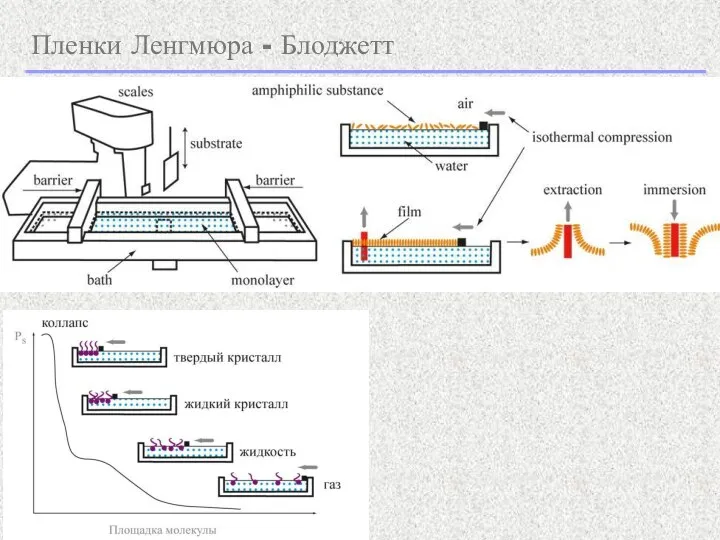
- 19. Пленки Ленгмюра - Блоджетт
- 20. Ионообменная адсорбция Ионообменная адсорбция состоит в ионном обмене ионов, содержащихся в адсорбенте на одноименные ионы из
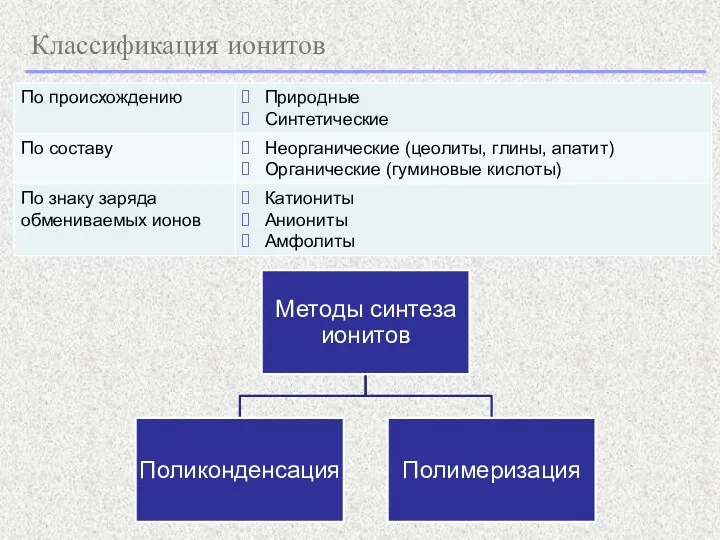
- 21. Классификация ионитов
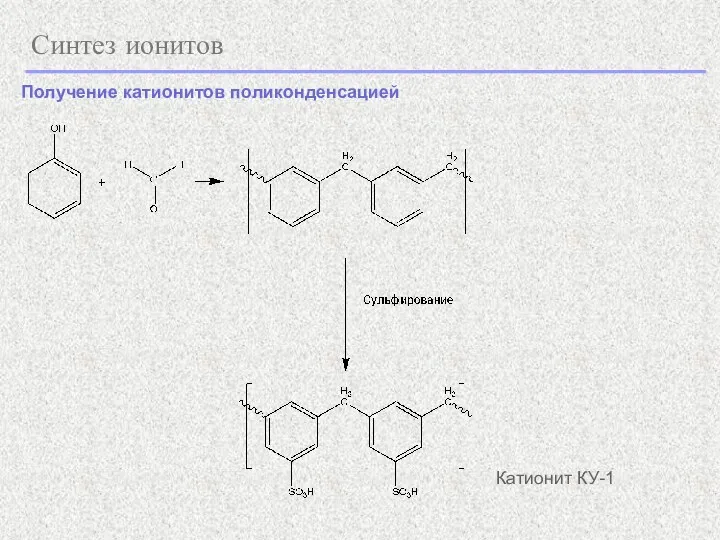
- 22. Синтез ионитов Катионит КУ-1 Получение катионитов поликонденсацией
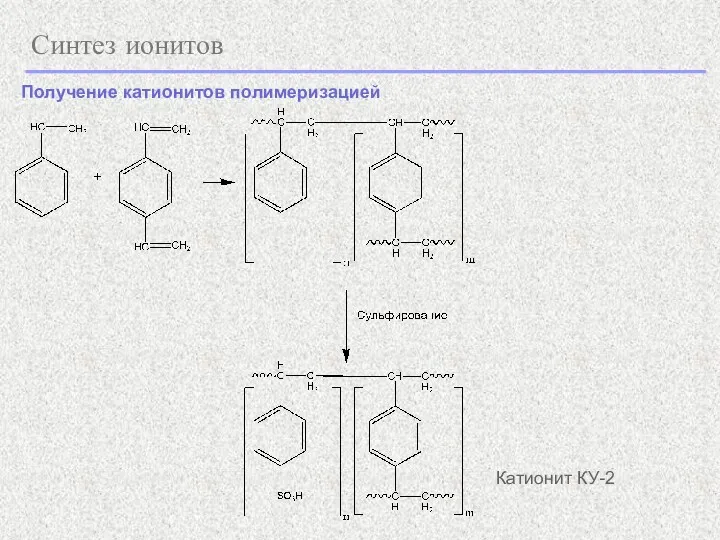
- 23. Синтез ионитов Катионит КУ-2 Получение катионитов полимеризацией
- 24. Характеристики ионитов Ионообменные материалы: Сильнокислотные (содержат -SO3H); Средней силы ( ) Слабокислотные (-OH, -COOH); Слабоосновные (-NH2);
- 25. Стадии ионного обмена Стадии ионного обмена: Диффузия ионов к поверхности сорбента; Диффузия ионов внутри зерна; Ионный
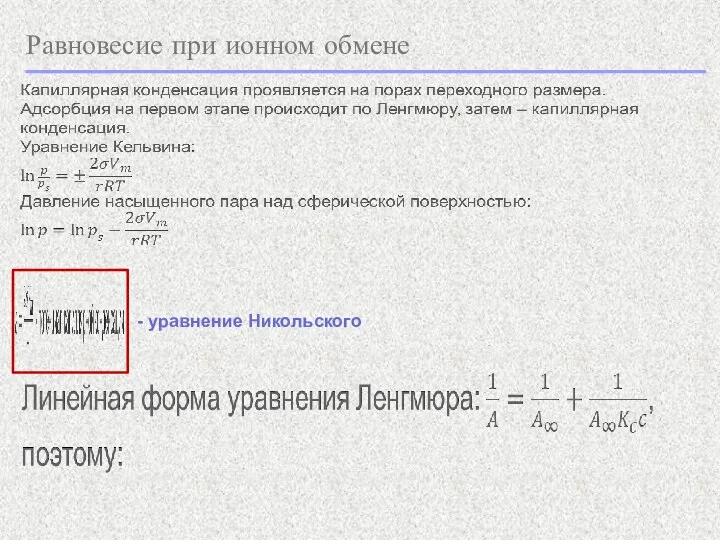
- 26. Равновесие при ионном обмене - уравнение Никольского
- 27. Лиотропные ряды Лиотропные ряды – последовательности ионов в порядке убывания адсорбционной способности. Для однозарядных катионов: Cs+>Rb+>K+>Na+>Li+
- 29. Скачать презентацию

















 Электролиз
Электролиз Хром. Элемент VI группы побочной подгруппы
Хром. Элемент VI группы побочной подгруппы Термодинамика химического равновесия
Термодинамика химического равновесия Координационные соединения
Координационные соединения Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Свойства природного газа
Свойства природного газа Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева
Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева Физико-химические свойства жиров
Физико-химические свойства жиров Инертные газы
Инертные газы Аллотропные модификации алмаза
Аллотропные модификации алмаза Автомобильные бензины
Автомобильные бензины Особо чистые вещества. Занятие 14
Особо чистые вещества. Занятие 14 Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Оксиды неметаллов
Оксиды неметаллов Сложные эфиры. Жиры
Сложные эфиры. Жиры Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические
Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Кислоты в животном и растительном мире
Кислоты в животном и растительном мире Свободные радикалы и болезни человека
Свободные радикалы и болезни человека Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Синтез на основі бензену
Синтез на основі бензену Шыны, әйнек
Шыны, әйнек Общая характеристика галогенов
Общая характеристика галогенов