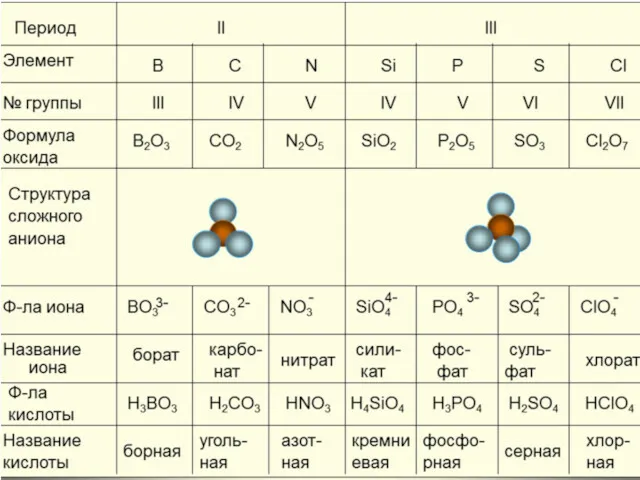
Соединения галогенов
галогеноводороды
бесцветные газы, с резким запахом, токсичные, хорошо растворяются в воде,
дымятся во влажном воздухе
Растворы галогеноводородов в воде являются кислотами
Фтороводородная кислота или плавиковая
Хлороводородная кислота или соляная
Бромоводородная кислота
Иодоводородная кислота
Самая сильная к-та
Самая слабая к-та
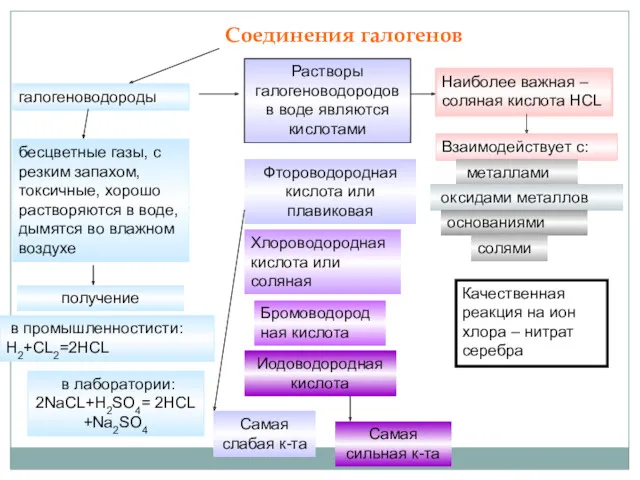
Наиболее важная –соляная кислота HCL
в промышленностисти: Н2+CL2=2HCL
в лаборатории: 2NaCL+H2SO4= 2HCL +Na2SO4
Взаимодействует с:
металлами
оксидами металлов
основаниями
солями
Качественная реакция на ион хлора – нитрат серебра
получение





 Растворы. Концентрация растворов
Растворы. Концентрация растворов Основания. 8 класс
Основания. 8 класс Основы электрохимии
Основы электрохимии Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Задачи на смеси и сплавы
Задачи на смеси и сплавы Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Основные понятия и законы химии
Основные понятия и законы химии Лекция 8. Электрохимия
Лекция 8. Электрохимия Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Вода. 8 класс
Вода. 8 класс Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Строение атома
Строение атома Классификация химических элементов
Классификация химических элементов Электрохимическая защита
Электрохимическая защита Строение и свойства циклоалканов
Строение и свойства циклоалканов Природный газ
Природный газ Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Летучие яды. Токсичные газы
Летучие яды. Токсичные газы Электрохимические производства
Электрохимические производства Водород. Строение, свойства, получение, применение
Водород. Строение, свойства, получение, применение Дисперсные системы
Дисперсные системы Электролиз расплавов, водных растворов
Электролиз расплавов, водных растворов Металлы II группы главной подгруппы
Металлы II группы главной подгруппы Оксиды. 8 класс
Оксиды. 8 класс Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Основные постулаты квантовой механики
Основные постулаты квантовой механики Основания
Основания