Содержание
- 2. Электрохимические методы анализа Электроаналитическая химия включает методы исследования и анализа. Методы делятся на 3 группы: Методы,
- 3. Классификация по способу выполнения Прямые (прямая потенциометрия, ионометрия, прямая кулонометрия, вольтамперометрия) Косвенные (титрометрия с электрохимическими методами
- 4. Кондуктометрия Кондуктометрия – анализ по химической проводимости Электрическая проводимость раствора выражается в единицах или удельной или
- 5. В разбавленных растворах удельная электрическая проводимость с увеличением концентрации растет и достигает максимума (рис.). Для аналитических
- 6. Эквивалентная проводимость раствора Проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами,
- 7. Температурная зависимость α – эмпирический коэффициент зависимости от природы ионов и растворителя
- 8. Проводимость в неводных растворах имеет ряд особенностей – влияет диэлектрическая проницаемость, появляется минимум и максимум на
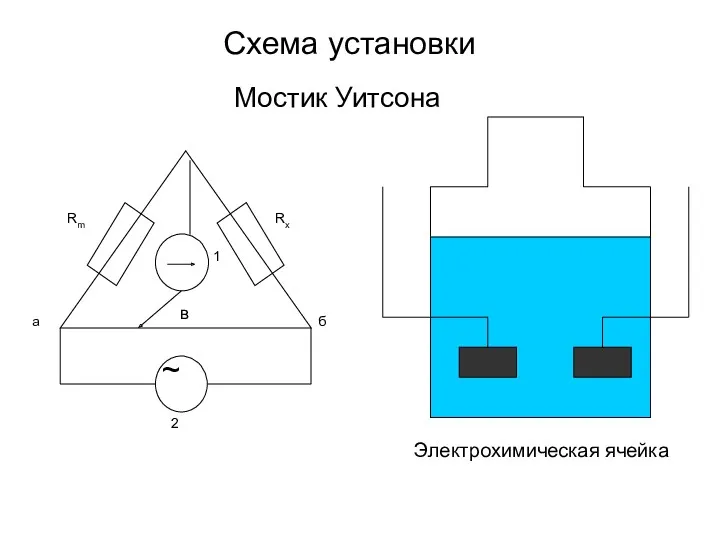
- 9. Схема установки Мостик Уитсона Электрохимическая ячейка
- 10. 2 – генератор Rm – магазин сопротивлений в – передвижной контакт (чтобы в положении 1 не
- 11. Истинная электрическая проводимость пропорциональна измеренной величине χ=kx, где k – константа сосуда
- 12. Прямая кондуктометрия Метод основан на том, что в области разбавленных и умеренно-концентрированных растворов электрическая проводимость растет
- 13. Кондуктометрическое титрование Применяют в титрометрическом анализе для определения точки эквивалентности Измеряют электрическую проводимость после добавления небольших
- 14. Кислотно-основное титрование (примеры) Сильная кислота + сильное основание HCl+NaOH=Na++H++OH-+Cl- Электрическая проводимость определяется концентрацией и подвижностью ионов
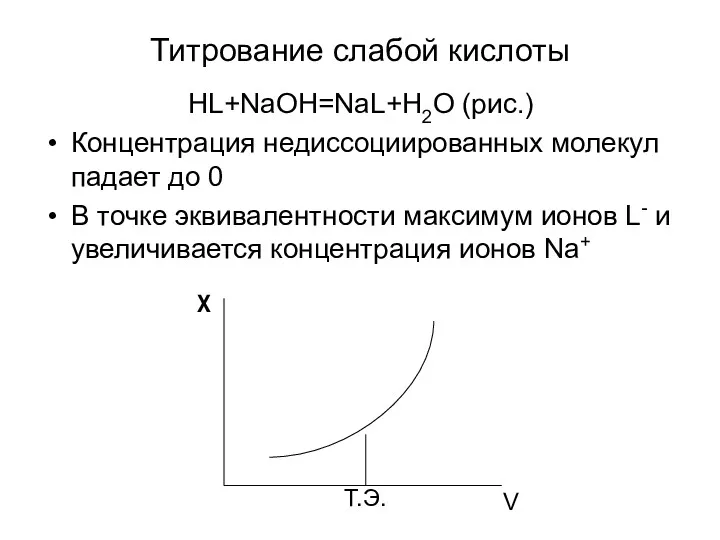
- 15. Титрование слабой кислоты HL+NaOH=NaL+H2O (рис.) Концентрация недиссоциированных молекул падает до 0 В точке эквивалентности максимум ионов
- 16. Реакция осаждения Вид кривой зависит от концентрации подвижности ионов и ПР, образовавшегося соединения Кривая хорошо строится
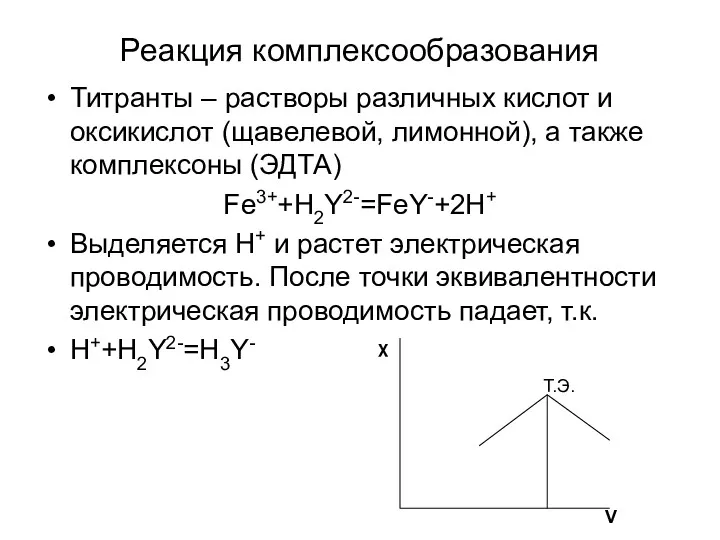
- 17. Реакция комплексообразования Титранты – растворы различных кислот и оксикислот (щавелевой, лимонной), а также комплексоны (ЭДТА) Fe3++H2Y2-=FeY-+2H+
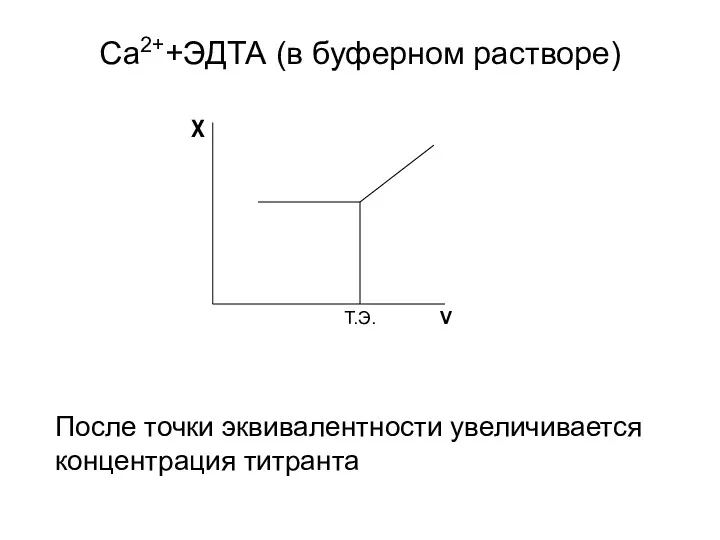
- 18. Ca2++ЭДТА (в буферном растворе) После точки эквивалентности увеличивается концентрация титранта
- 19. Окислительно-восстановительное титрование Используется редко, т.к. нужно большое количество электролита и сильно кислая среда Скорость реакции очень
- 20. Достоинства Экспрессность Простота Доступность Достаточная точность Sr=1-2% Без термостатирования ±(2+3)% (температура изменяет проводимость на 2-3%) Возможно
- 21. Электрофорез
- 22. Многие важные биохимические молекулы: аминокислоты, пептиды, белки и нуклеиновые кислоты содержат ионизирующие группы, поэтому в растворе
- 23. Биохимические вещества растворяют в буфере. Процесс проводится в специальных камерах из двух отсеков. В одном отсеке
- 24. Общая для всех носителей особенность состоит в том, что разделяемые веществ движутся в виде отчетливых зон,
- 25. Электрофоретическая подвижность заряженных молекул зависит от заряда, размера молекул, формы молекул Заряд: зависит от рН Размеры:
- 26. Буфер создает и стабилизирует рН носителя, а также самым различным образом влияет на скорость миграции веществ
- 27. Адсорбция – как и при адсорбционной хроматографии приводит к уменьшению скорости миграции. Электроосмос – это явление
- 28. Оборудование Источник питания и электрофоретический блок. Используют низкое напряжение. Источник стабилизированный Электроды из нержавеющей стали или
- 30. Скачать презентацию






















 Химические свойства металлов
Химические свойства металлов Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Классификация органических реакций
Классификация органических реакций Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Історія хімії
Історія хімії F элементы
F элементы Аммиак: состав вещества, получение, применение, строение, свойства
Аммиак: состав вещества, получение, применение, строение, свойства Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Изучение состава чая
Изучение состава чая Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Химическое загрязнение атмосферы
Химическое загрязнение атмосферы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Золото и серебро
Золото и серебро Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Бензол. Физические и химические свойства
Бензол. Физические и химические свойства Металлы – простые вещества
Металлы – простые вещества 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Химические реакции. (8 класс)
Химические реакции. (8 класс) Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Теоретические основы и технология первичной переработки нефти. Тема 4
Теоретические основы и технология первичной переработки нефти. Тема 4