Содержание
- 2. О каком металле идет речь… Среди металлов самый славный Важнейший древний элемент. В тяжелой индустрии –
- 3. Железо и его соединения Подготовила: учитель химии МБОУ «Томаровская СОШ №1» Исмаилова З.Г.
- 4. Домашнее задание: §34, читать; Устно ответить на вопросы 1-3; Упр. №4б, 5в, 7 (ОГЭ) страница 177
- 5. Происхождение названия Ferrum от латинского fers - быть твердым, что в свою очередь происходит от санскритского
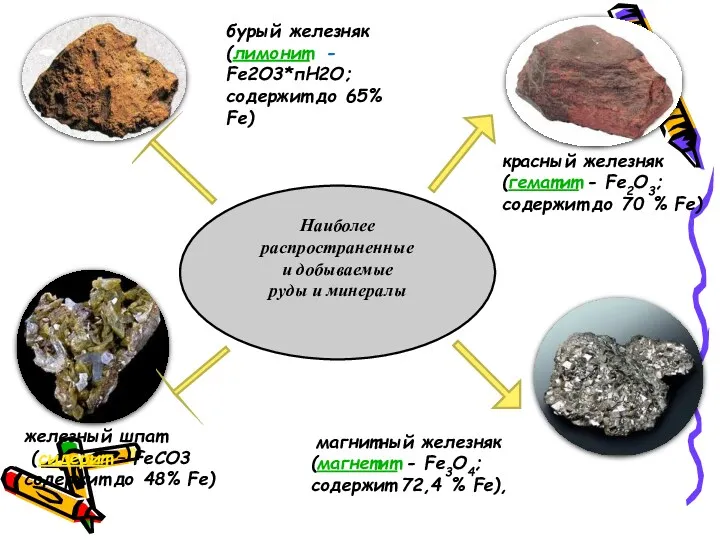
- 6. Наиболее распространенные и добываемые руды и минералы магнитный железняк (магнетит - Fe3O4; содержит 72,4 % Fe),
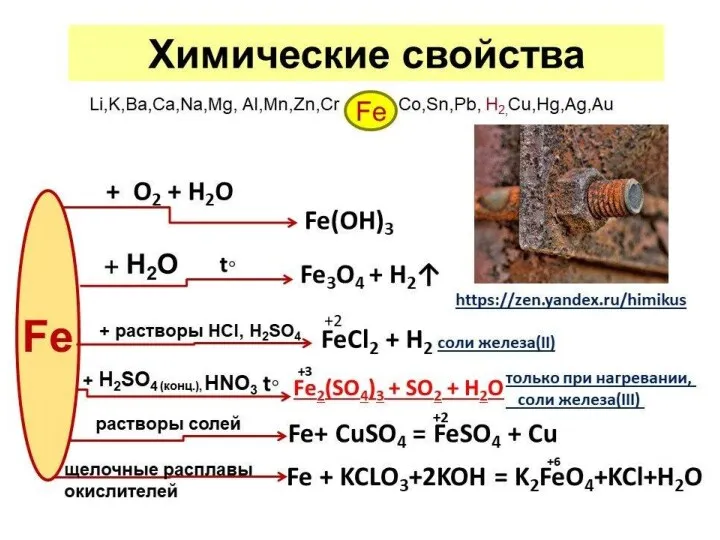
- 7. Вопросы по теме «Железо и его соединения» Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие
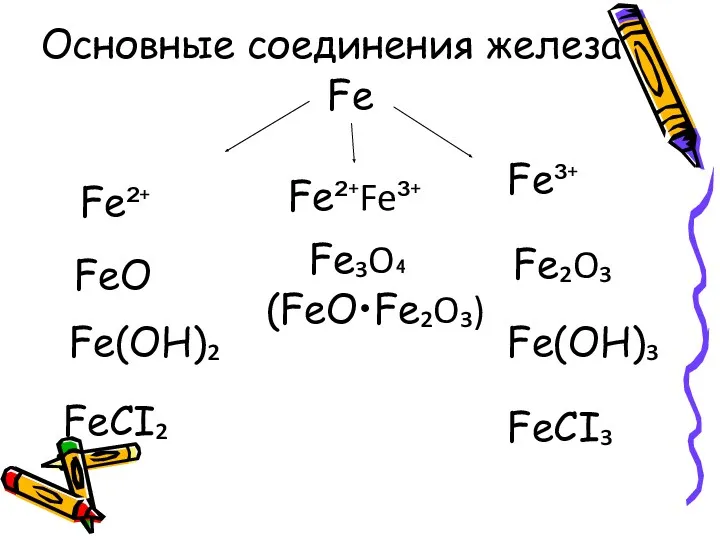
- 8. Fe Fe²⁺ Fe³⁺ FeO Fe(OH)₂ FeCI₂ Fe₂O₃ Fe(OH)₃ FeCI₃ Основные соединения железа Fe²⁺Fe³⁺ Fe₃O₄ (FeO•Fe₂O₃)
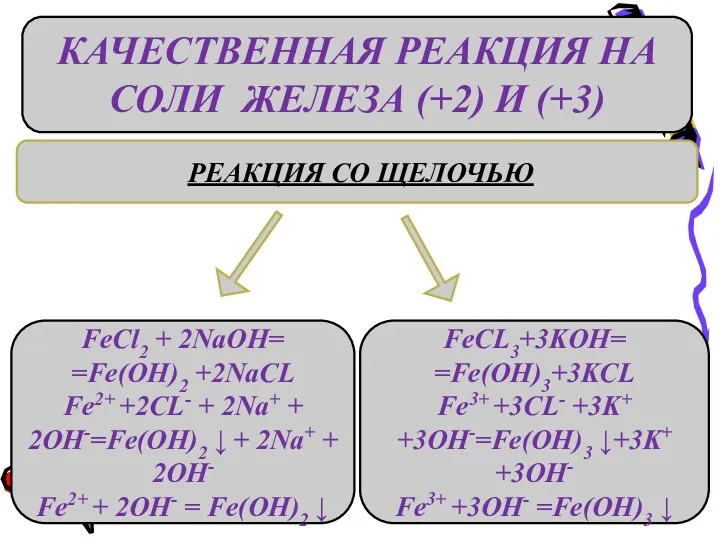
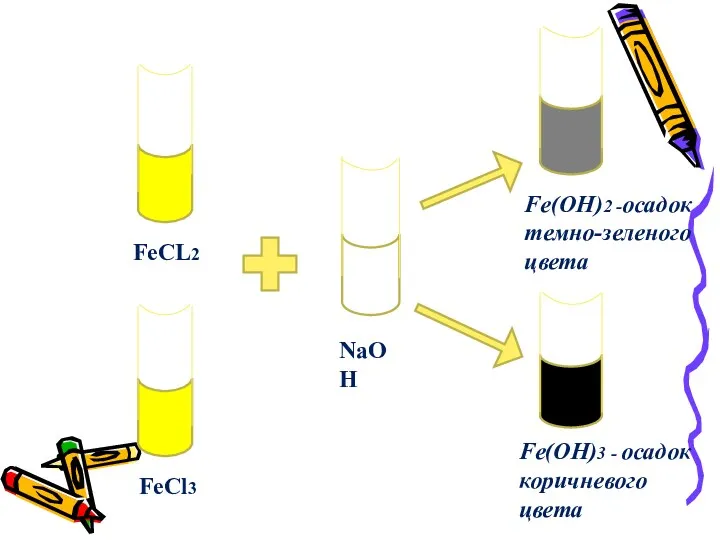
- 11. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СОЛИ ЖЕЛЕЗА (+2) И (+3) РЕАКЦИЯ СО ЩЕЛОЧЬЮ FeCl2 + 2NaOH= =Fe(OH)2 +2NaCL
- 12. FeCL2 FeCl3 NaOH Fe(OH)2 -осадок темно-зеленого цвета Fe(OH)3 - осадок коричневого цвета
- 13. Качественные реакции на ионы Fe²⁺ и Fe³⁺ Fe³⁺ реактив – роданид калия KSCN Fe³⁺ реактив –
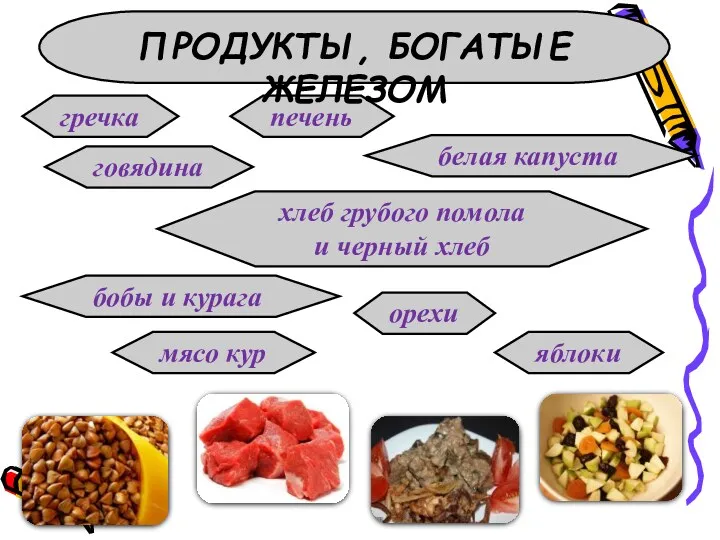
- 14. гречка говядина печень белая капуста хлеб грубого помола и черный хлеб бобы и курага орехи мясо
- 15. Токсичность железа Избыточная доза железа – 200мг и выше может вызвать отравление Железо занимает 5 –е
- 17. Скачать презентацию








 Закон Авогадро. Молярный объем газов
Закон Авогадро. Молярный объем газов Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Химия элементов VIIA группы
Химия элементов VIIA группы Презентация лекция 10 Реактора МБ
Презентация лекция 10 Реактора МБ Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Алюминий. Природные соединения алюминия
Алюминий. Природные соединения алюминия Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Вуглеводи
Вуглеводи Азот. Нахождение азота в природе
Азот. Нахождение азота в природе История микроскопа
История микроскопа Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Полимерные материалы
Полимерные материалы Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Алкены. Гомологический ряд и изомерия
Алкены. Гомологический ряд и изомерия Сополимеры в стоматологии
Сополимеры в стоматологии Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия Газовая хроматография
Газовая хроматография Химия и здоровье
Химия и здоровье Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Р-элементы IV группы
Р-элементы IV группы Удобрения. 9 класс
Удобрения. 9 класс Углерод
Углерод Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Характеристика элементов VI группы .Кислород. Озон
Характеристика элементов VI группы .Кислород. Озон Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы