Содержание
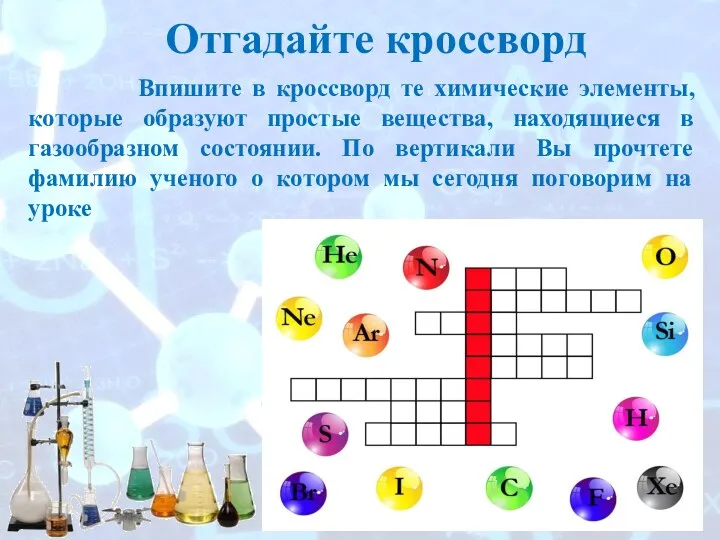
- 2. Впишите в кроссворд те химические элементы, которые образуют простые вещества, находящиеся в газообразном состоянии. По вертикали
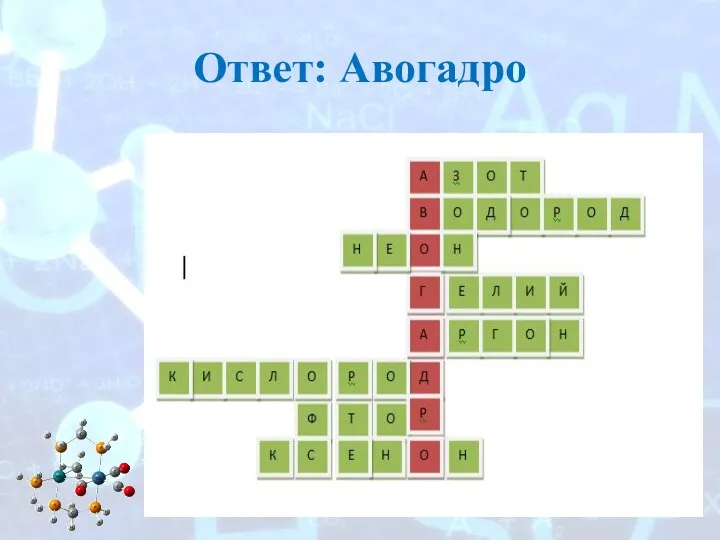
- 3. Ответ: Авогадро
- 4. Тема урока: Закон Авогадро. Молярный объем газов
- 5. Открытие и формулировка закона Итальянский ученый Амедео Авогадро обратил внимание на то, что все газы одинаково
- 6. Закон Авогадро Амедео Авогадро (1776 – 1856) В равных объёмах различных газов при одинаковых условиях содержится
- 7. Объяснение закона Авогадро 1 следствие При н.у. 1 моль любого газа занимает объем, равный 22,4 л
- 8. Vm = 22,4 л/моль Vm = V/n Нормальные условия (н.у.): p = 1 атм (101,325 кПа)
- 9. Объяснение закона Авогадро 2 следствие Т.к. 1 моль газа при н.у. занимает V=22,4, зная массу 1
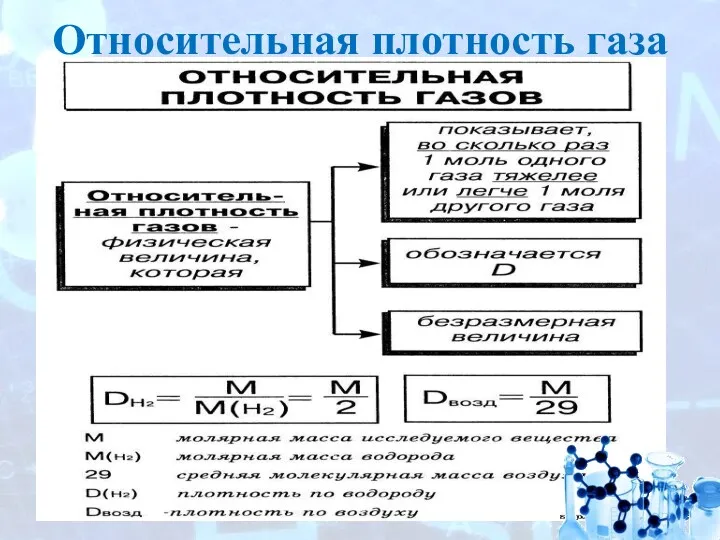
- 10. Относительная плотность газа
- 11. Плотности газов, измеренные при одинаковых условиях, относятся как их молярные массы M = 2DH2 M =
- 12. Закрепление изученного материала Решите задачи: Какой объем занимает 0,2 моль N2 при н.у.? Дано: Решение: Vm
- 14. Скачать презентацию








 О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Способы выражения состава растворов
Способы выражения состава растворов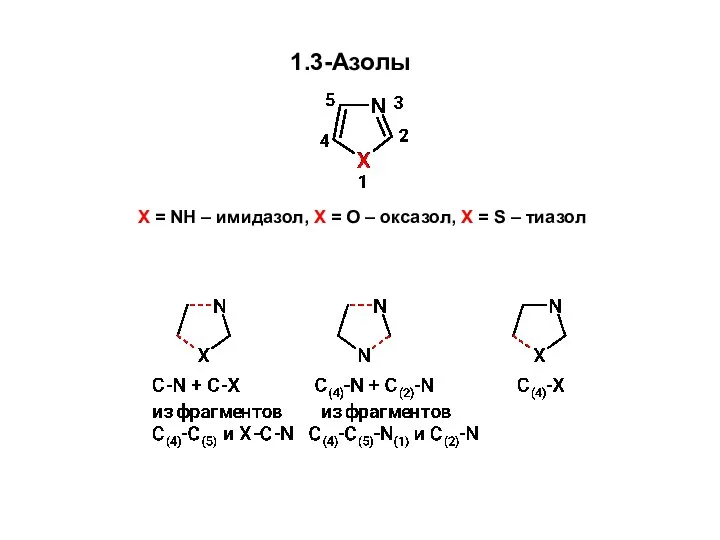 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Характеристика элемента по его положению в периодической системе химических элементов (1)
Характеристика элемента по его положению в периодической системе химических элементов (1) Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Оксиды и гидроксиды
Оксиды и гидроксиды Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода Алкани
Алкани Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Протекание ОВР зависит от рН среды
Протекание ОВР зависит от рН среды Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Литий. Общая характеристика элементов подгруппы 1А
Литий. Общая характеристика элементов подгруппы 1А Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева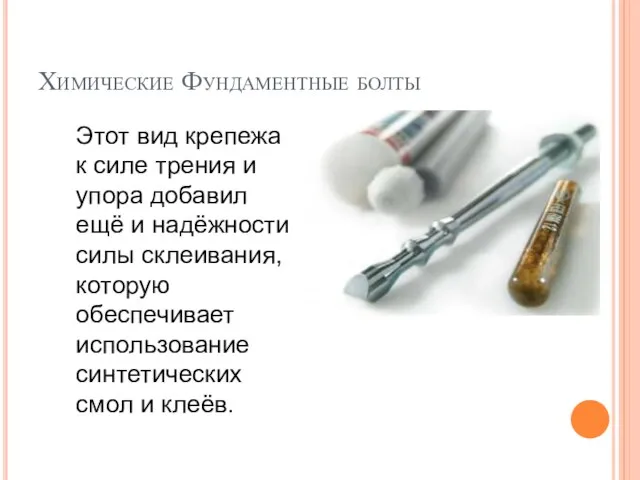 Химические фундаментные болты
Химические фундаментные болты Характер затвердевания
Характер затвердевания Понятие Химический элемент
Понятие Химический элемент Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Кристаллохимия негіздері
Кристаллохимия негіздері Алюминий и его свойства
Алюминий и его свойства Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі Единство химической организации живых организмов
Единство химической организации живых организмов Альдегиды и кетоны
Альдегиды и кетоны Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии