Содержание
- 2. Распространение хлора в природе В природе хлор встречается только в виде соединений в составе минералов: сильвина
- 3. Открытие хлора 1774 год Шведский аптекарь Карл Шееле «Я поместил смесь черной магнезии с муриевой кислотой
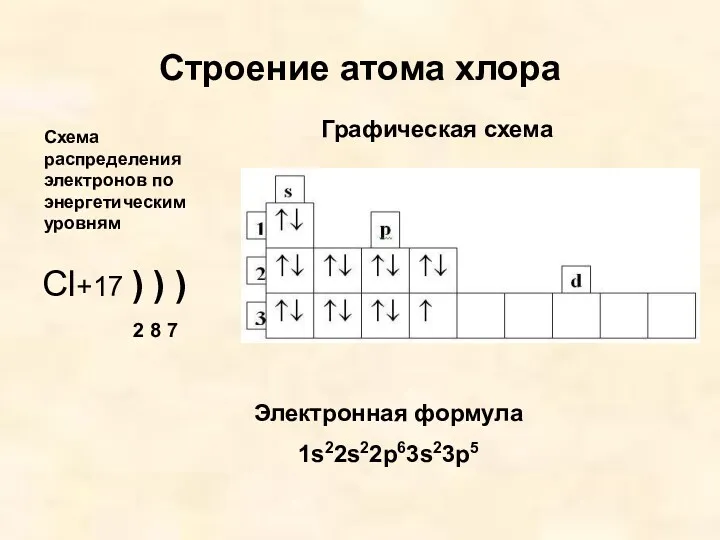
- 4. Строение атома хлора Cl+17 ) ) ) 2 8 7 Графическая схема Схема распределения электронов по
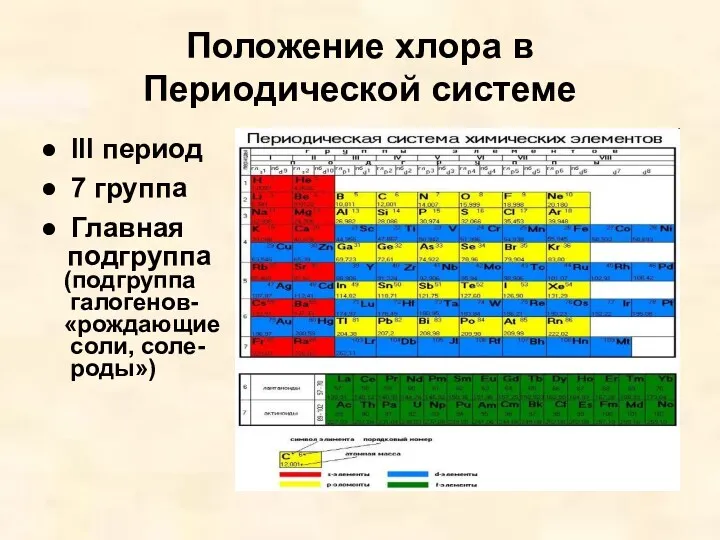
- 5. Положение хлора в Периодической системе lll период 7 группа Главная подгруппа (подгруппа галогенов- «рождающие соли, соле-
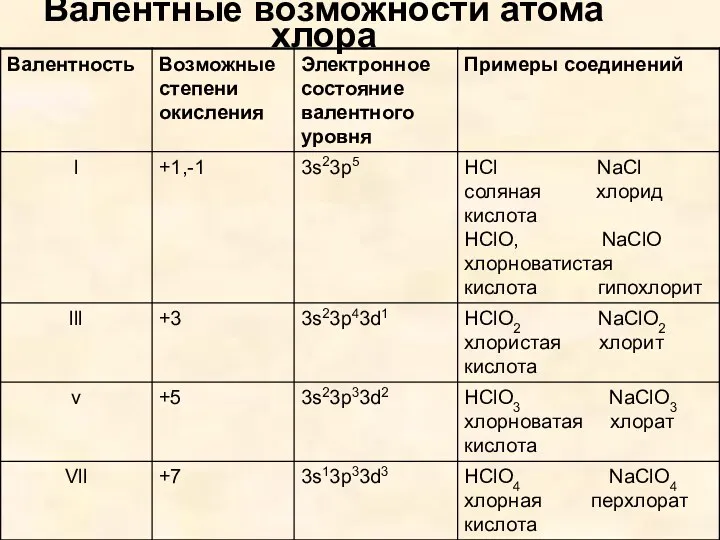
- 6. Валентные возможности атома хлора
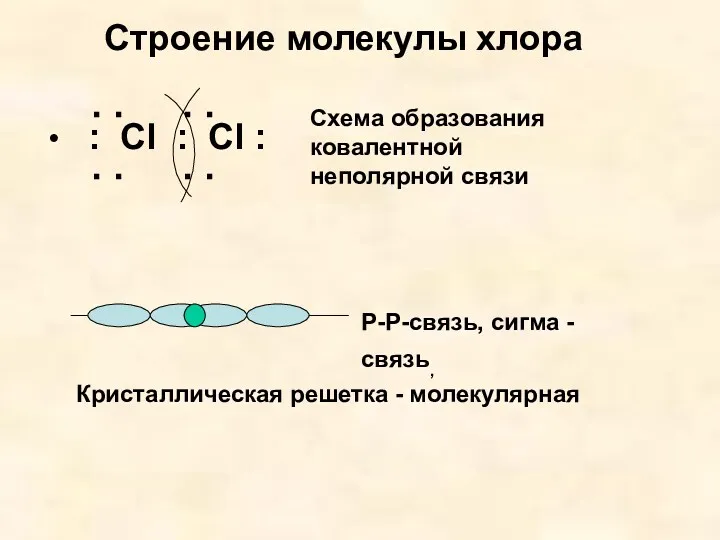
- 7. Строение молекулы хлора : Cl : Cl : : : : : Схема образования ковалентной неполярной
- 8. Физические свойства хлора удушливый газ желто-зеленого цвета имеет резкий запах хорошо растворим в воде плотность по
- 9. Химические свойства хлора Хлор- сильный окислитель: 1).Взаимодействует с металлами железом: 2Fe + 3Cl2→2FeCl3 медью: Cu +
- 10. Химические свойства хлора 3).Влажный хлор обесцвечивает красители на свету: 2Cl2 + 2Н2О → 4НСl + O2
- 11. Роль хлора в организме: Организм человека содержит 0,25 % ионов хлора Cl¯ по массе Хлор участвует
- 12. Запомни! Вдыхание хлора вместе с воздухом вызывает раздражение слизистых оболочек дыхательных путей, которое может закончиться отеком
- 13. Где содержится хлор Потребность в микроэлементе хлоре В сутки человеку достаточно от 2 до 4 г
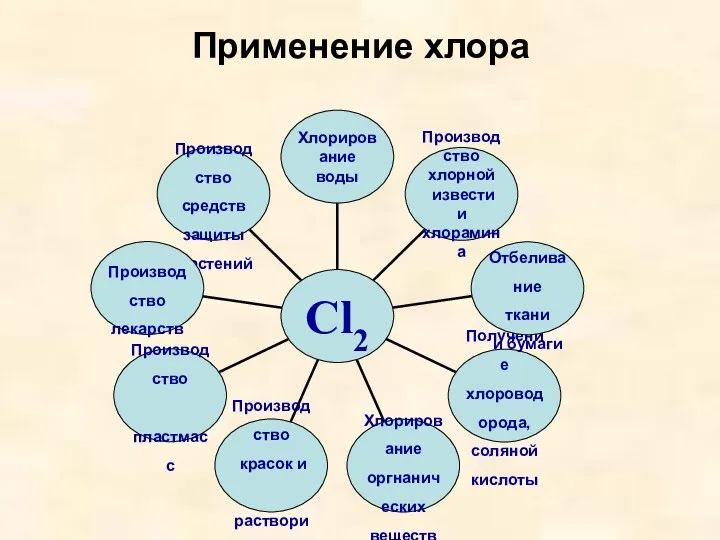
- 14. Применение хлора
- 15. Ответьте на вопросы Что вы знаете об истории открытия хлора? Каков «адрес» хлора в Периодической системе?
- 16. Домашнее задание § 25,26,упр.6,9(стр.131),упр.3,6(стр.134). При подготовке домашнего задания предлагаю вам заглянуть на мой сайт: https://sites.google.com/site/kazancevaevgenia/home Там
- 17. Использованные материалы http://www.gifanimation.ru/index_new.htm- анимированные картинки, 04.10.2010 http://cor.edu.27.ru- строение электронных оболочек галогенов, 04.10.2010 http://karapina.ucoz.ru- открытие галогенов, 04.10.2010
- 19. Скачать презентацию











 Неметаллические материалы
Неметаллические материалы Кислород
Кислород Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Основания. 8 класс
Основания. 8 класс Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Observing change. Chemical reactions
Observing change. Chemical reactions Виды химической связи
Виды химической связи Составление формул химических соединений
Составление формул химических соединений Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Элементы VIА группы
Элементы VIА группы Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Амины
Амины Обмен липидов
Обмен липидов Кислоты, их классификация и свойства. 8 класс
Кислоты, их классификация и свойства. 8 класс Сурьма. Положение в периодической системе химических элементов Менделеева
Сурьма. Положение в периодической системе химических элементов Менделеева Гідроліз солей
Гідроліз солей Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Материаловедение. Химические волокна
Материаловедение. Химические волокна Chemical Bonding I: Basic Concepts
Chemical Bonding I: Basic Concepts Тепловой эффект химической реакции
Тепловой эффект химической реакции Analytical chemistry methods
Analytical chemistry methods Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Азот, строение, свойства. Круговорот азота в природе
Азот, строение, свойства. Круговорот азота в природе Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии