Содержание
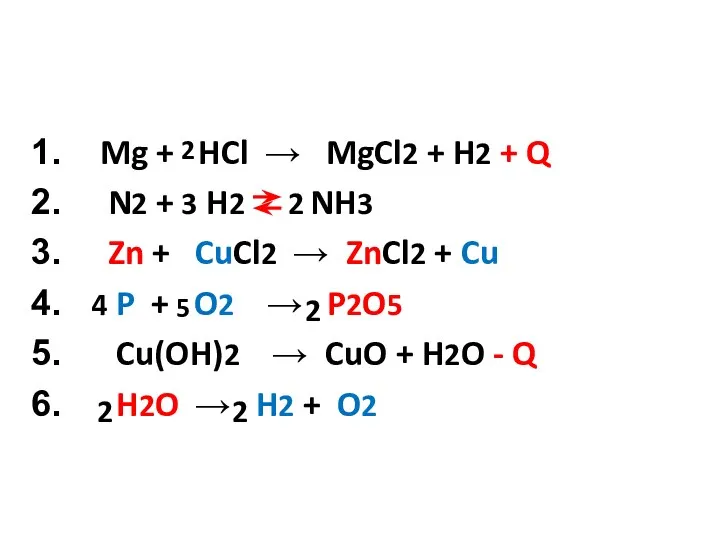
- 2. Mg + HCl → MgCl2 + H2 + Q N2 + H2 NH3 Zn + CuCl2
- 3. 1 2 3 4 5 6
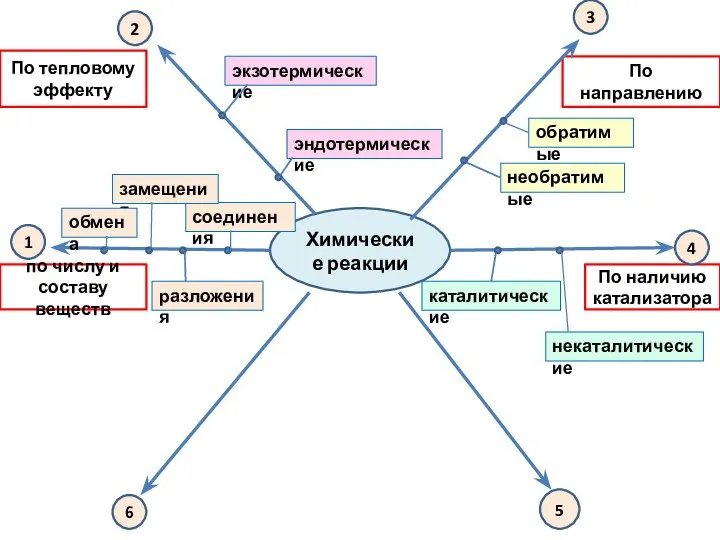
- 4. Реакции обмена
- 5. Техника безопасности! Эксперимент
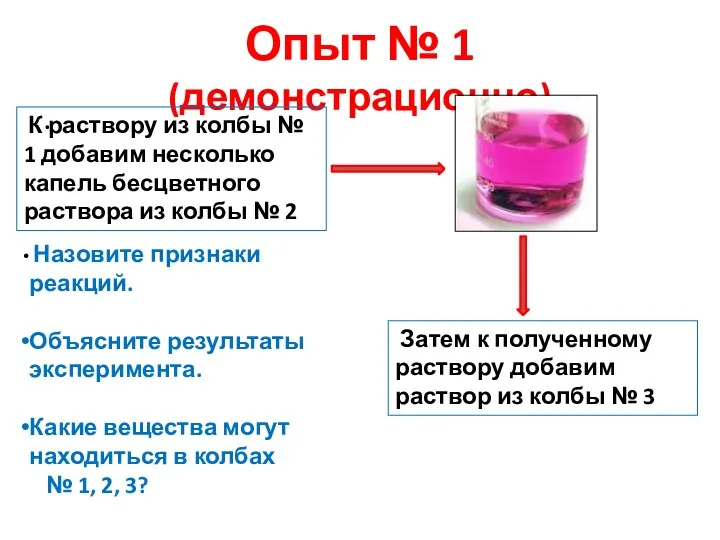
- 6. Опыт № 1 (демонстрационно) . К раствору из колбы № 1 добавим несколько капель бесцветного раствора
- 7. Взаимодействие гидроксида натрия и соляной кислоты: NaOH + HCl ф/ф → Na Cl + H2O +1
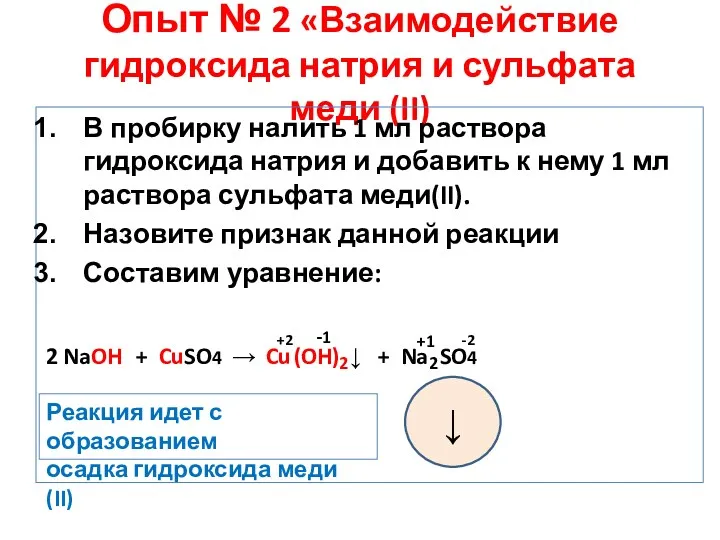
- 8. Опыт № 2 «Взаимодействие гидроксида натрия и сульфата меди (II) В пробирку налить 1 мл раствора
- 9. Опыт № 3 (самостоятельно) Прочтите инструкцию (учебник, стр. 190) и рассмотрите рис. 111 на стр 190.
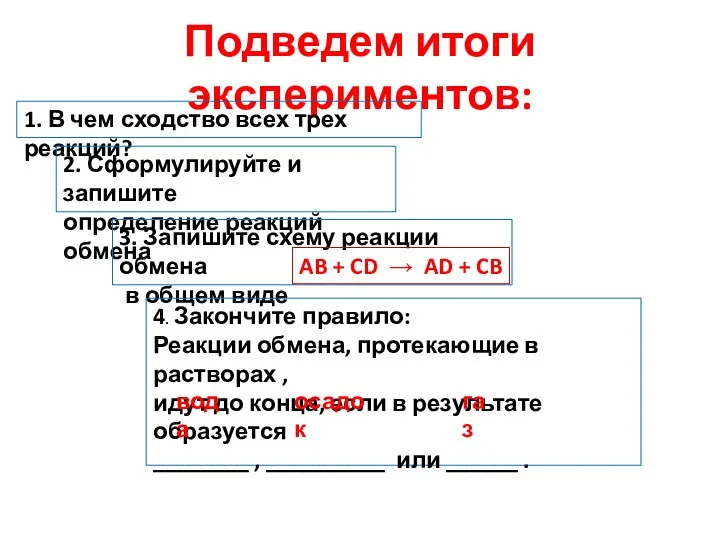
- 10. Подведем итоги экспериментов: 1. В чем сходство всех трех реакций? 2. Сформулируйте и запишите определение реакций
- 11. Химические реакции По тепловому эффекту По направлению По наличию катализатора по числу и составу веществ 3
- 13. Скачать презентацию





 Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Газовые гидраты
Газовые гидраты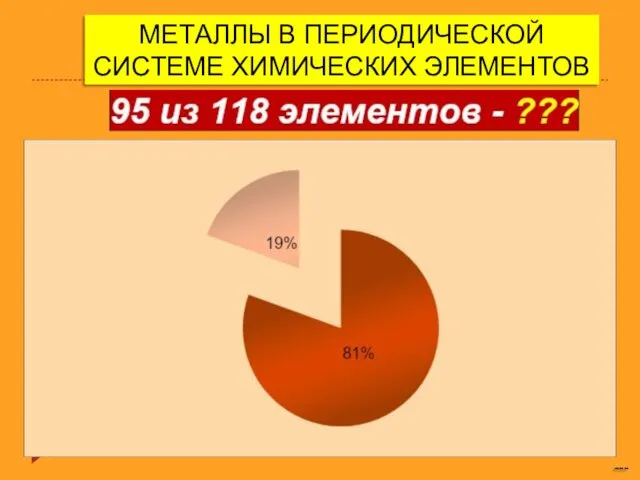 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Моющие средства
Моющие средства Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Алюминий и его соединения
Алюминий и его соединения Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Термический анализ
Термический анализ Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Кислород и оксиген
Кислород и оксиген Нитраттарды қолдану
Нитраттарды қолдану Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Металлы и сплавы. Общие сведения о металлах и сплавах
Металлы и сплавы. Общие сведения о металлах и сплавах Элементы VIА группы
Элементы VIА группы Химическая промышленность
Химическая промышленность Основные классы неорганических соединений
Основные классы неорганических соединений Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии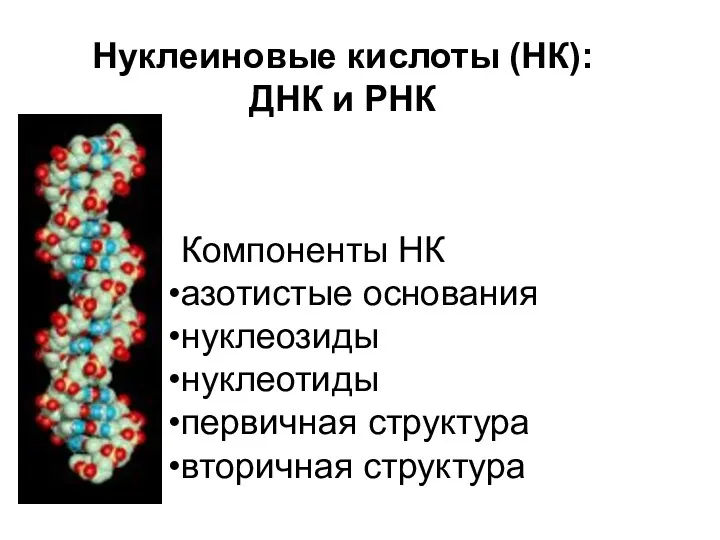 Нуклеиновые кислоты
Нуклеиновые кислоты Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі
Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі Карбоновые кислоты
Карбоновые кислоты Ауыр түсті металдар
Ауыр түсті металдар