Содержание
- 2. 1. ПЕРИОДИЧЕСКИЙ ЗАКОН 2. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ 3. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ 4. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
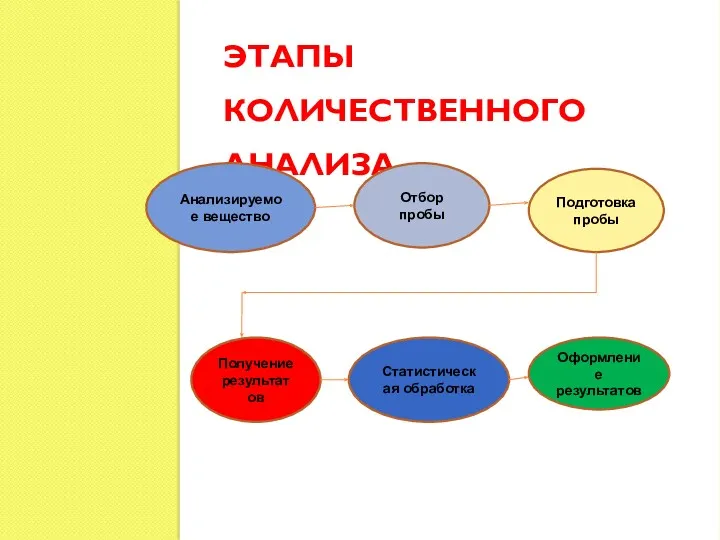
- 3. ЭТАПЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА Анализируемое вещество Отбор пробы Подготовка пробы Получение результатов Статистическая обработка Оформление результатов
- 4. Фактор эквивалентности – это безразмерная величина, которая рассчитывается на основании стехиометрических коэффициентов реакции, равная или меньше
- 5. ƒэкв.(кислоты) = _1_ [H] ƒэкв.(HCl)= 1/[H]=1|1 ƒэкв.(H2SO4)= 1/[H]=1|2 ƒэкв.(гидроксида) = _1__ [OH] ƒэкв.(KOH)= 1/[OH]=1|1 ƒэкв.Ba(OH)2= 1/[OH]=1|2
- 6. В окислительно-восстановительных реакциях фактор эквивалентности определяется по количеству отданных или принятых электронов: 10FeSO4 + 2KMn+7O4 +8Н2SO4
- 7. 10FeSO4 + 2KMn+7O4 +8Н2SO4 = 5Fe2(SO4)3 +2Mn2+SO4 + К2SO4 + +8Н2О Fe 2+ -1e → Fe
- 8. Молярная масса эквивалента вещества – это масса одного моля эквивалента этого вещества. Её записывают и рассчитывают
- 9. МАССОВАЯ ДОЛЯ - отношение массы растворенного вещества к общей массе раствора: m(Х) ω(Х) = ------------------ m(р-ра)
- 10. Массовую долю растворённого вещества ω(Х) обычно выражают в %; она показывает содержание массы растворённого вещества в
- 11. Молярная концентрация – отношение количества растворенного вещества к объёму раствора (количество молей растворенного вещества в 1
- 12. m(Х) – масса растворенного вещества Х, г; M(Х) – молярная масса растворенного вещества Х, г; V
- 13. Молярная концентрация эквивалента – отношение количества вещества эквивалента в растворе к объёму этого раствора или количество
- 14. n(ƒэкв.) С(ƒэкв.) = ---------------⋅1000 (моль/л или М) V m(Х) С(ƒэкв.) = ---------------⋅1000, (моль/л или М), где
- 15. Титр – масса вещества в г, содержащаяся в 1 мл раствора, обозначается: m(X) Т(Х) =-----------, г/мл
- 16. Титр может определяться по формуле: С(Х) · М(Х) Т(Х) =--------------- (г/мл) 1000
- 17. Титр связан с молярной концентрацией эквивалента уравнением: С(ƒэкв.) ·М(ƒэкв.) Т(Х) =---------------------------- ( г/мл) 1000
- 18. Титр раствора по определяемому веществу (Т А/Х) – масса определяемого вещества (Х) в г, реагирующая с
- 19. Поправочный коэффициент – число, показывающее, во сколько раз практическая концентрация (навеска) больше или меньше заданной (расчётной,
- 20. Закон эквивалентов, в соответствии с которым число эквивалентов взаимодействующих и образующихся веществ равно Для произвольной реакции
- 21. Химическая посуда в количественном анализе
- 22. бюретки
- 23. Мерные колбы
- 24. Цилиндры
- 25. Конические колбы
- 26. пипетки
- 27. Пенициллиновые склянки
- 28. Гравиметрический анализ Совокупность методов количественного анализа, основанных на выделении определяемого количества в виде какого-либо соединения и
- 29. Титриметрический анализ Титрование – непрерывно контролируемый процесс постепенного добавления одного вещества (титранта) другому (опрееляемому) Момент, в
- 30. Титриметрический анализ Реакции, протекающие при титровании и в точке эквивалентности, называются титриметрическими Методы титрования называются в
- 31. Методы титрования Прямое титрование Обратное титрование Заместительное титрование Титрование с разведением Титрант – реагент с точно
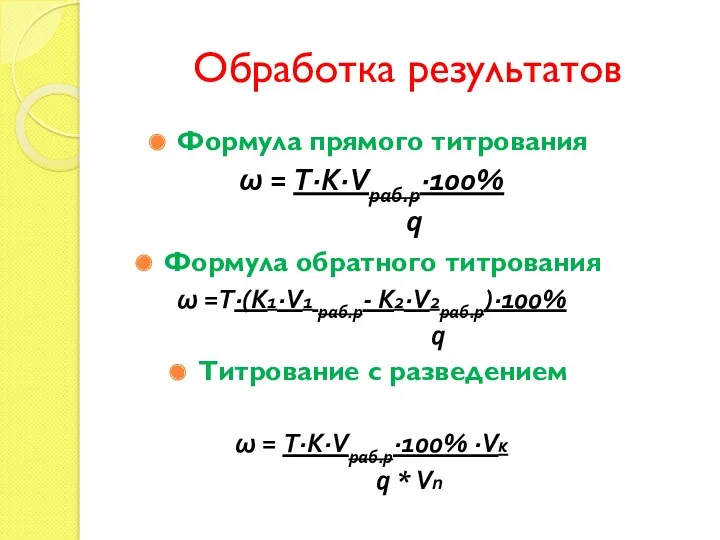
- 32. Обработка результатов Формула прямого титрования ω = Т·K·Vраб.р·100% q Формула обратного титрования ω =Т·(K1·V1 раб.р- K2·V2раб.р)·100%
- 33. Индикаторы Индикатор – средство, позволяющее путем визуального наблюдения установить достижение точки эквивалентности Цветные индикаторы: одноцветные и
- 34. Электрохимические методы Основаны на явлениях, протекающих на электродах или в межэлектродном пространстве Полярография Потенциометрия Кулонометрия кондуктометрия
- 35. Спектроскопические методы В основе метода лежат спектральные процессы Люминесцентные методы Эмиссионные методы Рефрактометрические методы Колориметрический анализ
- 36. Рефрактометрические метод
- 37. Рефрактометр:
- 38. Рефрактометр:
- 39. Рефрактометр
- 40. рефрактометрия 1,333 1,334 1,335 1,333 1,334
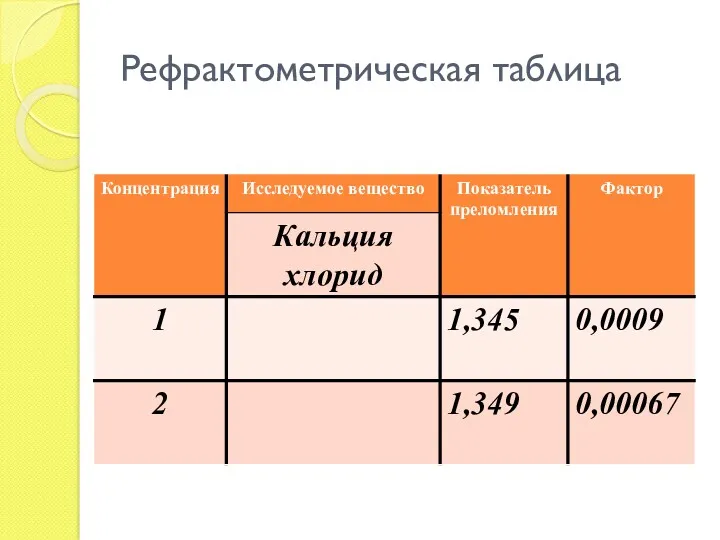
- 41. Рефрактометрическая таблица
- 42. Правила работы на рефрактометре Нанести на нижнюю призму каплю воды очищенной, показатель преломления должен быть 1,333
- 43. Показатель преломления Сравнивают с рефрактометрической таблицей, если n = табличное значение, сразу определяют концентрацию раствора
- 44. Показатель преломления если точное значение показателя преломления (n) отсутствует в таблице, концентрацию определяют по формуле: n
- 46. Скачать презентацию


![ƒэкв.(кислоты) = _1_ [H] ƒэкв.(HCl)= 1/[H]=1|1 ƒэкв.(H2SO4)= 1/[H]=1|2 ƒэкв.(гидроксида) =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287948/slide-4.jpg)





































 Carbohydrates (sugars)
Carbohydrates (sugars) Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Алюминий. Строение
Алюминий. Строение Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Коллигативные свойства растворов
Коллигативные свойства растворов Элементы теории горения
Элементы теории горения Physiology lab
Physiology lab Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Высокомолекулярные соединения
Высокомолекулярные соединения Сахароза
Сахароза Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Соединения железа
Соединения железа Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Значение органической химии в жизни человека
Значение органической химии в жизни человека Степень окисления в органической химии
Степень окисления в органической химии Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Ионная связь
Ионная связь Строение атома
Строение атома Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химический элемент титан
Химический элемент титан