Содержание
- 2. Виды оксидов азота N2O NO N2O3 NO2 N2O5 +1 +2 +3 +4 +5 N2O – оксид
- 3. N2O- оксид азота (I) II IV II N=N=O Против всех правил Степень окисления не всегда совпадает
- 4. Оксид азота (I) N2O Получение. Разложение нитрата аммония при нагревании: NH4NO3 = N2O + 2H2O Нагрев
- 5. NO-оксид азота (II) Несолеобразующий оксид. Бесцветный газ, не имеет запаха. В воде малорастворим. Термически устойчив. Образуется
- 6. Оксид азота (II) NO Получение. 1. При реакции неактивных металлов с разбавленной азотной кислотой: 3Cu +
- 7. Химические свойства. Очень реакционноспособное вещество. Может проявлять и окислительные и восстановительные свойства. 1. При обычной температуре
- 8. N2O3-оксид азота (III) Жидкость, темно – синего цвета, термически неустойчива, t кип.= 3,5 С, т. е.
- 9. Оксид азота (III) N2O3 Получить можно при сильном охлаждении эквимолярной смеси NO и NO2: NO +
- 10. Оксид азота (IV) «Лисий хвост» Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.
- 11. Оксид азота (IV) NO2 Получение. Термическим разложением нитратов металлов, расположенных в ряду активности в интервале Al-Сu:
- 12. Оксид азота (IV) NO2 Химические свойства. Взаимодействие с водой: 2NO2 + H2O(хол) = HNO3 + HNO2
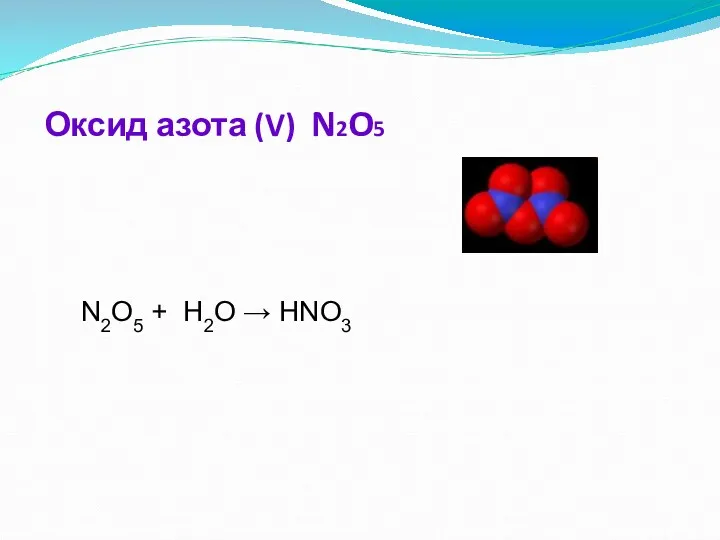
- 13. Оксид азота (V) Бесцветные прозрачные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты : N2O5
- 14. Химические свойства. Оксид азота(V) - кислотный оксид. 1. При растворении в воде образует азотную кислоту: N2O5
- 15. Оксид азота (V) N2O5 N2O5 + H2O → HNO3
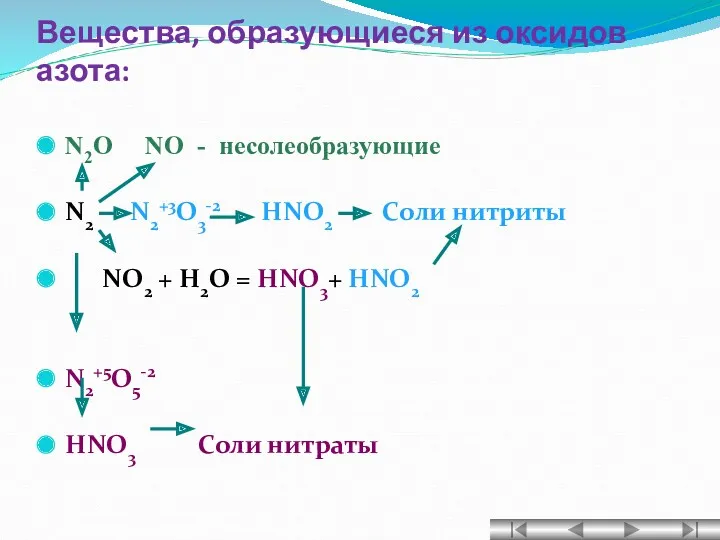
- 16. Вещества, образующиеся из оксидов азота: N2O NO - несолеобразующие N2 N2+3O3-2 HNO2 Соли нитриты NO2 +
- 17. Обобщающие задания. 1.Имеются три закрытых цилиндра: с оксидом азота (IV), с азотом, с аммиаком. Как проще
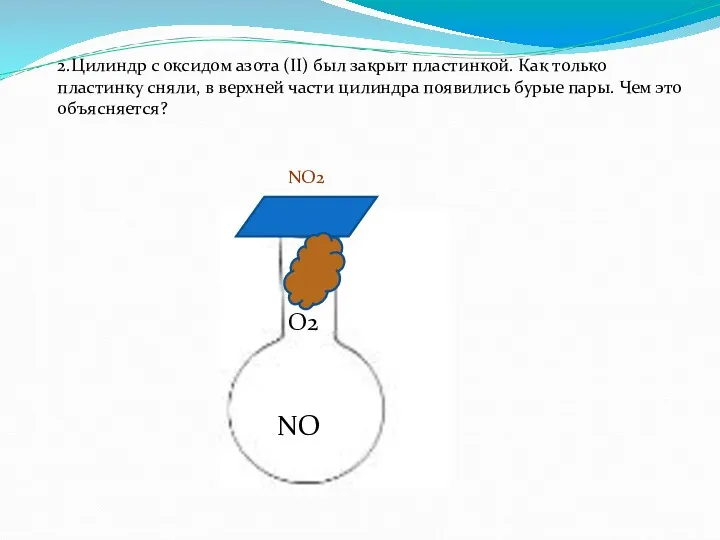
- 18. 2.Цилиндр с оксидом азота (II) был закрыт пластинкой. Как только пластинку сняли, в верхней части цилиндра
- 19. Кислотные дожди
- 20. Влияние кислотных дождей на животных
- 22. Скачать презентацию
















 Кислоты, их состав и названия
Кислоты, их состав и названия Обмен липидов
Обмен липидов Роль воды в химических реакциях
Роль воды в химических реакциях Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) IV группа главная подгруппа
IV группа главная подгруппа Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток Углерод и его соединения
Углерод и его соединения Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Неметаллические материалы
Неметаллические материалы Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Производство полимеров
Производство полимеров Основания. Неорганические соединения
Основания. Неорганические соединения Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Кислотно-основное титрование
Кислотно-основное титрование Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Автомобильные пластичные смазки
Автомобильные пластичные смазки Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Окислительновосстановительное титрование
Окислительновосстановительное титрование