Содержание
- 2. Ферменттер – тіршілік негізі
- 3. Жоспары: Фермент туралы жалпы түсінік Ферменттердің химиялық құрамы және құрылымы Ферменттер атаулары мен жіктемесі Ферменттердің әсер
- 4. Ферменттер (латынша fermentum- ашу немесе enzym, en-ішкі, zyme-ашытқы) тірі ағзада түрлі биохимиялық реакцияларды белсендіруші, биологиялық катализатор.
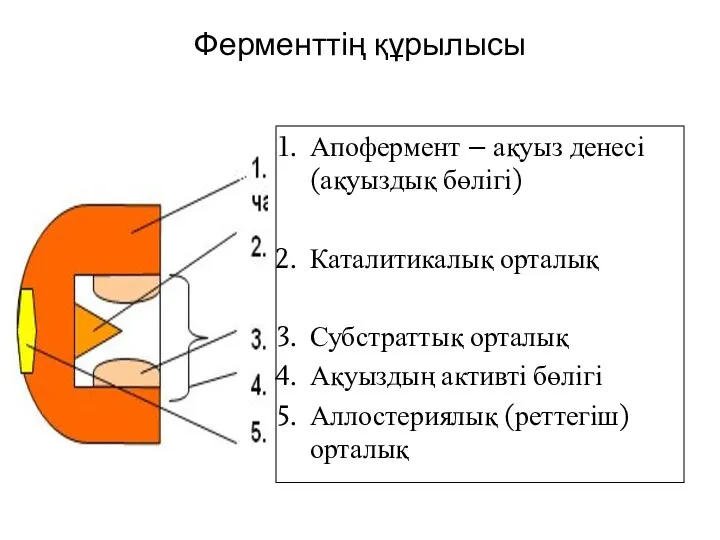
- 5. Ферменттің құрылысы Апофермент – ақуыз денесі (ақуыздық бөлігі) Каталитикалық орталық Субстраттық орталық Ақуыздың активті бөлігі Аллостериялық
- 6. Ферменттің белсенді орталығы Фермент молекуласының субстратпен тікелей тиісіп жанасатын бөлігін ферменттің активті орталығы деп аталады; Активті
- 7. Аллостерлік орталық “Аллостерия” (грек. Allo - басқа, stereos - орын) деген термин “басқа жермен байланысты” не
- 8. Ферменттердің аталуы. Номенклатурасы Ферменттердің кездейсоқ белгілеріне қарай (тривиалды): пепсин (грек. пепсис- асқорыту) - Субстрат атауына байланысты
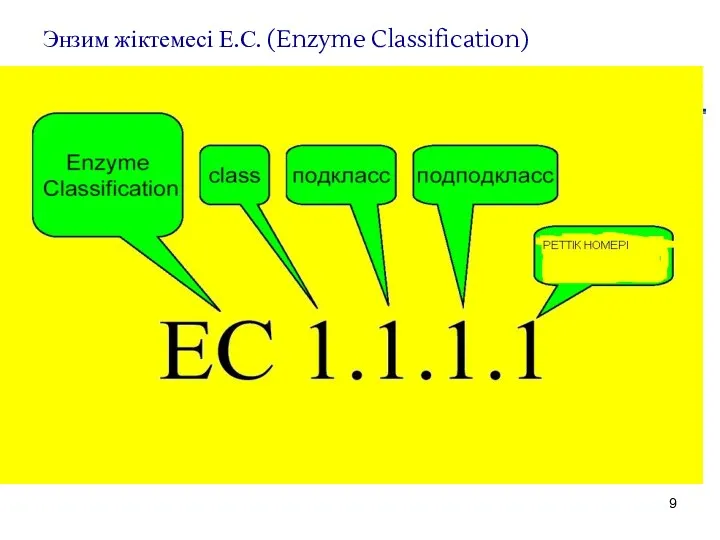
- 9. Энзим жіктемесі Е.С. (Enzyme Classification)
- 10. 1972 ж. ферменттерге арнайы нөмір, шифр берілді. Мысалы, уреаза шифрі – 3.5.1.5. Бірінші сан(3)- уреаза ферменттерің
- 11. Ферменттердің ақуыздық қасиеті: ақуыз тәрізді кристалдануы; нейтралды тұздардың қанық ерітіндісімен әсер еткенде тұнбаға түсуі; түрлі факторлармен
- 12. А.Е.Арбузов: «Болашақтың химиясының қазіргі химиядан қандай айырмашылығы болуы керек? Тірі табиғатқа еліктеу – міне болашақтың химиясының
- 13. Ферменттермен жұмыстың күрделілігі: сақтау кезінде өте тұрақсыздығы, яғни жылдам бұзылып, өзінің белсенділігін жоғалтады Сондықтан, ферменттерді тұрақтандыру,
- 14. Биологиялық катализатор-ферменттердің кәдімгі катализаторлардан айырмашылықтары: катализдейтін нысанаға және қатысатын реакциясына байланысты талғампаздығы. толық стереохимиялық талғампаздығы. кәдімгі
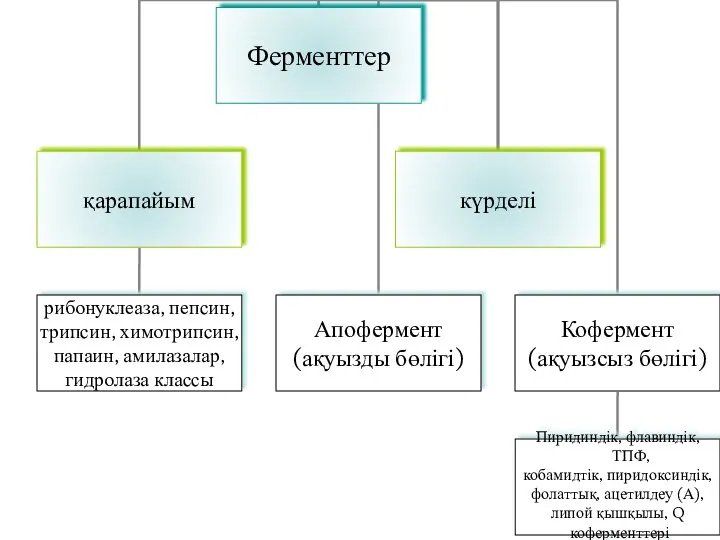
- 16. Ферменттер құрамына қарай: Ақуызды – қарапайым (рибонуклеаза, пепсин, трипсин, химотрипсин, папаин, амилаза және гидролаза класына жататын
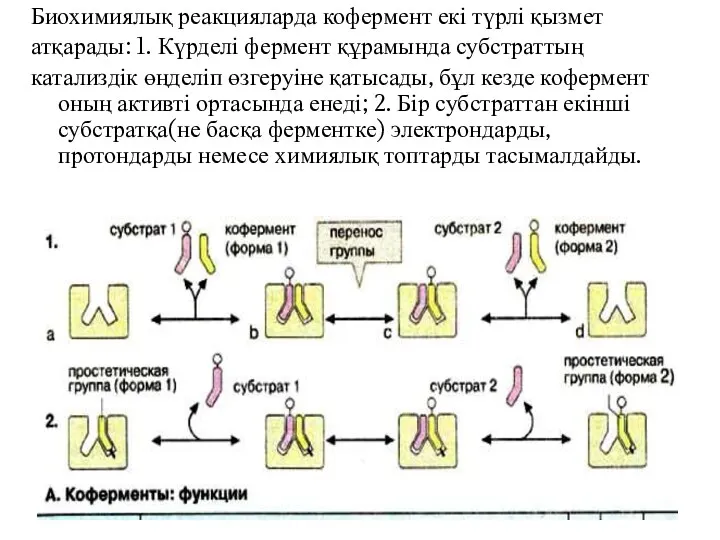
- 17. Биохимиялық реакцияларда кофермент екі түрлі қызмет атқарады: 1. Күрделі фермент құрамында субстраттың катализдік өңделіп өзгеруіне қатысады,
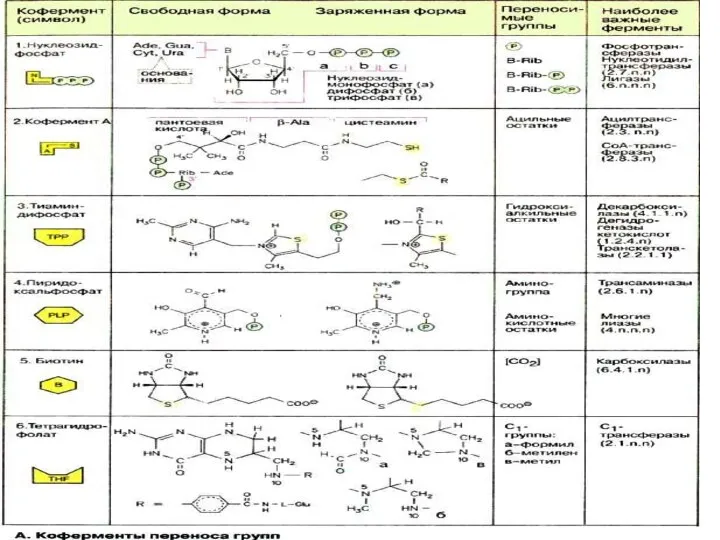
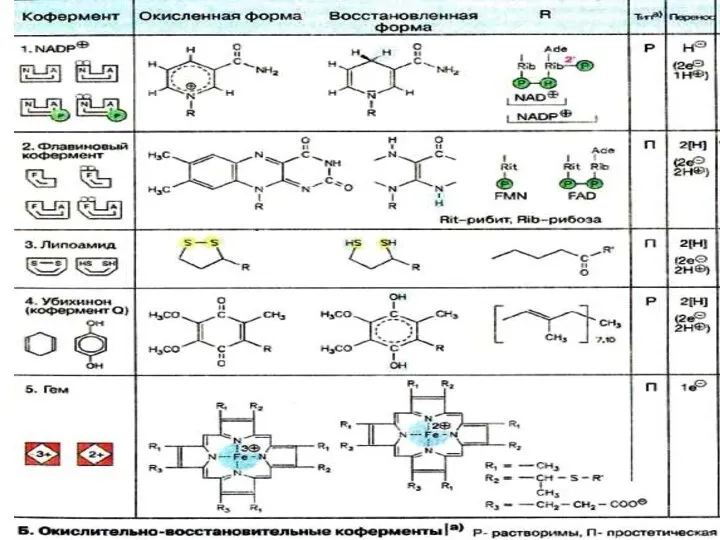
- 20. Коферменттер NAD+ , NADP+ сутек тасымалдаушылар (электрон) никотин қышқылы - витамин РР FAD сутек тасымалдаушылар (электрон)
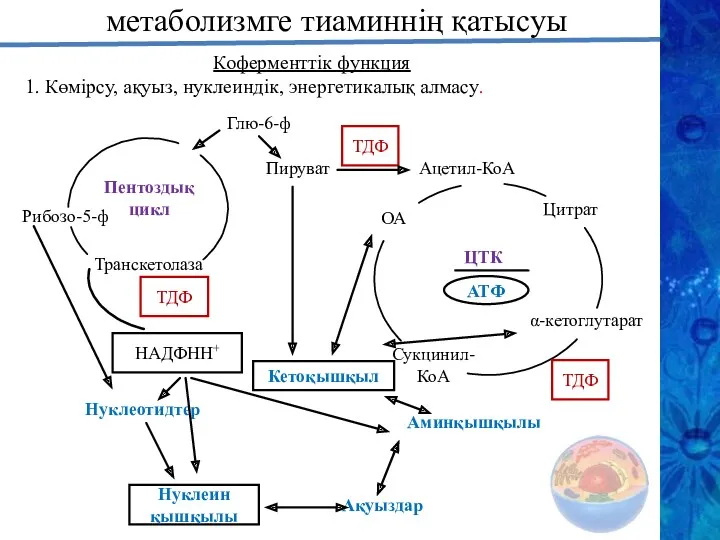
- 21. метаболизмге тиаминнің қатысуы Глю-6-ф Пируват ТДФ Ацетил-КоА ТДФ НАДФНН+ Нуклеотидтер Нуклеин қышқылы Кетоқышқыл Аминқышқылы Ақуыздар Коферменттік
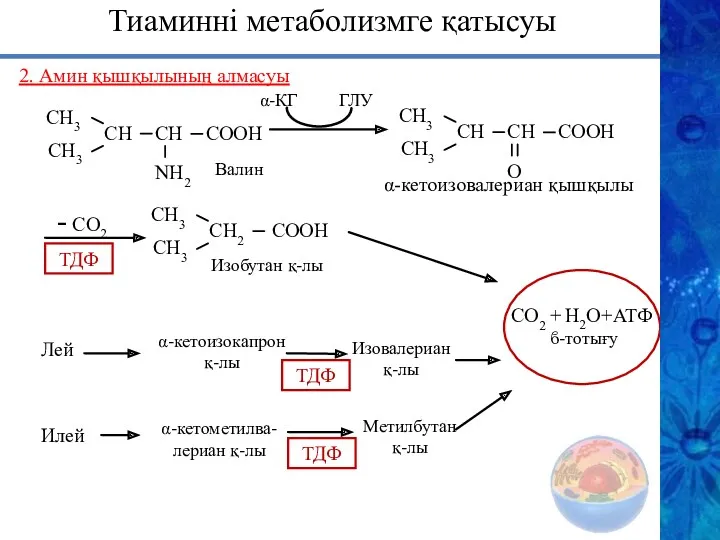
- 22. 2. Амин қышқылының алмасуы ϐ-тотығу СН3 СН3 СН СН NH2 СOOН СН3 СН3 СН СН О
- 23. Тиаминнің метаболизмге қатысуы 2. Кейбір коферменттер ТТФ – нейрондарда энергетикалық алмасу, жүйке импульстарын жүргізу, нейрон мембраналарының
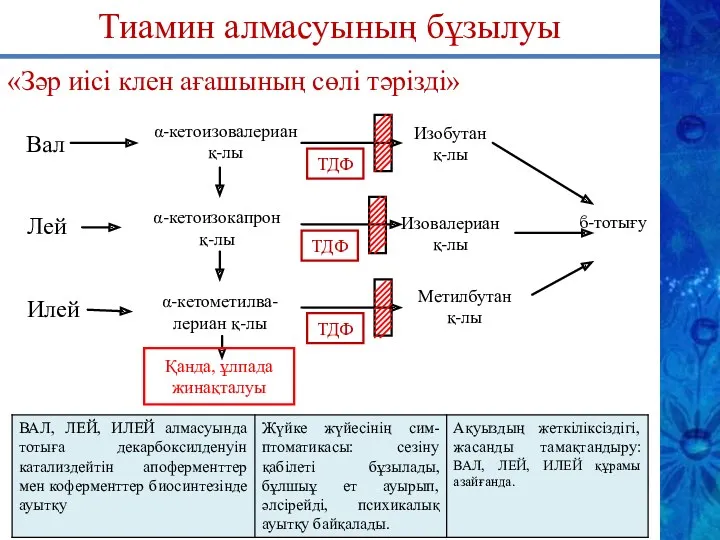
- 24. ϐ-тотығу Тиамин алмасуының бұзылуы «Зәр иісі клен ағашының сөлі тәрізді» α-кетоизовалериан қ-лы ТДФ Лей Илей α-кетоизокапрон
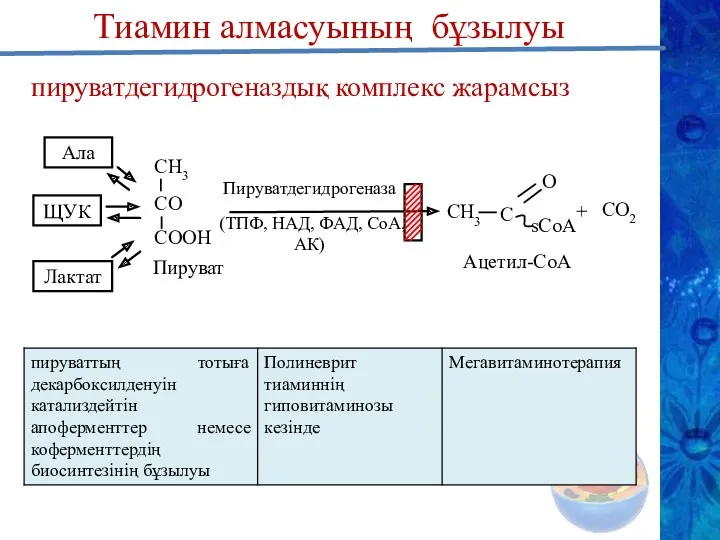
- 25. пируватдегидрогеназдық комплекс жарамсыз СН3 СO СOOН Пируват Ала Лактат ЩУК Пируватдегидрогеназа (ТПФ, НАД, ФАД, СоА, АК)
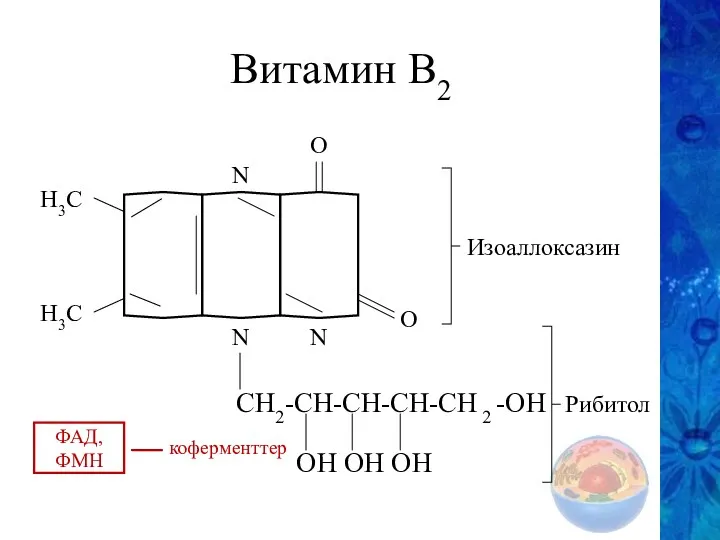
- 26. Витамин В2 О О N N N H3C H3C CH2-CH-CH-CH-CH 2 -OH OH OH OH Изоаллоксазин
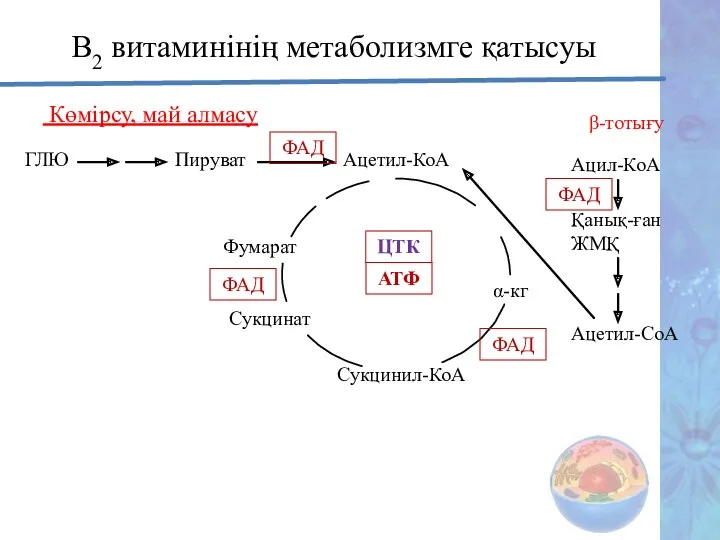
- 27. В2 витаминінің метаболизмге қатысуы Көмірсу, май алмасу ГЛЮ Пируват Ацетил-КоА АТФ ФАД ФАД α-кг Сукцинил-КоА Сукцинат
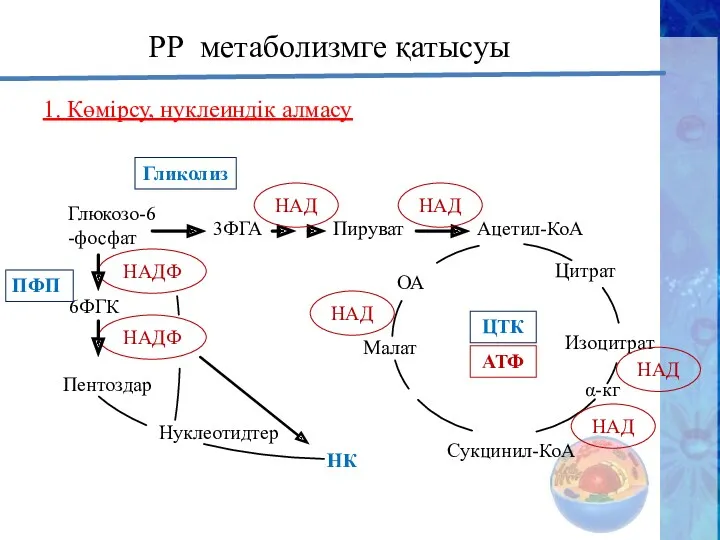
- 28. НАДФ НАДФ РР метаболизмге қатысуы 1. Көмірсу, нуклеиндік алмасу Глюкозо-6-фосфат 3ФГА Пируват Ацетил-КоА 6ФГК Пентоздар Нуклеотидтер
- 29. 2. Липидтік алмасу Ацетил-КоА Холестерин Кетондық денелер Ацил-КоА 3. Биоэнергетикалық алмасу – тыныстану тізбегі (НАД, НАДФ
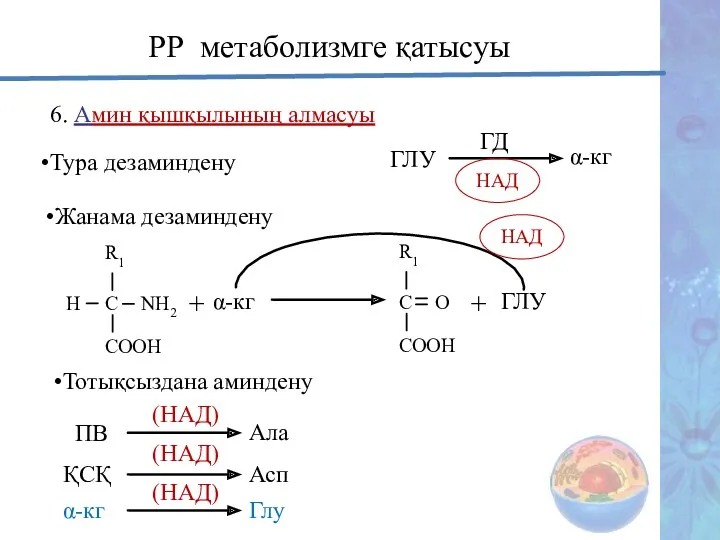
- 30. 6. Амин қышқылының алмасуы Тура дезаминдену ГЛУ ГД НАД α-кг РР метаболизмге қатысуы Жанама дезаминдену R1
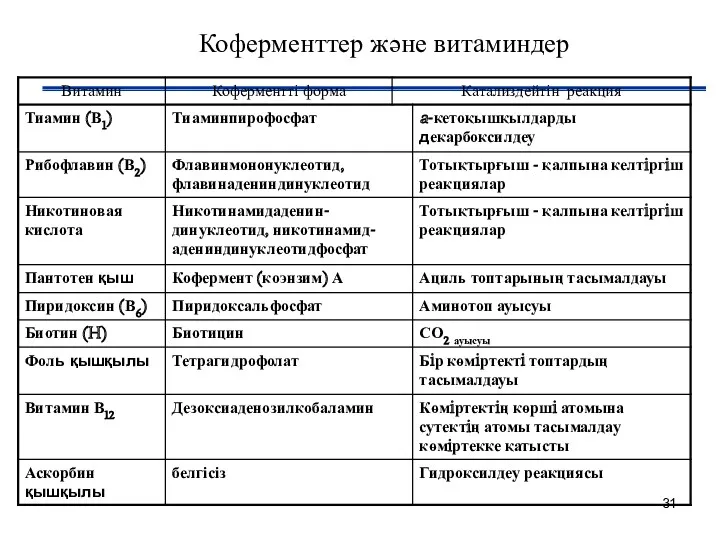
- 31. Коферменттер және витаминдер
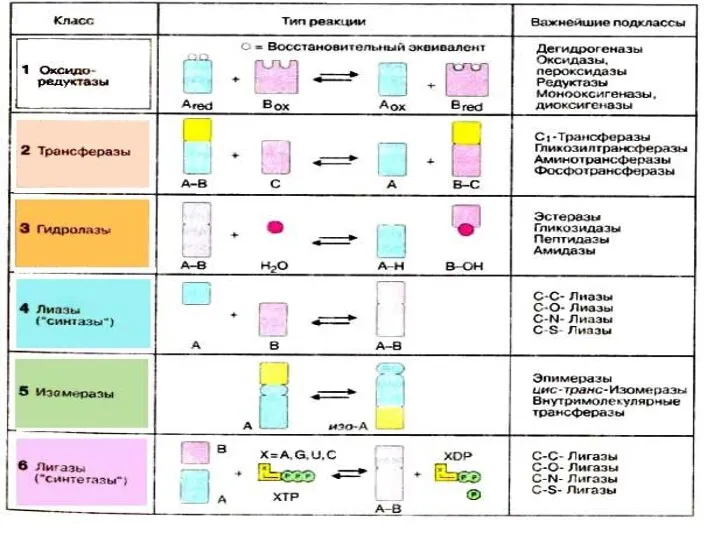
- 32. Ферменттердің жіктемесі 1. Оксидоредуктазалар- Тотығу-тотықсыздану реакциясы 2. Трансфераза- Функционалдық топтарды тасымалдаушы 3. Гидролазалар- Гидролиз реакциясы 4.Лиазалар-
- 34. Энзим жіктемесі– Е.С. (Enzyme Classification) Е.С.1. – оксидоредуктаза (oxidoreductases). Е.С.2. – трансфераза (transferases). Е.С.3. – гидролаза
- 35. Оксидоредуктазалар- субстраттың тотығу тотықсыздану реакцияларының жүру барысын (сутегі атомдарын немесе электрондарды бөліп және қосып алу) жеделдетеді.
- 36. Оксиредуктаза түрлері Дегидрогеназа (редуктаза) Оксидаза Пероксидаза Гидроксилаза Оксигеназан Гидрогеназа
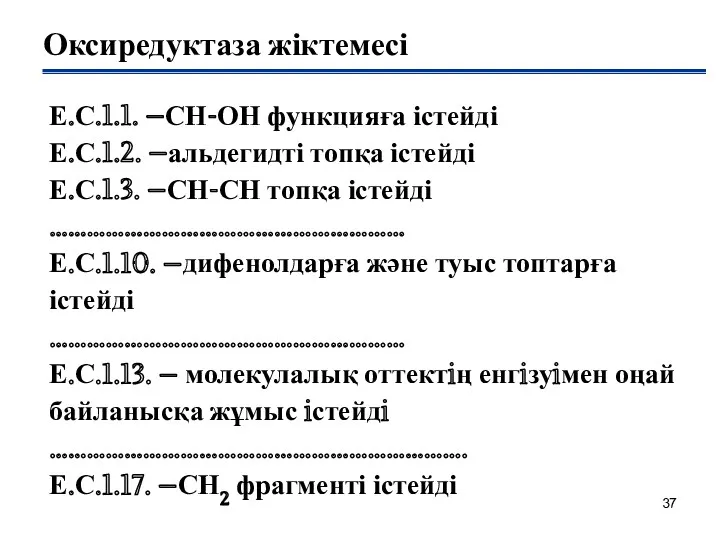
- 37. Оксиредуктаза жіктемесі Е.С.1.1. –СН-ОН функцияға істейді Е.С.1.2. –альдегидті топқа істейді Е.С.1.3. –СН-СН топқа істейді ………………………………………………… Е.С.1.10.
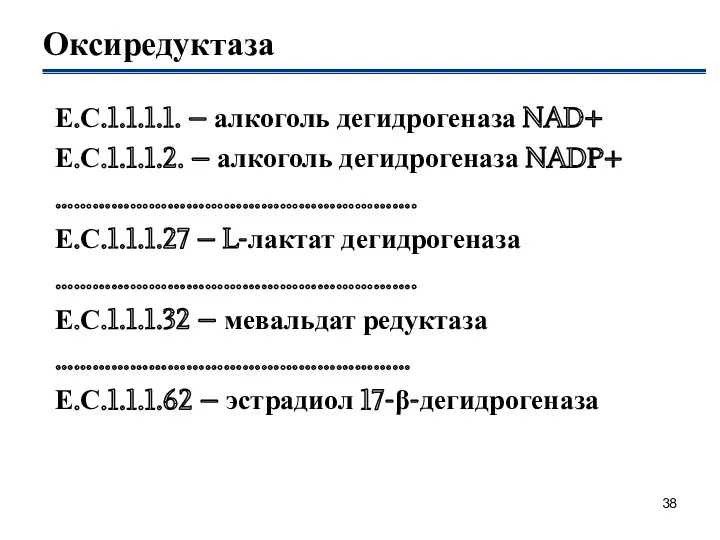
- 38. Оксиредуктаза Е.С.1.1.1.1. – алкоголь дегидрогеназа NAD+ Е.С.1.1.1.2. – алкоголь дегидрогеназа NADP+ …………………………………………………. Е.С.1.1.1.27 – L-лактат дегидрогеназа
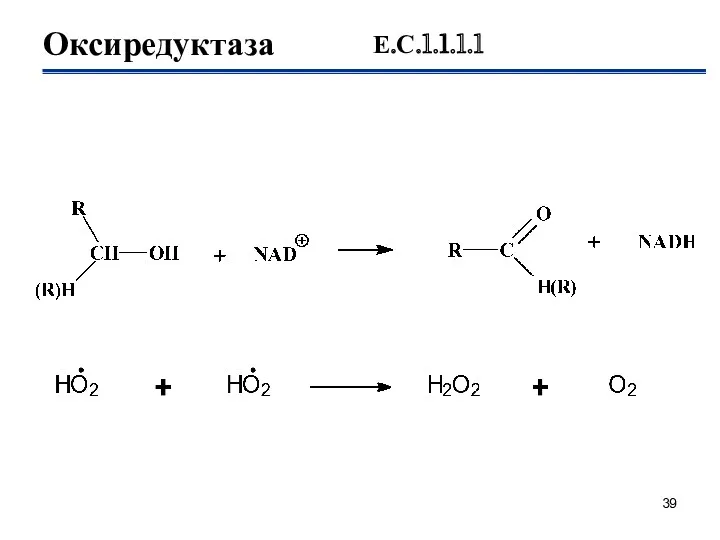
- 39. Оксиредуктаза Е.С.1.1.1.1
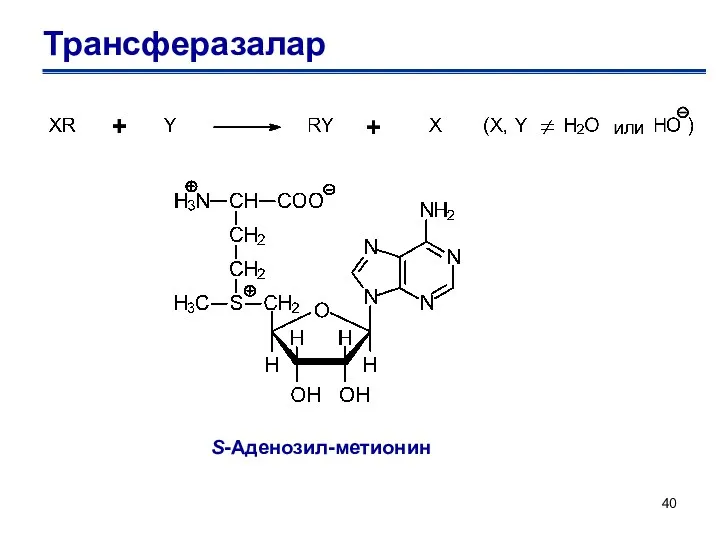
- 40. Трансферазалар S-Аденозил-метионин
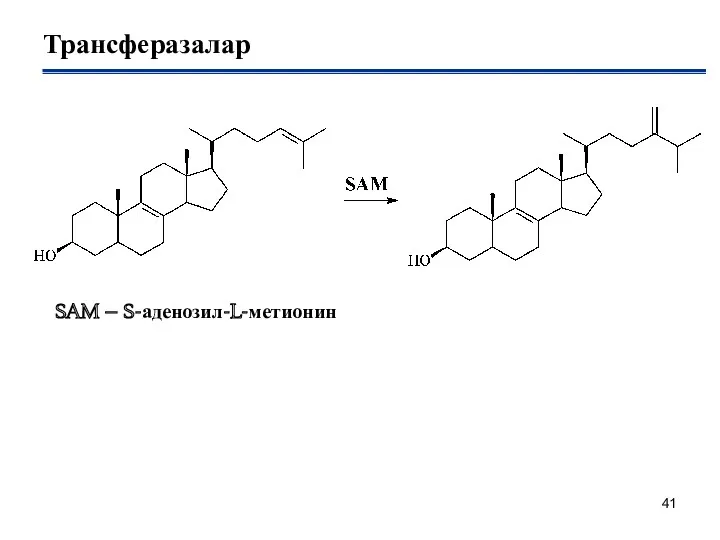
- 41. Трансферазалар SAM – S-аденозил-L-метионин
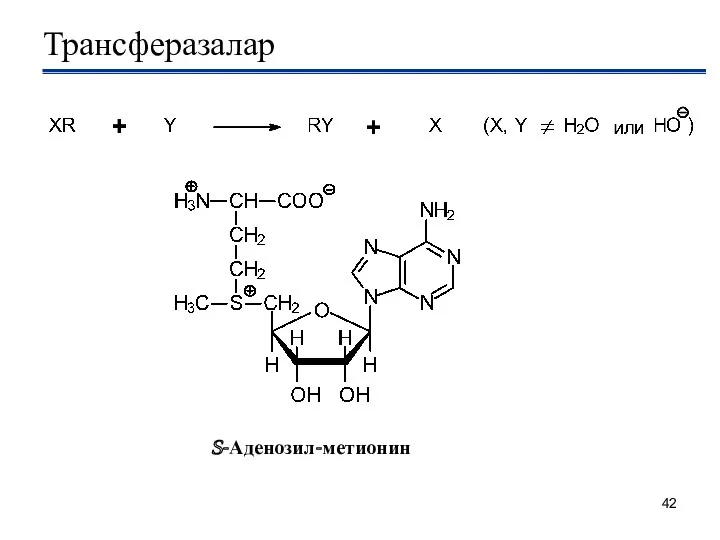
- 42. Трансферазалар S-Аденозил-метионин
- 43. Гидролазалар Е.С.3.1 қолданыстағы күрделi эфир байланыстарына гидролаза Е.С.3.1.1.1 карбоксилэстеразалар RCOOR1 + H2O = RCOOH + R1OH
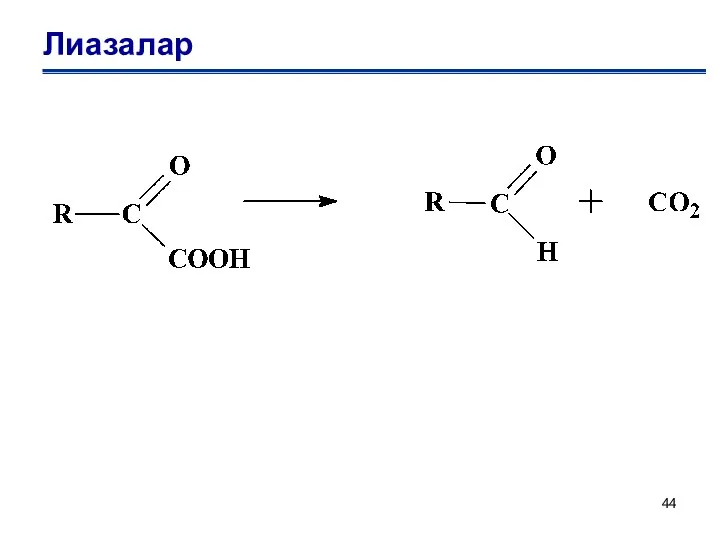
- 44. Лиазалар
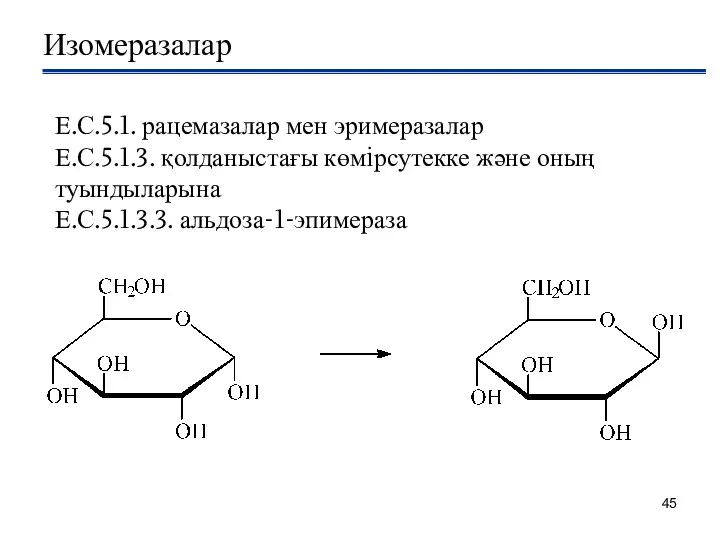
- 45. Изомеразалар Е.С.5.1. рацемазалар мен эримеразалар Е.С.5.1.3. қолданыстағы көмiрсутекке және оның туындыларына Е.С.5.1.3.3. альдоза-1-эпимераза
- 46. Ферменттердің жалпы қасиеттері. Ферменттің субстратқа сәйкестігі құлыптың кілтке сәйкестігі тәрізді» (Э.Фишер 1894 ж.). Термолобилділігі, температуралық оптимум
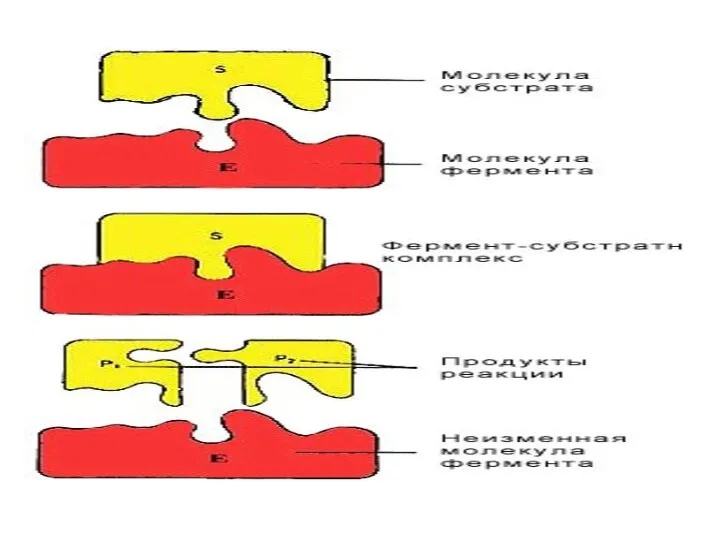
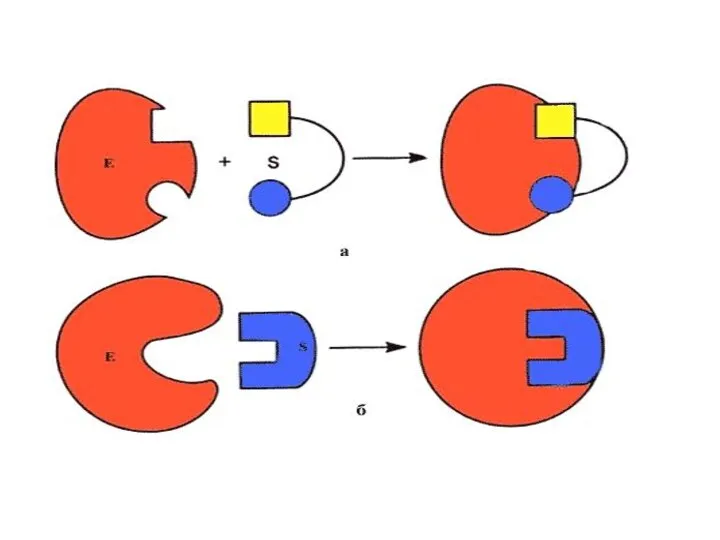
- 47. Ферменттер әсерінің теориясы Фермент өзінің субстратын айырып таниды. Э.Фишердің айтуы бойынша “құлыпқа дәл келетін кілт сияқты”,
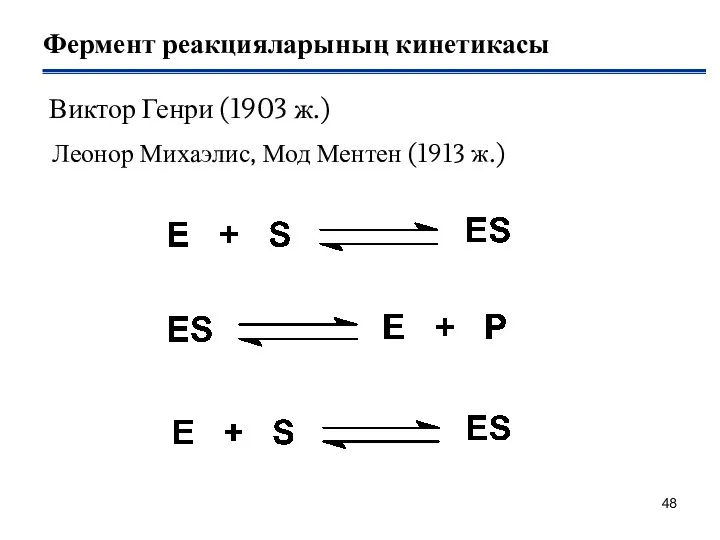
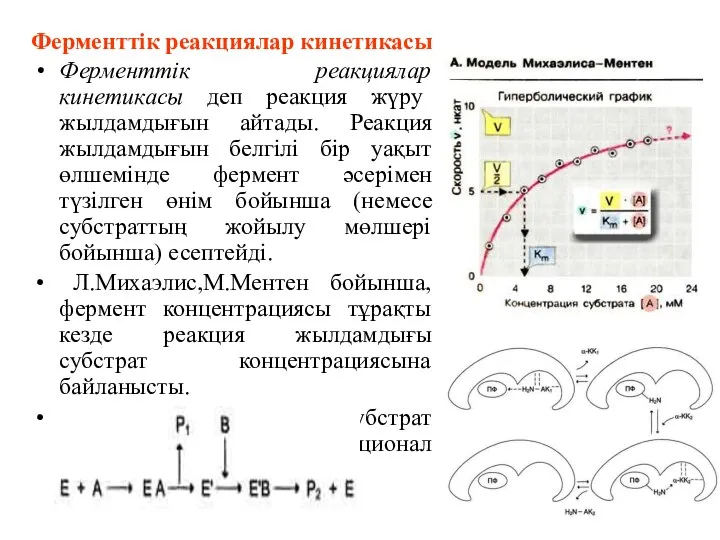
- 48. Фермент реакцияларының кинетикасы Виктор Генри (1903 ж.) Леонор Михаэлис, Мод Ментен (1913 ж.)
- 50. Абсолюттік талғампаздық белгілі бір айқын құрылымды субстратқа әсер ететін ферменттерге тән. Мысалы, аргиназа аргининді орнитин және
- 51. Ферменттердің құрылысы және әсер ету механизмі. Фермент Белоктық бөлігі Қосалқы топ Симплекс Ферон (тасымалдаушы) Агон (белсенді
- 52. Ферменттердің қасиеттері Ферменттік реакциялар жылдамдығына температураның әсері; Ортаның рН көрсеткішінің әсері; Фермент әсерінің ерекшелігі; Фермент активаторлары
- 53. Ферменттердің өздеріне тән ерекшелігі Ферменттің реакцияны тездету қасиеті: фермент тек өзінің ғана субстратын байланыстырады және сол
- 55. Фермент активтілігіне температура әсері 30-400С жағдайда тірі организмде ферменттер әсіресе белссенді. Ферменттер өзі ақуыз болғандықтан, өте
- 56. Ферменттік реакциялар кинетикасы Ферменттік реакциялар кинетикасы деп реакция жүру жылдамдығын айтады. Реакция жылдамдығын белгілі бір уақыт
- 57. Фермент реакцияларының кинетикасы Михаэлиса-Ментен моделі
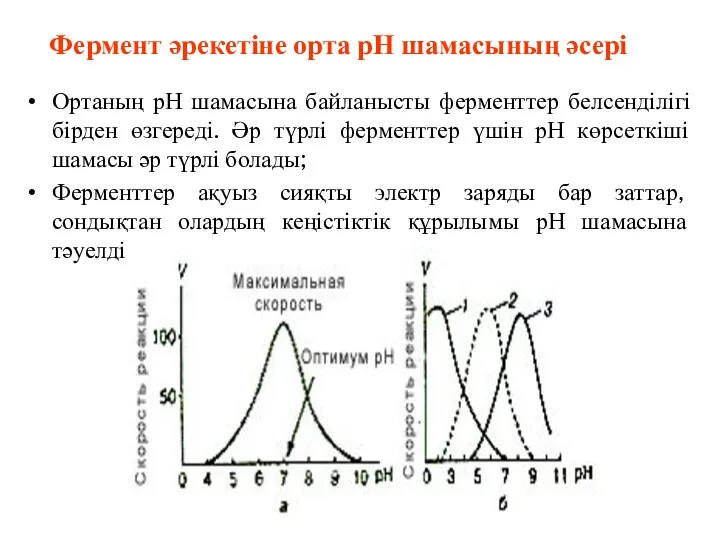
- 58. Фермент әрекетіне орта рН шамасының әсері Ортаның рН шамасына байланысты ферменттер белсенділігі бірден өзгереді. Әр түрлі
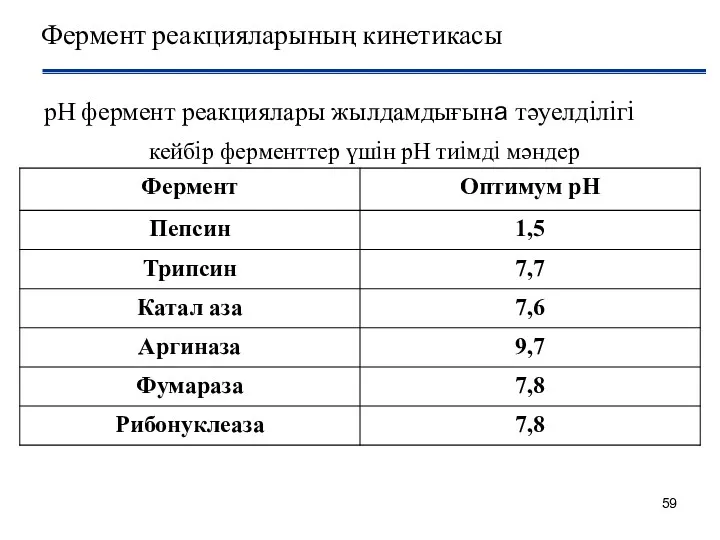
- 59. Фермент реакцияларының кинетикасы рН фермент реакциялары жылдамдығына тәуелдiлiгi кейбiр ферменттер үшiн рН тиiмдi мәндер
- 60. Бәсекелес емес қайтымды тежеу E + S ↔ ES → E + P; E + I
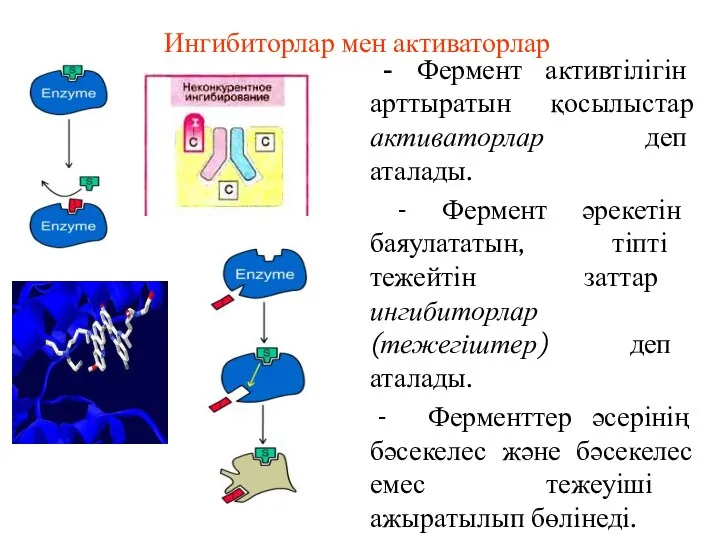
- 61. Ингибиторлар мен активаторлар - Фермент активтілігін арттыратын қосылыстар активаторлар деп аталады. - Фермент әрекетін баяулататын, тіпті
- 62. Ферменттерді бөлу және тазалау Ферменттің нативті қасиеті сақталатын тәсіл- глицеринмен экстракциялау; Фермент құрамдас заттарды -100С жоғары
- 63. Ферменттердің тазалық дәрежесі- оның меншікті белсенділігімен бағланады, онда ферменттің белсенділігін 1 мг ақуызға шаққандағы есеппен алады.
- 64. Проферменттер мен изоферменттер Профермент (лат. pro – алдыңғы фермент) – ферменттердің белсенді емес түрі. Безді эпителийде
- 65. Изоферменттер (грек. isos – тең, бірдей) – бір фермент әр түрі, олардың полипептидтік құрылысында бір-бірінен өзгешелігі
- 66. Мультиферменттік жүйе Бұл әр түрлі ферменттерден құралған комплекс. Әрбір жеке мультиферменттік жүйе 2 ферменттен 20 ферментке
- 67. Ферменттердің практикалық маңызы Бактериалдық ашу Физиологиялық реттегіш Катализ Жасушалық метаболизм Макромолекулалар Генетикалық аппарат Тамақтану Мембраналар ультрақұрылысы
- 68. Иммобилденген ферменттер Иммобилденген (лат.immobilis - қозғалмайтын) ферменттер – қатты таянышқа (полимерге, целлюлозаға,әйнекке) бекітілген ферменттер. Ондай ферменттер
- 69. Тұңғыш рет 1910 жылы А.Гэррод зат алмасу ферменттермен және тұқым қуалайтын аурулардың арасындағы байланысты анықтады. Медицинада
- 70. Микроорганиздермен ашу тамақ, алкоголь, түрлі сусындар өндірісінде немесе консервілеуде қолданылады. Барлық ашу үдерісі пируваттың түзілуімен анаэробты
- 75. Скачать презентацию






































 Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования The halogens
The halogens Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Крахмал. Строение вещества
Крахмал. Строение вещества Alkynes
Alkynes Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Природные источники углеводородов
Природные источники углеводородов Топливо. Виды топлива
Топливо. Виды топлива p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Ионные уравнения реакции
Ионные уравнения реакции Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас
Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук Гидролиз. Классификация солей
Гидролиз. Классификация солей Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері Heavy metals
Heavy metals Lipid metabolism
Lipid metabolism Основные разделы химии
Основные разделы химии Кислоты
Кислоты Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Tungsten. (Вольфрам)
Tungsten. (Вольфрам)