Содержание
- 2. Домашняя работа Mr(H2SiO3)= ? Mr(HMnO4)= ?
- 3. Количество вещества Из курса физики мы знаем о таких физических величинах, как масса, объём и плотность.
- 4. Количество вещества – это физическая величина характеризующая количество однотипных структурных единиц (молекул, атомов), содержащихся в веществе.
- 5. И салфетки мы тоже поштучно не покупаем, но купив пачку салфеток, то есть порцию, мы точно
- 6. Количество вещества – это порция вещества с определённым числом структурных частиц. Количество вещества принято обозначать буквой
- 7. Вспомним другие величины для измерения веществ
- 8. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода, а
- 9. Количество вещества можно определить как отношение числа структурных частиц к числу частиц в одном моле вещества.
- 10. Например, количество вещества, которое соответствует 3·1023 атомов железа можно легко рассчитать по этой формуле. n=N/Na n(Fe)
- 11. Закон Авогадро Своё имя эта постоянная получила в честь Амедео Авогадро, который в 1811 году сделал
- 12. Из закона Авогадро следует, что при одинаковых условиях массы газов, содержащие одинаковое число структурных частиц, будут
- 13. Молярный объём обозначается Vm, показывает объём газа количеством 1 моль. При нормальных условиях является постоянной величиной.
- 14. Например, количество вещества, которое соответствует 44,8 л кислорода можно легко рассчитать по этой формуле. n=V/Vm n(O2)
- 15. Молярная масса Массу вещества количеством 1 моль называют молярной массой, обозначают буквой M. Молярная масса численно
- 16. Зная массу вещества, легко определить количество вещества. n=m/M
- 17. Например, найдём количество вещества 5,6 г железа. n=m/M n(Fe) = m/M = 5,6/56 = 0,1моль
- 18. Задача. Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число
- 19. !Задание Конспект лекции с основными понятиями – количество вещества, 3 формулы для нахождения количества вещества, молярный
- 21. Скачать презентацию


















 ВОДОРОД
ВОДОРОД Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Чистые вещества и смеси
Чистые вещества и смеси Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Фенол и его свойства
Фенол и его свойства Химические свойства воды
Химические свойства воды Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Атом - сложная частица
Атом - сложная частица Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения Основные понятия и законы химии
Основные понятия и законы химии Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Электролиз
Электролиз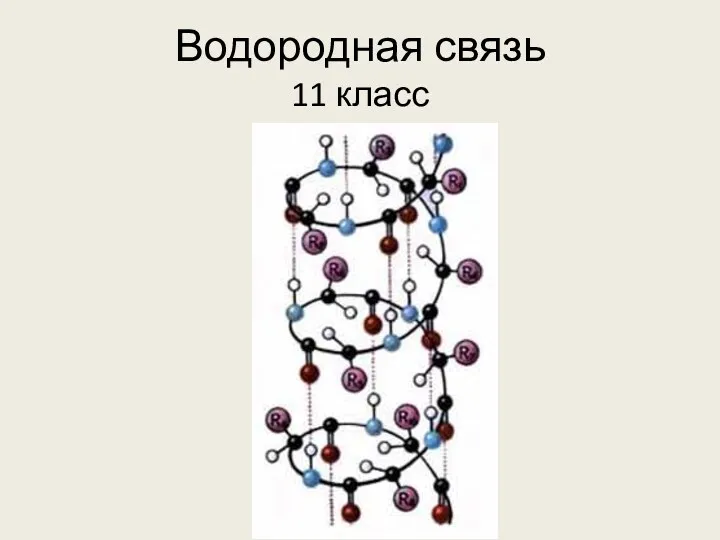 Водородная связь
Водородная связь Фторопласт-4 (тефлон, політетрафлуоретен)
Фторопласт-4 (тефлон, політетрафлуоретен) Застосування неметалів
Застосування неметалів Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева
Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Сероводород
Сероводород Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Поширення та колообіг оксигену в природі
Поширення та колообіг оксигену в природі Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Введение в геохимию
Введение в геохимию