Содержание
- 2. 2.Как называется ряд, составленный из следующих формул веществ? C → CO→ CO2→H2CO3→CaCO3 У доски записать уравнения
- 3. «Я… понимаю, что это обыкновенные камни, причудливо обработанные ветром и газированной водой. - Почему газированной? -
- 4. Хотя я - соль, но под водой Вас удивлю своей средой. Посуду мыть, стирать бельё Могу
- 5. Угольная кислота и её соли Цель: формирование представлений о строении, свойствах и применении угольной кислоты и
- 6. Характеристика H2СO3 По основности: двухосновная 2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде: растворимая
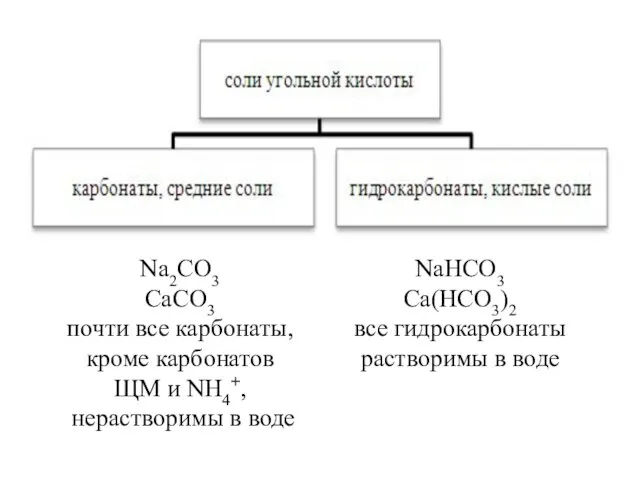
- 8. Взаимопревращения карбонатов и гидрокарбонатов = Ca(HCO3)2 -
- 9. Просачиваясь в пещеру сверху, вода понемногу капает, а растворённые материалы свисают с потолка. Так образуются сталактиты.
- 10. Взаимопревращения карбонатов и гидрокарбонатов Стекая со стен пещеры и попадая на дно, раствор гидрокарбоната кальция начинает
- 11. Понятие о жёсткости воды временная жёсткость постоянная жёсткость
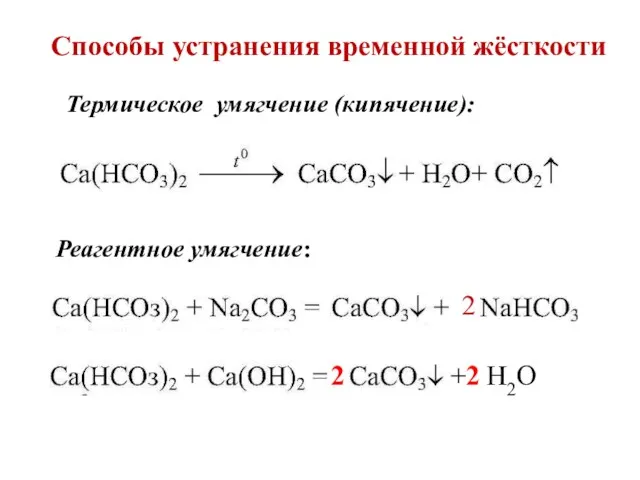
- 12. Способы устранения временной жёсткости Реагентное умягчение: 2 Термическое умягчение (кипячение): 2 Н2О 2
- 13. Способы устранения постоянной жёсткости Реагентное умягчение (добавление соды): CaCl2 + Na2CO3 = CaCO3 ↓ + NaCl
- 14. Качественная реакция на карбонат - ион Na2CO3 + HCl = 2 2
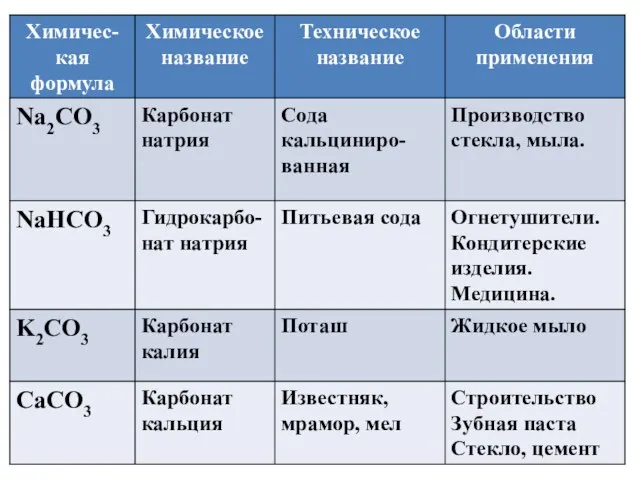
- 16. Карбонаты в природе
- 17. Карбонаты в природе магнезит MgCO3 малахит (CuOH)2CO3 Сидерит FeCO3
- 18. Гидрокарбонаты в природе (лечебно-столовая питьевая вода «Нижне - Ивкинская №2К»)
- 19. Верите ли вы, что… 1.Угольная кислота – сильный электролит. 2.Угольная кислота образует кислые и средние соли.
- 20. § 29, №7(а) с.138
- 21. Объясните исторический факт с химической точки зрения В романе Г.Г. Хаггарда «Клеопатра» написано: «… она вынула
- 22. Что же произошло с жемчужиной, и почему Клеопатра смогла выпить «крепкий уксус»?
- 23. Что такое жемчуг? Что объединяет жемчуг с мрамором?
- 24. Жемчуг образуется в раковине моллюска, который реагирует на раздражитель, например песчинку, и выделяет вещество– перламутр, который
- 25. Задание. Запишите уравнение реакции растворения жемчужины в уксусной кислоте. CaCO3 + CH3COOH = Ca(CH3COO)2+ CO2↑+H2O 2
- 27. Скачать презентацию





















 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы