Содержание
- 2. «ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ» Цели урока: ● изучить классификацию химических реакций по тепловому эффекту на основе
- 3. О КАКИХ РЕАКЦИЯХ ИДЁТ РЕЧЬ В ДАННОМ СТИХОТВОРЕНИИ? КАКОВЫ ПРИЗНАКИ ЭТИХ РЕАКЦИЙ? Огонь свечи, огонь костра…
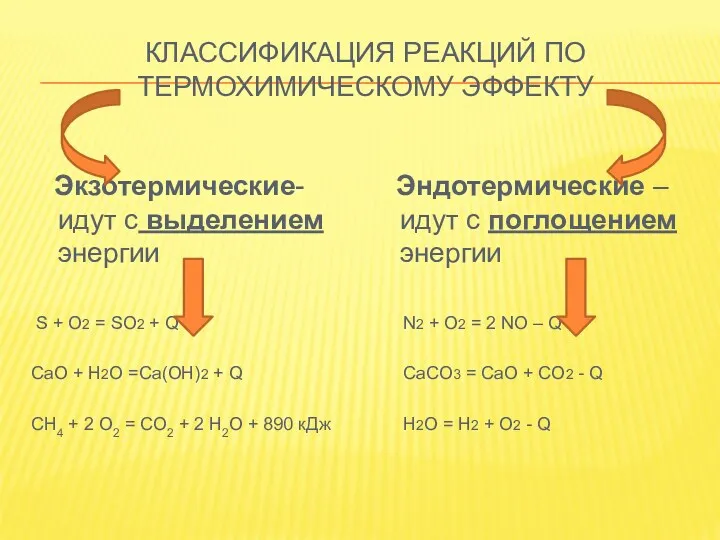
- 4. КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО ТЕРМОХИМИЧЕСКОМУ ЭФФЕКТУ Экзотермические- идут с выделением энергии S + O2 = SO2 +
- 5. ЛАБОРАТОРНЫЙ ЭКСПЕРИМЕНТ Опыт 1. Взаимодействие Mg с кислотой. 1) В пробирку с порошком магния (Mg) прилить
- 6. ЛАБОРАТОРНЫЙЭКСПЕРИМЕНТ Растворение азотного удобрения в воде 1) В пробирку с белым кристаллическим веществом прилейте имеющуюся воду,
- 7. ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ Q – это количество теплоты, которое выделилось или поглотилось в ходе химической
- 8. ХИМИЧЕСКИЕ УРАВНЕНИЯ, В КОТОРЫХ УКАЗЫВАЮТСЯ ТЕПЛОВОЙ ЭФФЕКТ, НАЗЫВАЮТСЯ ТЕРМОХИМИЧЕСКИМИ В ТЕРМОХИМИЧЕСКИХ УРАВНЕНИЯ УКАЗЫВАЮТ АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА,
- 9. Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком. Это означает, что
- 10. ВСЕ РЕАКЦИИ СОПРОВОЖДАЮТСЯ ТЕПЛОВЫМ ЭФФЕКТОМ
- 11. ИЗУЧЕНИЕМ ТЕПЛОВОГО ЭФФЕКТА ХИМИЧЕСКИХ РЕАКЦИЙ ЗАНИМАЛСЯ НАШ СООТЕЧЕСТВЕННИК ГЕРМАН ИВАНОВИЧ ГЕСС Учёный сформулировал основной закон термохимии
- 12. ЗНАНИЯ О ТЕПЛОВЫХ ЭФФЕКТАХ ХИМИЧЕСКИХ РЕАКЦИЙ ИМЕЮТ БОЛЬШОЕ ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ. Самая мощная в мире российская ракета
- 13. В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут
- 14. ТЕРМОХИМИЧЕСКИЕ РАСЧЁТЫ При определении выделившейся или поглощенной энергии в результате химической реакции пользуются правилом: количество теплоты
- 15. РАСЧЁТЫ ПО ТЕРМОХИМИЧЕСКИМ УРАВНЕНИЯМ РЕАКЦИЙ Задача 2. Определите тепловой эффект реакции 2SO2(г) + O2(г) = 2SO3(г)
- 16. РЕШИТЕ САМОСТОЯТЕЛЬНО: 1). Согласно термохимическому уравнению реакции СН4(г)+2О2(г)=СО2(г)+2Н2О(г)+802кДж количество теплоты, выделившейся при сжигании24г метана, равно: а)
- 17. ЧТО ТВЁРДО ВЫУЧИШЬ, ДОЛГО ПОМНИТСЯ. ―С реакциями какого типа мы познакомились на уроке? ― Чем экзотермические
- 19. Скачать презентацию















 Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Ізомери у природі
Ізомери у природі Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Курс хімії за 11 клас
Курс хімії за 11 клас Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Теория строения органических веществ А.М. Бутлеров
Теория строения органических веществ А.М. Бутлеров В мире кристаллов
В мире кристаллов Гигиена питания школьников
Гигиена питания школьников Интеллектуальная физико-химическая игра
Интеллектуальная физико-химическая игра Фазовые диаграммы и статистическая термодинамика бинарных m-h систем
Фазовые диаграммы и статистическая термодинамика бинарных m-h систем Реакции ионного обмена
Реакции ионного обмена Азотная кислота и ее свойства
Азотная кислота и ее свойства Углеводы. Моносахариды
Углеводы. Моносахариды Производные 8-замещенных хинолина
Производные 8-замещенных хинолина Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Характеристика металу Ферум
Характеристика металу Ферум Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Химический элемент кремний
Химический элемент кремний Тотығу түрлері.Липидтердің пероксидті тотығуы (ЛПТ), антиоксиданттар
Тотығу түрлері.Липидтердің пероксидті тотығуы (ЛПТ), антиоксиданттар Полимеры и их использование
Полимеры и их использование Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Органические и неорганические вещества. Нуклеиновые кислоты
Органические и неорганические вещества. Нуклеиновые кислоты Жесткость воды
Жесткость воды Строение атомов химических элементов и природа химической связи
Строение атомов химических элементов и природа химической связи