Слайд 2

Ацетати CH3COO-
1. Утворення естерів:
2. Реакція з ферум (III) хлоридом -
з’являється червоно-буре забарвлення, яке зникає від додавання розведених мінеральних кислот:
6CH3COO- + 3Fe3+ + 2H2O → [Fe3(CH3COO)6(OH)2]+ + 2H+
Слайд 3
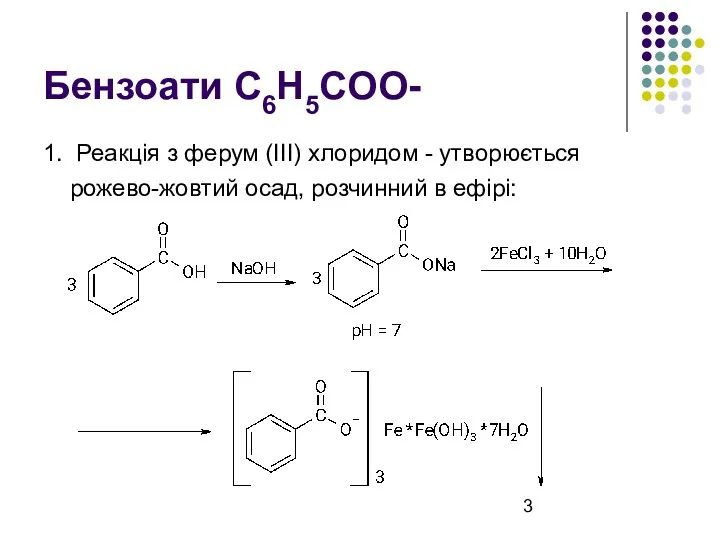
Бензоати C6H5COO-
1. Реакція з ферум (ІІІ) хлоридом - утворюється рожево-жовтий
осад, розчинний в ефірі:
Слайд 4
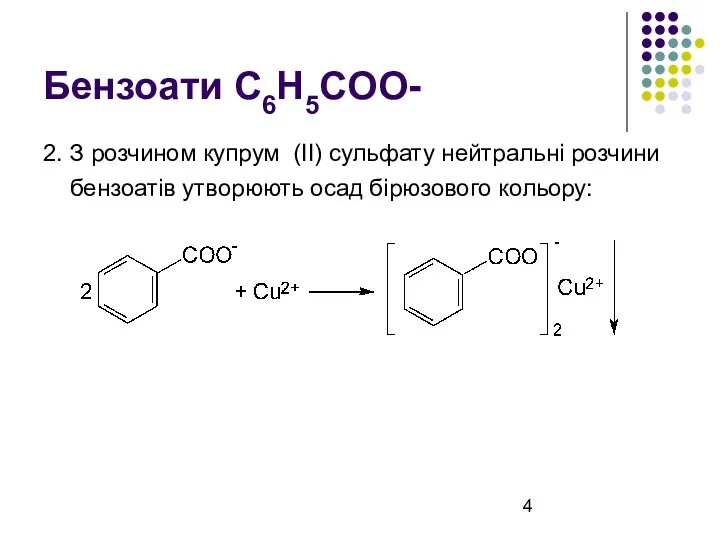
Бензоати C6H5COO-
2. З розчином купрум (ІІ) сульфату нейтральні розчини бензоатів
утворюють осад бірюзового кольору:
Слайд 5
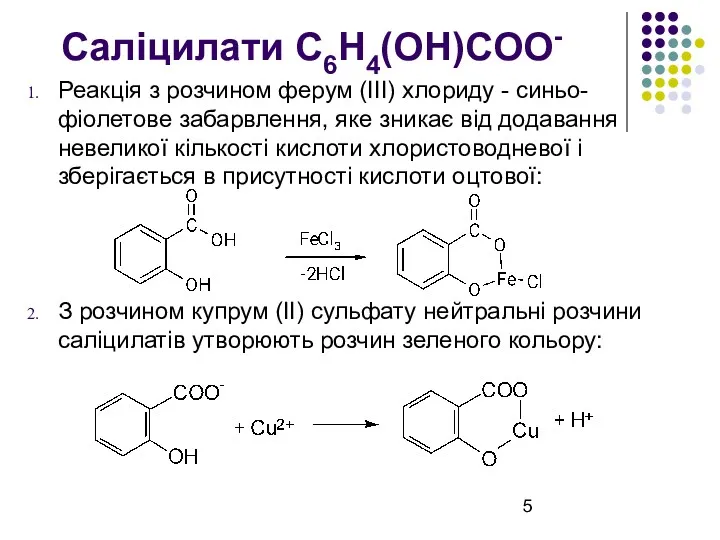
Саліцилати C6H4(OH)COO-
Реакція з розчином ферум (III) хлориду - синьо-фіолетове забарвлення, яке
зникає від додавання невеликої кількості кислоти хлористоводневої і зберігається в присутності кислоти оцтової:
З розчином купрум (ІІ) сульфату нейтральні розчини саліцилатів утворюють розчин зеленого кольору:
Слайд 6

Тартрати (HOCHCOO-)2
Винна кислота з солями калію утворює білий кристалічний осад
кислої солі. Реакцію проводять при охолодженні:
HO – CH - COOH HO ─ CH ─ COOK
K+ + │ → │ ↓ + H+
HO - CH - COOH HO ─ CH ─ COOH
білий
До реакційної суміші додають натрію ацетат:
СН3СООNa + H+ → CH3COOH + Na+
Утворенню осаду сприяє додавання 95% спирту і струшування пробірки. Осад нерозчинний в оцтовій кислоті, але розчинний в мінеральних кислотах і розчинах лугів.
Слайд 7
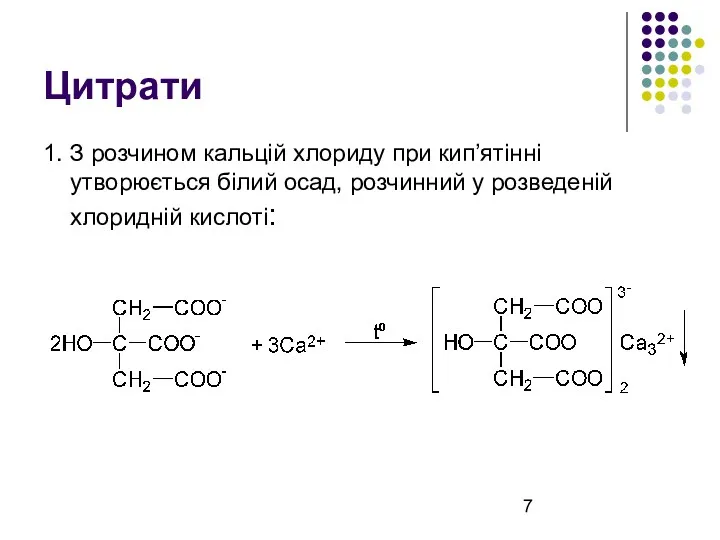
Цитрати
1. З розчином кальцій хлориду при кип’ятінні утворюється білий осад,
розчинний у розведеній хлоридній кислоті:
Слайд 8

Аналіз ненасичених вуглеводнів
Бромування ненасичених вуглеводнів
R-CH=CH-R1 + Br2 ? R -CHBr-CHBr-R1
2. Окиснення
ненасичених вуглеводнів (проба Байєра)
R-CH=CH-R1 + H2O + O ? R-CH(OH)–CH(OH)-R1
3R-CH=CH-R1 + 2 KMnO4 + 4 H2O ?
3 RCH(OH)-CH(OH)R1 + 2KOH +2 MnO2
Слайд 9

3. Положення подвійного зв'язку визначають озонуванням.
4. Дієнові вуглеводні ідентифікують за
реакцією Дільса-Альдера – утворюються кристалічні продукти у реакції з малеїновим ангідридом.
5. Ацетилен і його похідні утворюють нерозчинні продукти з солями арґентуму, купруму (І), меркурію
Слайд 10

АНАЛІЗ ГАЛОГЕНОВМІСНИХ СПОЛУК
1. Найпростішою попередньою пробою на наявність галогену в
складі органічної речовини є проба Бельштейна.
2. Реакція з розчином арґентум нітрату
Щоб довести наявність галогену в молекулі органічної речовини, треба перевести його в іоногенний стан. Наприклад, для переведення галогену в іоногенний стан використовують реакцію лужного гідролізу при нагріванні з водним розчином натрію гідроксиду. Далі проводять реакції з арґентум нітратом.
Слайд 11

Виявлення спиртів
Реакція естерифікації. Продукти реакції ідентифікують за характерним запахом або температурою
плавлення.
2. Йодоформна проба
С2Н5ОН+ 4І2+6КОН ? СНІ3↓+5КІ+НСООК + 5Н2О
3. Реакції окиснення. Утворені при цьому альдегіди або кетони встановлюють за характерним запахом або відповідними якісними реакціями. Ця реакція застосовується, наприклад, для визначення домішки метилового спирту в етиловому.
Слайд 12
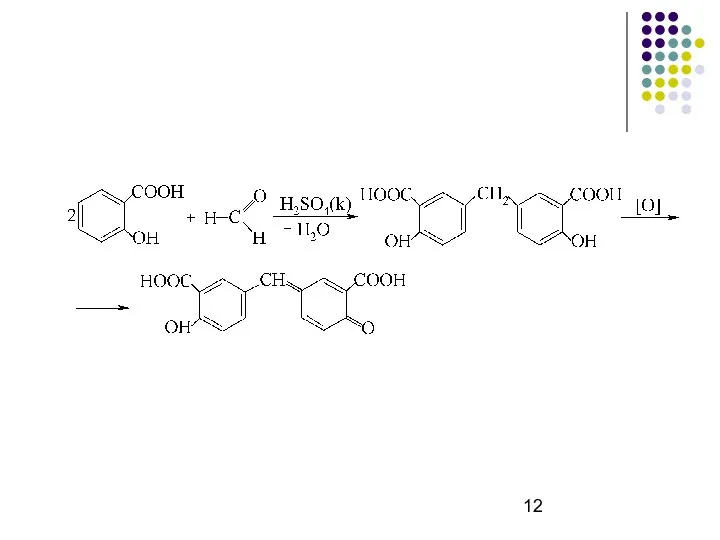
Слайд 13
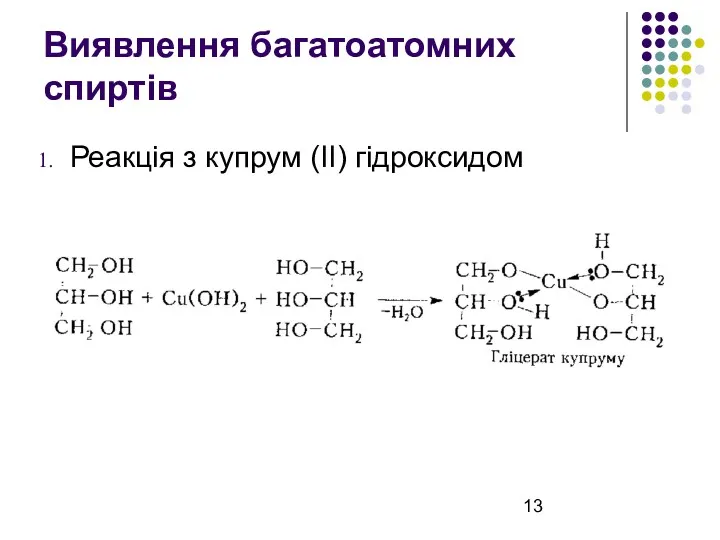
Виявлення багатоатомних спиртів
Реакція з купрум (ІІ) гідроксидом
Слайд 14
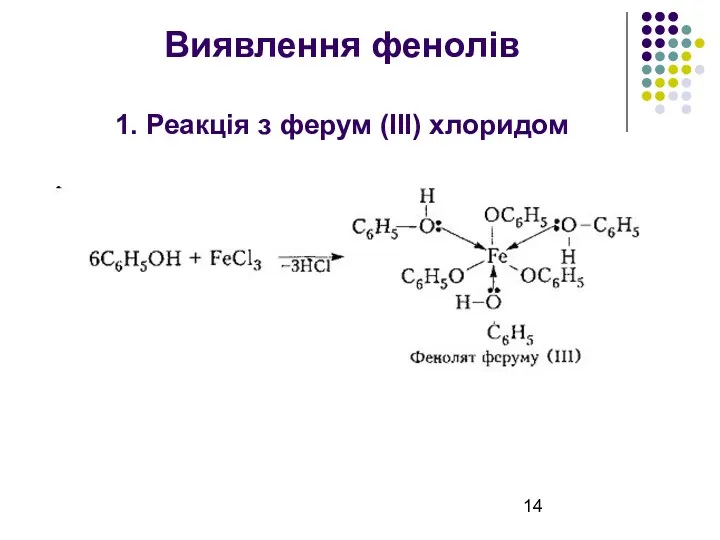
Виявлення фенолів
1. Реакція з ферум (ІІІ) хлоридом
Слайд 15
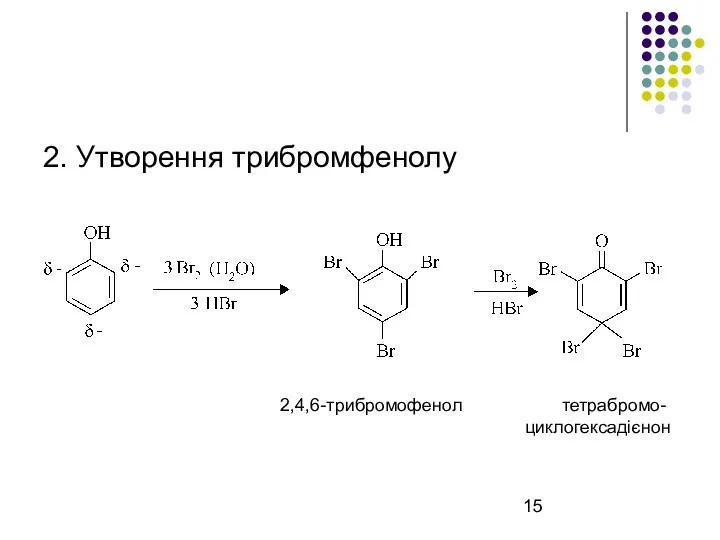
2. Утворення трибромфенолу
2,4,6-трибромофенол тетрабромо-
циклогексадієнон
Слайд 16

Виявлення альдегідів і кетонів
Реакція “срібного дзеркала”
AgNO3 + NH4OH ? AgOH +
NH4NO3
AgOH + 2NH4OH ? [Ag(NH3)2 ]OH + 2H2O
Н-CHO + 2[Ag(NH3)2 ]OH ? 2 Ag + 4 NH3 + H2O + НCOOH
2. Реакція альдегідів з купрум (ІІ) гідроксидом
CuSO4 + 2NaOH ? Cu(OH)2 + Na2SO4
RCHO + 2Cu(OH)2 ? Cu2O +2H2O+RCOOH
Слайд 17
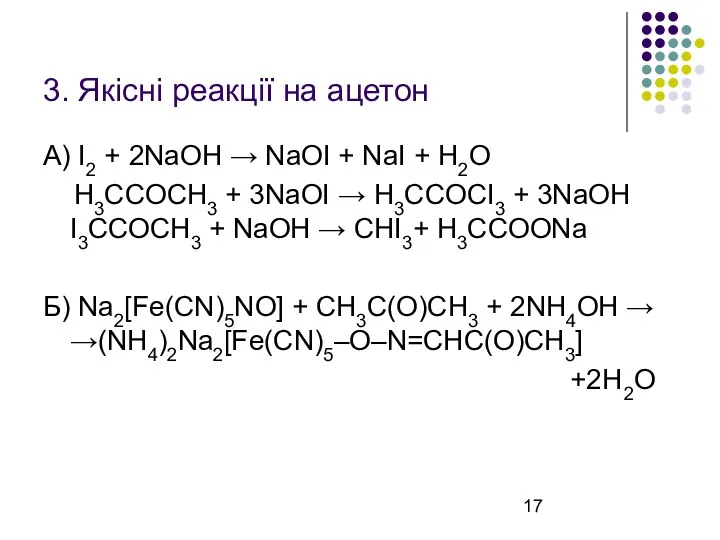
3. Якісні реакції на ацетон
А) I2 + 2NaOH → NaOI +
NaI + H2O
H3CCОCH3 + 3NaOI → H3CCОCI3 + 3NaOH I3CCОCH3 + NaOH → CHI3+ H3CCОONa
Б) Na2[Fe(CN)5NO] + СН3С(О)СН3 + 2NH4OH → →(NH4)2Na2[Fe(CN)5–O–N=CHC(O)CH3]
+2H2O
Слайд 18
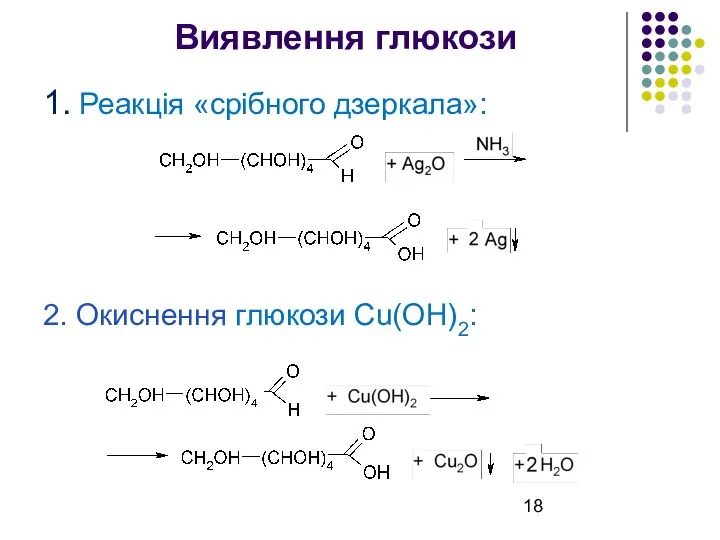
Виявлення глюкози
1. Реакція «срібного дзеркала»:
2. Окиснення глюкози Cu(OH)2:
Слайд 19
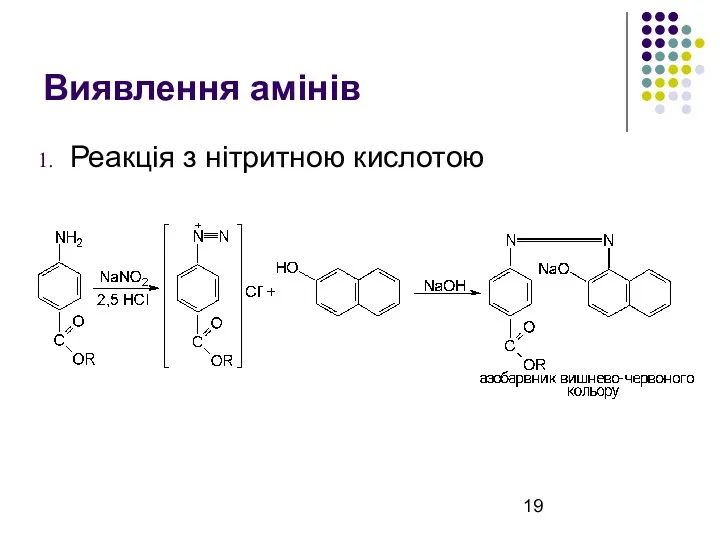
Виявлення амінів
Реакція з нітритною кислотою
Слайд 20
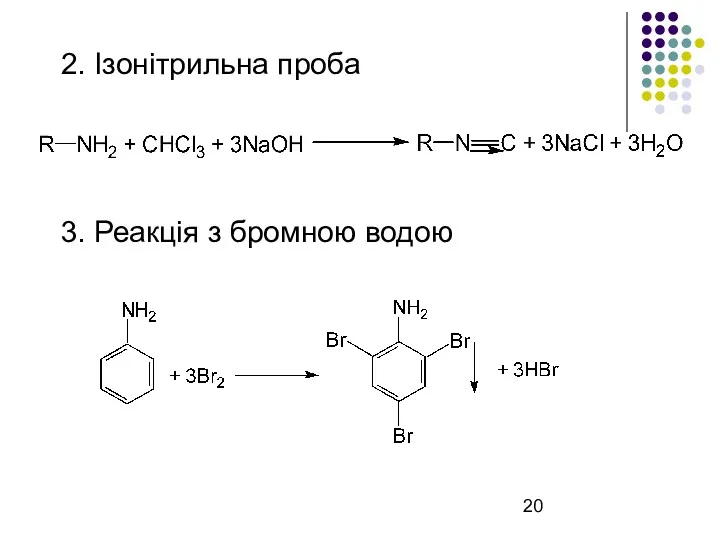
2. Ізонітрильна проба
3. Реакція з бромною водою
Слайд 21
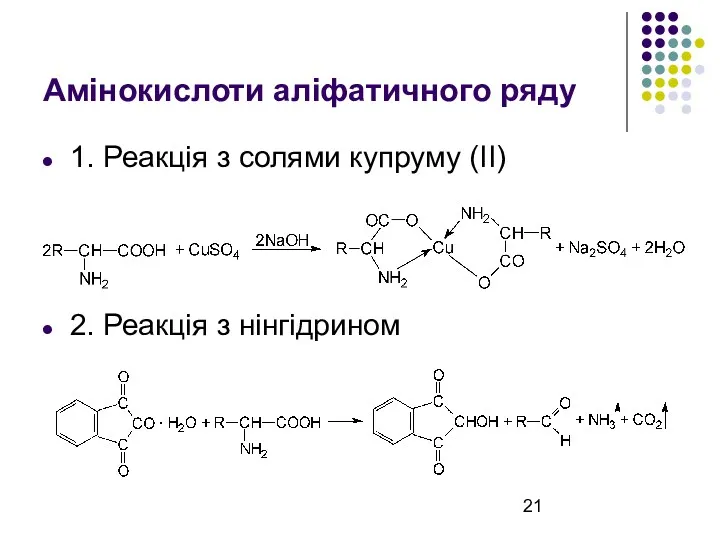
Амінокислоти аліфатичного ряду
1. Реакція з солями купруму (ІІ)
2. Реакція з нінгідрином
Слайд 22





















 Жиры и масла
Жиры и масла Особенности лантаноидов и актиноидов
Особенности лантаноидов и актиноидов Горение топлива
Горение топлива Текстуры метаморфических пород
Текстуры метаморфических пород Коррозия металлов
Коррозия металлов Пластмаси. Властивості пластмас. Склад пластичних мас. Види пластмаси
Пластмаси. Властивості пластмас. Склад пластичних мас. Види пластмаси Масова частка розчиненої речовини
Масова частка розчиненої речовини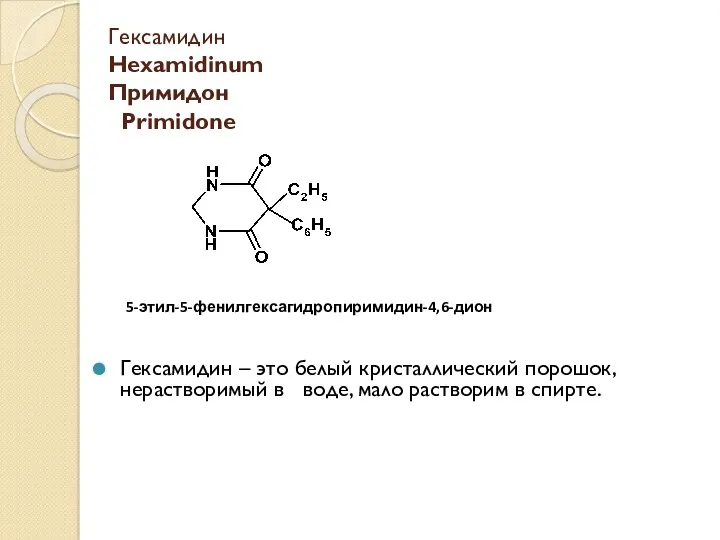 Гексамидин Hexamidinum. Примидон Primidone
Гексамидин Hexamidinum. Примидон Primidone Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени
Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени Аміни
Аміни Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Химический элемент хлор
Химический элемент хлор Химическая термодинамика. Фазовые равновесия
Химическая термодинамика. Фазовые равновесия Знаки вторичной переработки
Знаки вторичной переработки Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Органическая химия. Вещества
Органическая химия. Вещества Рідкі кристали та їх властивості
Рідкі кристали та їх властивості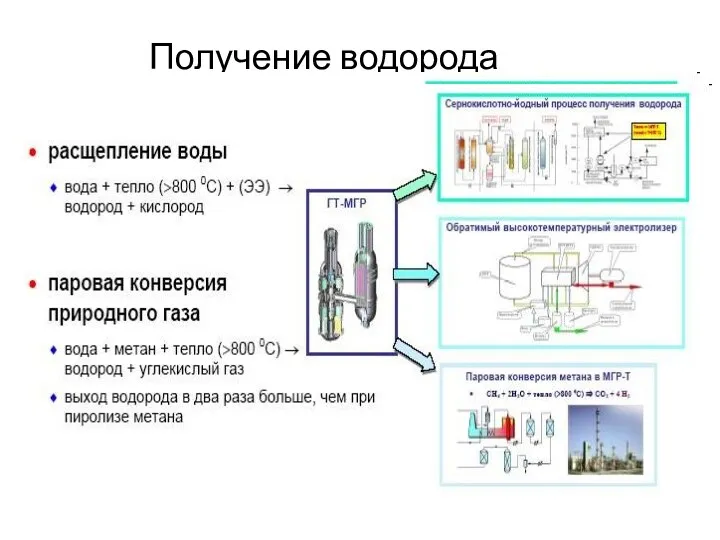 Получение водорода
Получение водорода Химические свойства алкенов
Химические свойства алкенов Номенклатура органических соединений
Номенклатура органических соединений Prezentatciya
Prezentatciya Характеристика азота и фосфора. Физические и химические свойства
Характеристика азота и фосфора. Физические и химические свойства Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Серная кислота H2SO4. 9 классы
Серная кислота H2SO4. 9 классы Хімічні властивості кислот
Хімічні властивості кислот