Содержание
- 2. Распространенность химических элементов
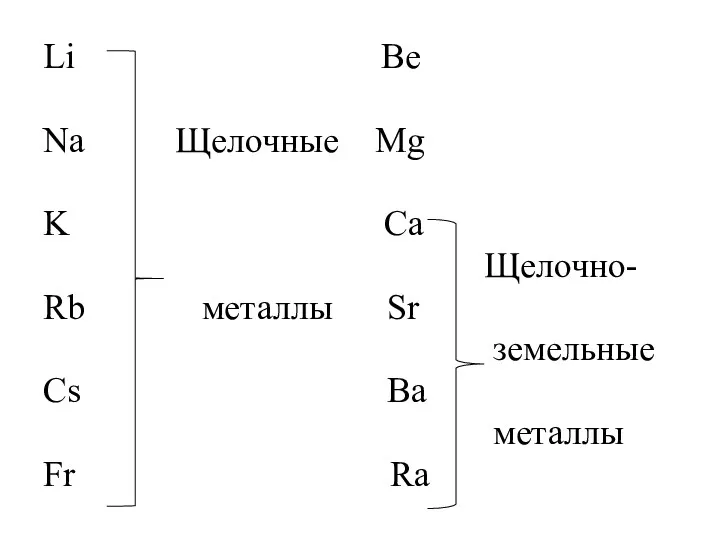
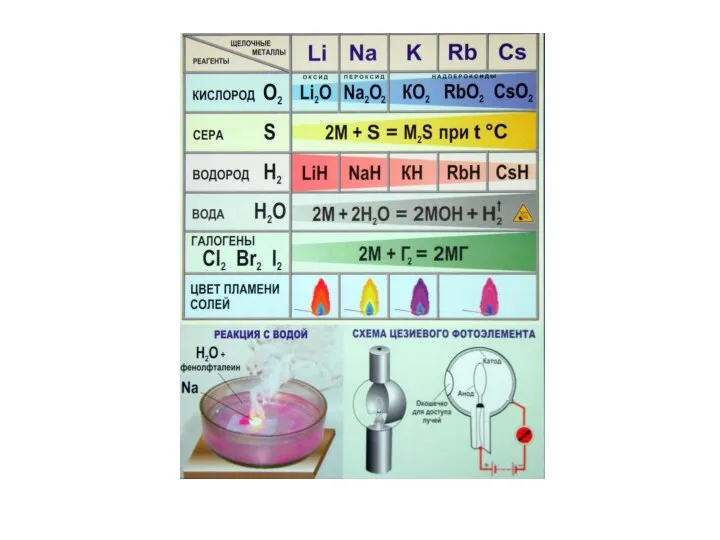
- 3. Li Be Na Щелочные Mg K Ca Щелочно- Rb металлы Sr земельные Cs Ba металлы Fr
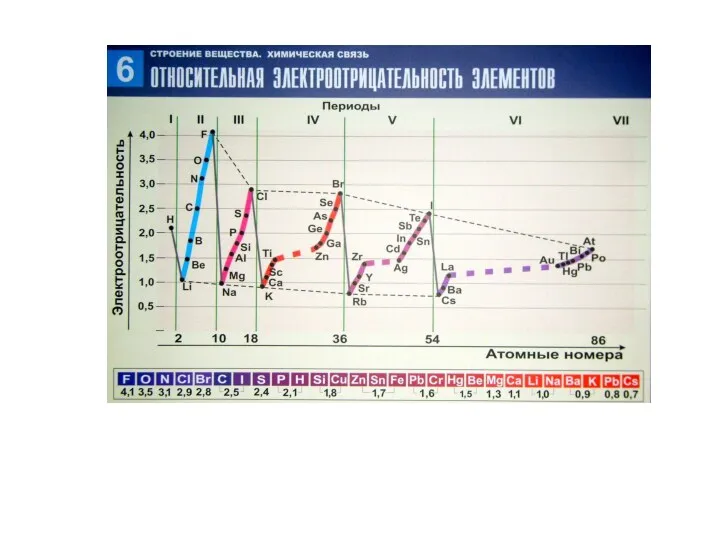
- 4. Общая характеристика s-элементов M0 ns1 M0 ns2 M+ ns0 M2+ ns0 Проявляемая степень окисления в соединениях:
- 7. Распространённость в природе Литий Сподумен Li2O · Al2O3 · 4SiO2 Амблигонит LiAlPO4F Лепидолит
- 8. Натрий Галит NaCl Мирабилит Na2SO4 · 10 H2O Тенардит Na2SO4 Чилийская селитра NaNO3
- 9. Калий Карналлит Сильвинит NaCl · KCl Лангбейнит K2Mg2(SO4)3 Рубидий, цезий Сопутствуют калию
- 10. Бериллий Берилл Be3Al2(Si6O18) Хризоберилл BeAl2O4
- 11. Магний Осадочные породы магнезит доломит карналлит MgCO3 CaCO3·MgCO3 KCl·MgCl2·6H2O Изверженные породы оливин асбест тальк (Mg,Fe)2[SiO4] Mg6[Si4O11](OH)·6H2O
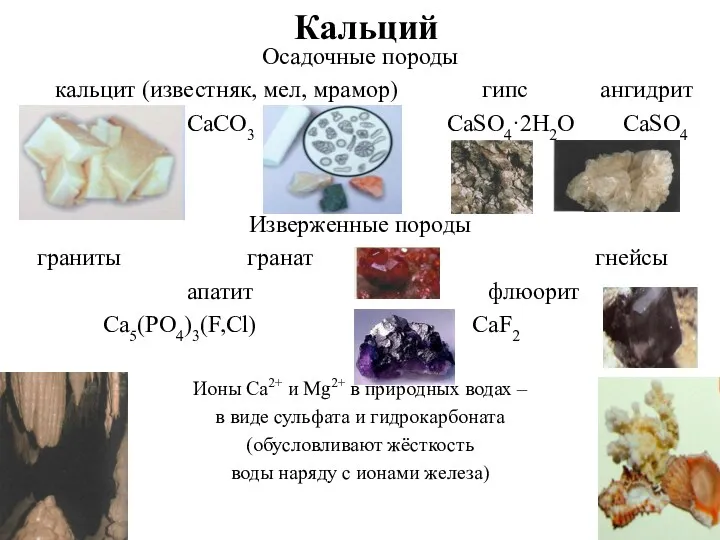
- 12. Кальций Осадочные породы кальцит (известняк, мел, мрамор) гипс ангидрит CaCO3 СаSО4·2Н2О СаSО4 Изверженные породы граниты гранат
- 13. Стронций, барий Изоморфны кальцию встречаются в виде сульфатов, карбонатов целестин стронцианит SrSО4 SrСО3 барит (тяжёлый шпат)
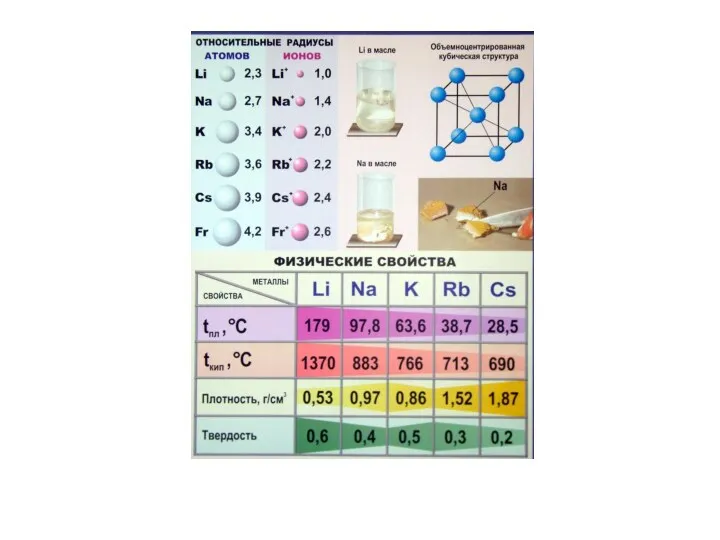
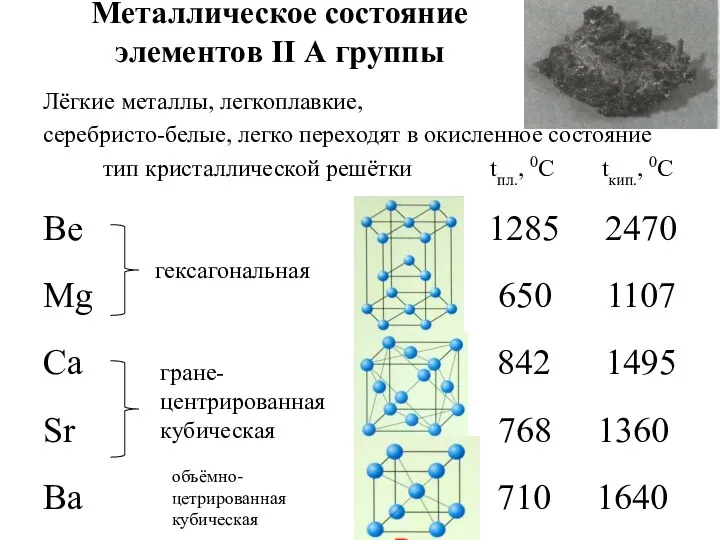
- 15. Металлическое состояние элементов II А группы Лёгкие металлы, легкоплавкие, серебристо-белые, легко переходят в окисленное состояние тип
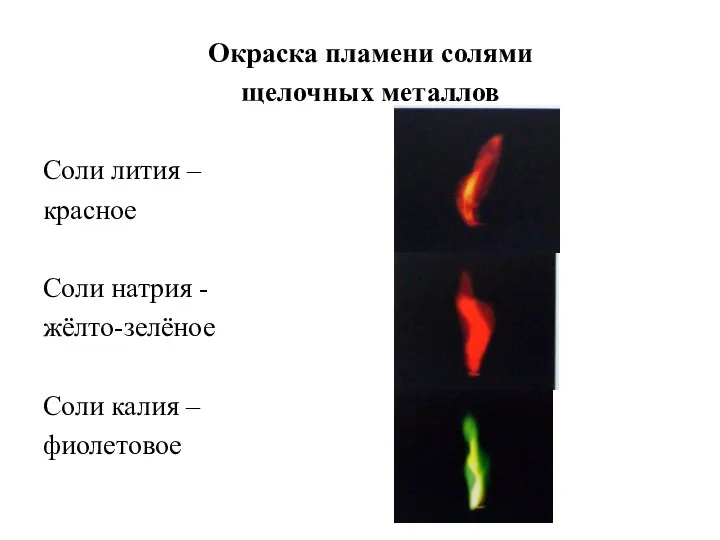
- 17. Окраска пламени солями щелочных металлов Соли лития – красное Соли натрия - жёлто-зелёное Соли калия –
- 18. Химические свойства 2Bе + О2 2BеО 2Mg + О2 2MgО 3Мg + N2 Мg3N2 2M +
- 19. 2M + Г2 → 2MГ2 3М + N2 → М3N2 М + S → МS 3М
- 20. Be + 2NaOH + 2H2O → Na2[Ве(ОН)4] + Н2 (с концентрированными - на холоде, с разбавленными
- 21. Получение Металлы нельзя получить из водных растворов Щелочные металлы получают: 1) электролизом расплавов, например LiCl: 2LiCl
- 22. Получение Бериллий получают: магнийтермически: ВеF2 + Мg Ве + МgF2 2) электролизом расплава ВеCl2 ВеCl2 Be
- 23. Магний получают: карботермически: MgO + C Mg(пар) + CO 2) электролизом расплава MgCl2
- 24. Кальций, стронций и барий получают: 1) электролизом расплавов хлоридов кальция и стронция или оксида бария 2)
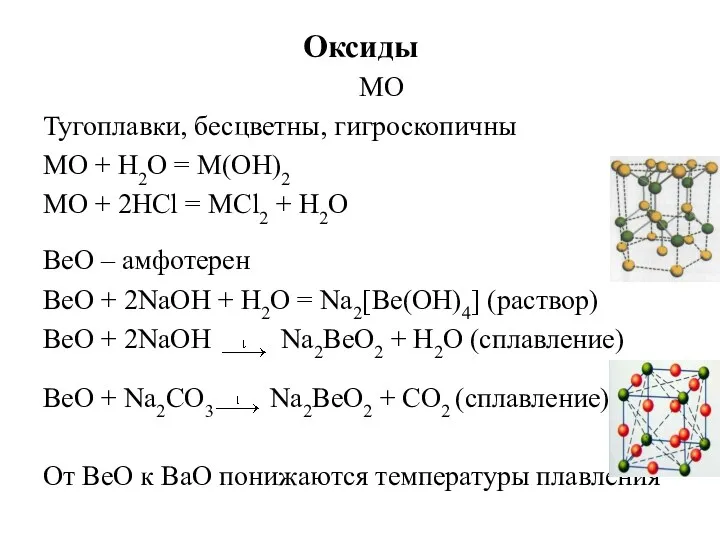
- 25. Оксиды MO Тугоплавки, бесцветны, гигроскопичны MO + Н2О = M(OH)2 MO + 2НСl = МСl2 +
- 26. Получение оксидов Be(OH)2 = BeO + Н2О ВеSО4 = ВеО + SО3 MСО3 = MО +
- 27. Гидроксиды M(OH)2 Ca(OH)2 – известковое молоко Ba(OH)2 – баритовая вода M(ОН)2 + 2НСl = MСl2 +
- 28. Получение гидроксидов ВеСl2 + 2КОН = Ве(ОН)2↓ + 2КСl MgСl2 + 2КОН = Mg(ОН)2↓ + 2КСl
- 29. Соли Карбонаты BeCO3·4H2O xBe(OH)2·yBeCO3 (NH4)2[Be(CO3)2] 3MgCO3·Mg(OH)2·3H2O Са, Sr, Ba: МСО3, М(НСО3)2 СаСО3↓ + CO2 + H2O
- 30. Сульфаты BeSO4·4H2O [Be(H2O)4]SO4 MgSO4·7H2O CaSO4·2H2O, CaSO4·0,5H2O, CaSO4 SrSO4, BaSO4 CaSO4·2H2O ← CaSO4·0,5H2O + 1,5H2O CaSO4·2H2O CaSO4
- 31. Галогениды BeCl2 BeCl2·4H2O [Be(H2O)4]Cl2 BeCl2·4H2O Be(OH)Cl + HCl + 3H2O Be(OH)Cl BeO + HCl MgCl2 +
- 32. Бинарные соединения MS MSe M3N2, M2N4, BaN2 M3P2, M3As2, M3Sb2 Be2C и BeC2, MgC2 и Mg2C3,
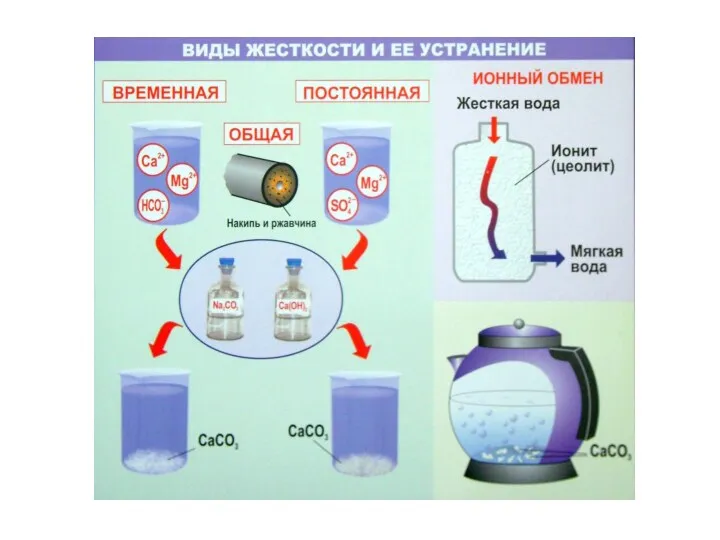
- 33. Жёсткость воды
- 35. Совокупность временной и постоянной жёсткости называется общей жёсткостью воды: ЖО = ЖК + ЖНК. Ж =
- 36. Устранение жёсткости воды Временная жёсткость устраняется кипячением: M(HCO3)2 MCO3 + CO2 + H2O Постоянная жёсткость устраняется
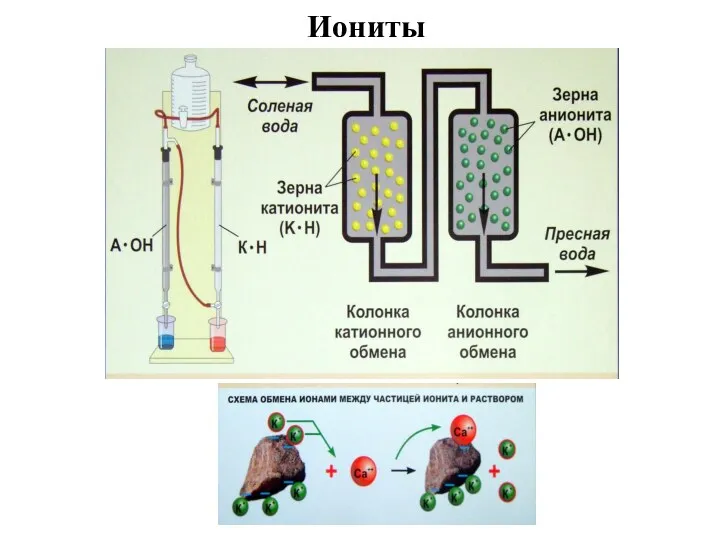
- 37. Иониты
- 39. Скачать презентацию










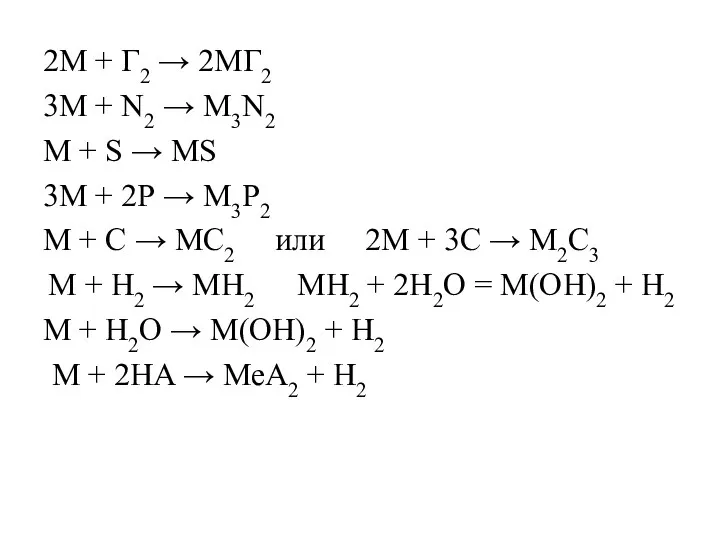
![Be + 2NaOH + 2H2O → Na2[Ве(ОН)4] + Н2 (с](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379025/slide-19.jpg)







![Соли Карбонаты BeCO3·4H2O xBe(OH)2·yBeCO3 (NH4)2[Be(CO3)2] 3MgCO3·Mg(OH)2·3H2O Са, Sr, Ba: МСО3,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379025/slide-28.jpg)
![Сульфаты BeSO4·4H2O [Be(H2O)4]SO4 MgSO4·7H2O CaSO4·2H2O, CaSO4·0,5H2O, CaSO4 SrSO4, BaSO4 CaSO4·2H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379025/slide-29.jpg)
![Галогениды BeCl2 BeCl2·4H2O [Be(H2O)4]Cl2 BeCl2·4H2O Be(OH)Cl + HCl + 3H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379025/slide-30.jpg)




 Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Методи отримання основних класів неорганічних сполук
Методи отримання основних класів неорганічних сполук Виды химических реакций
Виды химических реакций Растворы электролитов
Растворы электролитов Метали V групи побічної підгрупи (V, Nb, Ta)
Метали V групи побічної підгрупи (V, Nb, Ta) Хром и его соединения
Хром и его соединения Типы химических реакций
Типы химических реакций Химическая связь. 8 класс
Химическая связь. 8 класс Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю Жесткость воды
Жесткость воды Соли. 11 класс
Соли. 11 класс Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Платина. Свойства
Платина. Свойства Химические свойства основных оксидов
Химические свойства основных оксидов Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Спирты
Спирты Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс
Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс Серная кислота и ее соли
Серная кислота и ее соли Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Соединения железа
Соединения железа Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Счастливый случай. Право первого хода
Счастливый случай. Право первого хода ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895 Валентность химических элементов
Валентность химических элементов