Содержание
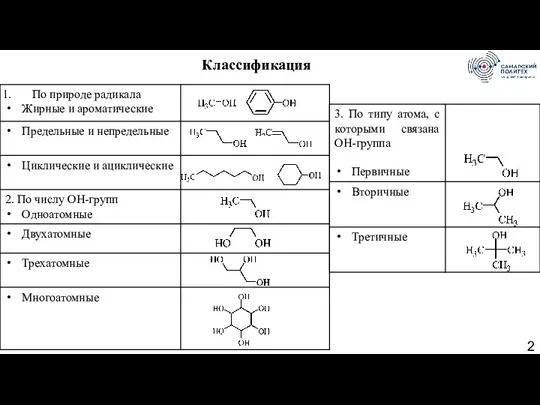
- 2. Классификация
- 3. Номенклатура Алифатические спирты (предельные, одноатомные) - это соединения, содержащие гидроксильную группу (-ОН), связанную с углеводородным радикалом.
- 4. Согласно карбинольной (рациональной) системе, метанол называют карбинолом, а остальные спирты рассматривают как производные карбинола. Например, этанол
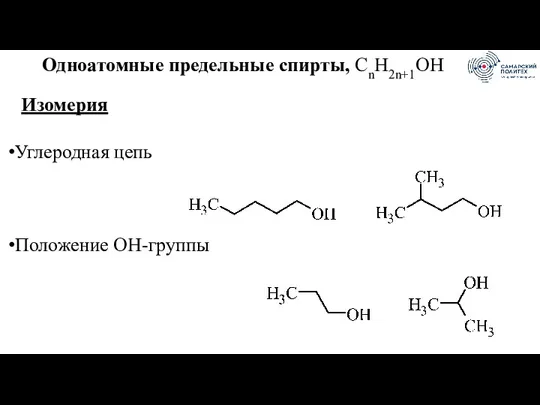
- 5. Одноатомные предельные спирты, CnH2n+1OH Изомерия Углеродная цепь Положение ОН-группы
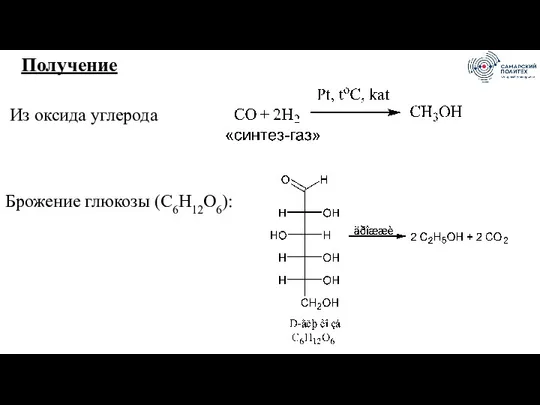
- 6. Получение Из оксида углерода Брожение глюкозы (C6H12O6):
- 7. Методы получения Гидролиз галогеналканов в водных растворах щелочей происходит по механизму нуклеофильного замещения 3
- 8. Методы получения Гидратация алкенов Присоединение воды протекает в присутствии кислотных катализаторов (H2SO4, H3PO4, оксид алюминия и
- 9. Методы получения из изобутилена - трет-бутиловый спирт: Присоединение протекает по правилу Марковникова, реакционная способность алкенов определяется
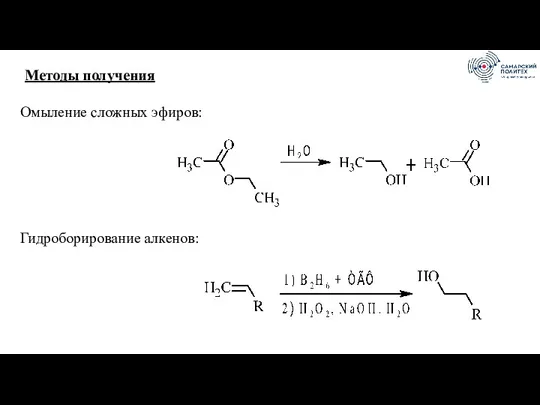
- 10. Методы получения Омыление сложных эфиров: Гидроборирование алкенов:
- 11. Реактивы Гриньяра или литийорганические соединения с карбонильными соединениями дают алкоголяты металлов, которые действием воды или разбавленной
- 12. Методы получения Восстановление карбонильных соединений. Альдегиды и кетоны легко восстанавливаются водородом в присутствии катализаторов (Ni, Pd,
- 13. Методы получения Дезаминирование первичных аминов
- 14. Промышленные методы получения спиртов 3 Окисление алканов (синтез спиртов С10-С20). Спирты нормального строения С10-С20 представляют интерес
- 15. 3 Синтез спиртов по методу Фишера-Тропша. При высоком давлении СО и Н2 образует смесь кислородсодержащих соединений
- 16. 3 Процесс оксосинтеза – получение из алкенов и синтез-газа (СО+Н2) альдегидов и их гидрирование до спиртов:
- 17. Физические свойства C1-C10 – жидкости, характеризуются специфическим запахом С4-С10 – неприятный запах, сивушные масла d С1-С3
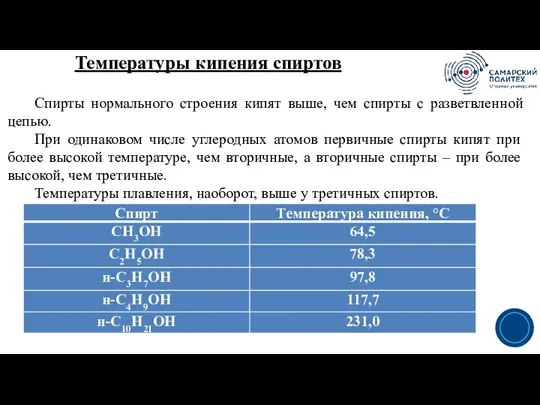
- 18. Температуры кипения спиртов 3 Спирты нормального строения кипят выше, чем спирты с разветвленной цепью. При одинаковом
- 19. Химические свойства спиртов 3 В молекуле спирта можно выделить три реакционных центра: 1. О-Н-связь: обладает выраженной
- 20. Кислотные и основные свойства спиртов Спирты способны проявлять себя и как кислоты, и как основания. Константа
- 21. 3 Наименьшую кислотность имеет трет-бутиловый спирт, так как соответствующий алкоксид-анион наименее устойчив из-за электронодонорного влияния метильных
- 22. 3 Нуклеофильное замещение гидроксильной группы на галоген К реакциям нуклеофильного замещения относятся замещение гидроксильной группы на
- 23. 3 Наиболее важные химические превращения спиртов связаны с заменой гидроксильной группы на галоген под действием галогенводородных
- 24. 3 При действии PCl3 и PCl5 на спирты также образуются соответствующие галогенпроизводные: Взаимодействие спиртов с тионилхлоридом
- 25. 3 Реакции отщепления В реакциях дегидратации (отщепления воды, элиминирования Е) проявляются основные свойства спиртов. Как катализаторы
- 26. 3 Реакции отщепления Направление реакции отщепления определяется правилом Зайцева: водород отщепляется от наименее гидрогенизированного атома углерода,
- 27. 3 Любое влияние, делокализующее положительный заряд карбкатиона, ведет к его стабилизации. Это связано с индукционной стабилизацией
- 28. Стадия 1: Стадия 2: Образование третичного катиона связано с гидридным (Н-) сдвигом. Мигрировать может и алкильная
- 29. Механизм дегидратации Е2: Характерен для первичных спиртов
- 30. 3 Окисление Первичные и вторичные спирты могут быть окислены соответственно до альдегидов и кетонов. Третичные спирты
- 31. 3 Вторичные спирты окисляются до кетонов под действием: K2Cr2O7 в разбавленной серной кислоте, CrO3 в уксусной
- 32. 3 Дегидрирование спиртов Этим способом получают многие альдегиды и кетоны, пропуская пары первичного или вторичного спирта
- 33. Химические свойства Сложные эфиры с органическими и неорганическими кислотами Сульфаты Бораты Нитраты
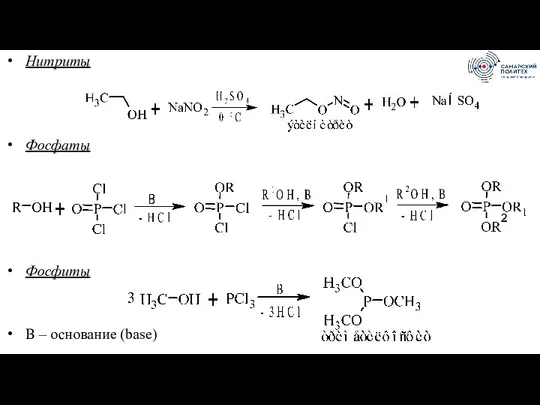
- 34. Нитриты Фосфаты Фосфиты В – основание (base)
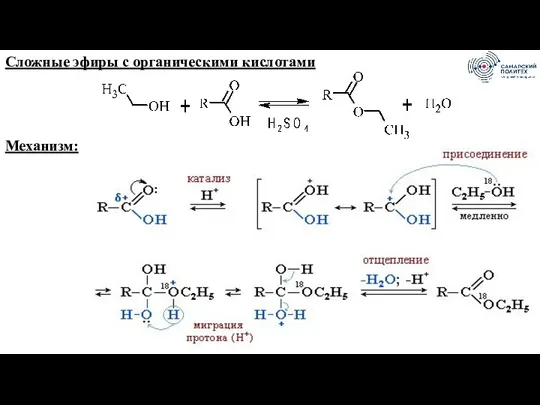
- 35. Сложные эфиры с органическими кислотами Механизм:
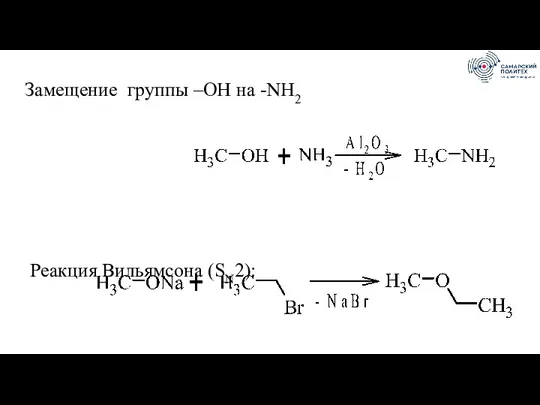
- 36. Замещение группы –ОН на -NH2 Реакция Вильямсона (SN2):
- 37. Отдельные представители 3 Метанол (метиловый, древесный спирт) – бесцветная жидкость со слабым спиртовым запахом. Используют в
- 38. 3 Этанол (этиловый, винный спирт) – бесцветная жидкость с характерным спиртовым запахом. Этиловый спирт используется в
- 39. 3 Бутиловый спирт и его сложные эфиры применяют как растворители лаков и смол Изобутиловый спирт применяется
- 40. Непредельные одноатомные спирты Виниловые спирты неустойчивы и обычно быстро изомеризуются в карбонильные соединения – правило Эльтекова-Эрленмейера
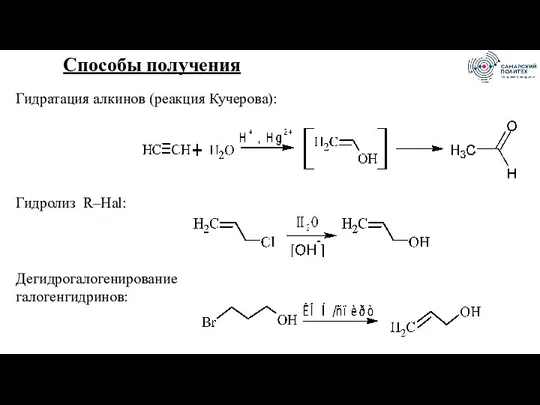
- 41. Способы получения Гидратация алкинов (реакция Кучерова): Гидролиз R–Hal: Дегидрогалогенирование галогенгидринов:
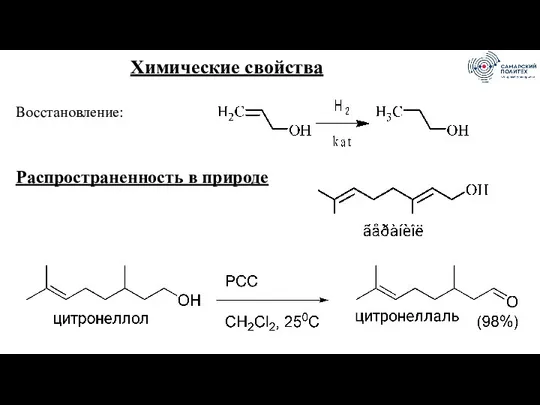
- 42. Химические свойства Восстановление: Распространенность в природе
- 43. Двухатомные спирты Спирты, содержащие несколько гидроксильных групп, называются многоатомными спиртами. Двухатомные спирты называются гликолями, общая формула
- 44. Двухатомные спирты Классификация 1. По взаимному расположению ОН-групп: α-, β-, γ- и т.д.
- 45. Двухатомные спирты Классификация 2. По атому углерода с которым связана ОН-группа 2.1. Двупервичные 2.2 Первично-вторичные 2.3
- 46. Изомерия и номенклатура гликолей Изомерия гликолей связана с изомерией углеродного скелета и взаимным расположением гидроксильных групп
- 47. Способы получения Гидролиз вицинальных дигалогенпроизводных или галогенгидринов Окисление алкенов водным раствором перманганата калия или пероксидом водорода
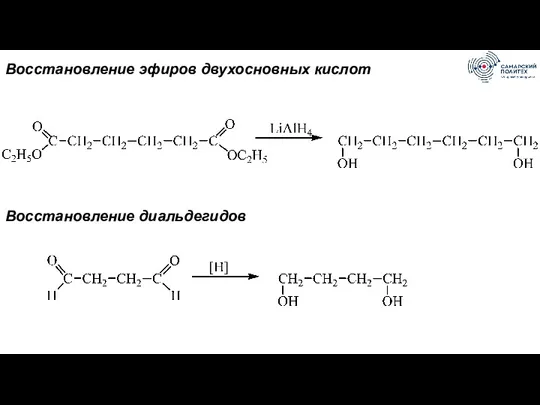
- 48. Восстановление эфиров двухосновных кислот Восстановление диальдегидов
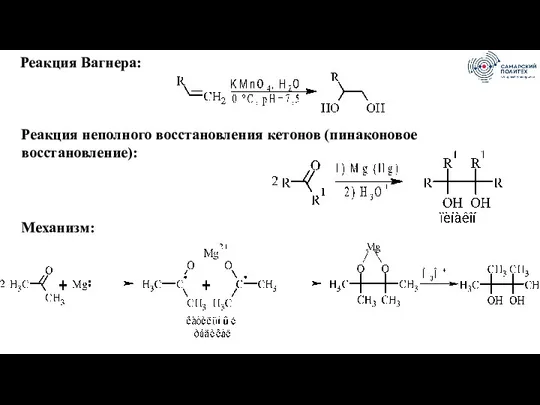
- 49. Реакция Вагнера: Реакция неполного восстановления кетонов (пинаконовое восстановление): Механизм:
- 50. Физические свойства Благодаря наличию межмолекулярных и внутримолекулярных водородных связей и большому числу полярных ОН-групп гликоли имеют
- 51. Химические свойства Образование гликолятов Особенностью гликолей является реакция с гидроксидом меди (качественная реакция на вицинальные диолы)
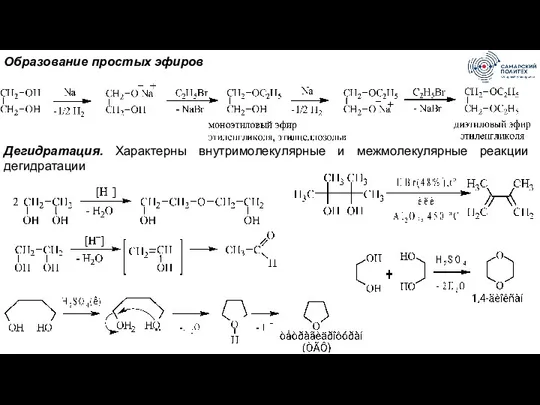
- 52. Образование простых эфиров Дегидратация. Характерны внутримолекулярные и межмолекулярные реакции дегидратации
- 53. Дегидратация α-двутретичных гликолей (пинаконов) в присутствии кислот, приводящая к образованию пинаколинов (пинакон-пинаколиновая перегруппировка):
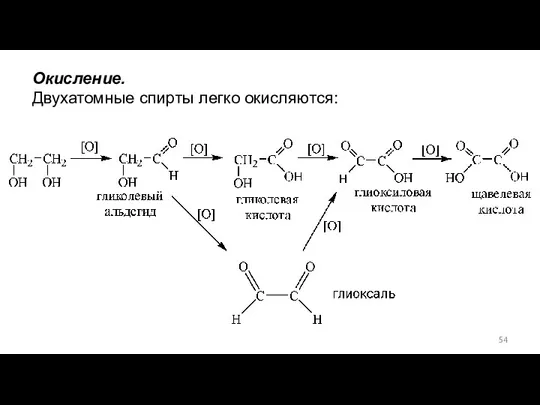
- 54. Окисление. Двухатомные спирты легко окисляются:
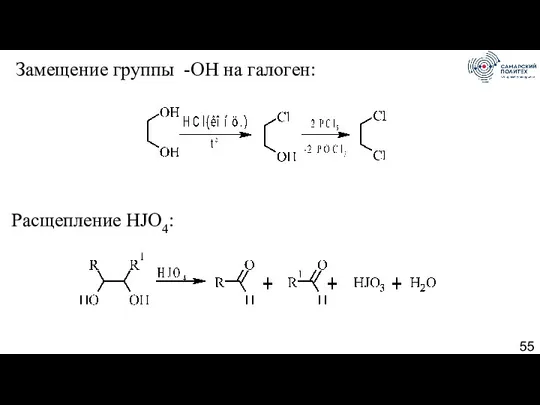
- 55. Замещение группы -ОН на галоген: Расщепление HJO4:
- 56. Отдельные представители Этиленгликоль и пропиленгликоль используют в производстве антифризов. Этиленгликоль применяется в синтезе полимеров – полиэтилентерефталата
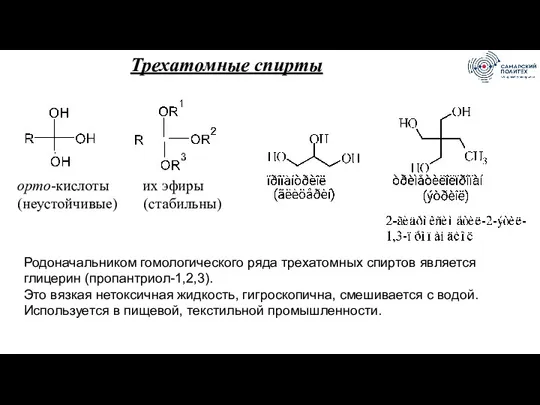
- 57. Трехатомные спирты орто-кислоты их эфиры (неустойчивые) (стабильны) Родоначальником гомологического ряда трехатомных спиртов является глицерин (пропантриол-1,2,3). Это
- 58. Трехатомные спирты. Получение. Гидролиз жиров. Долгое время единственным источником получения глицерина служило мыловаренное производство Из пропилена
- 59. 5. При производстве биодизеля Химические свойства Качественная реакция с Cu(OH)2 (образование окрашенного комплекса синего цвета): Трехатомные
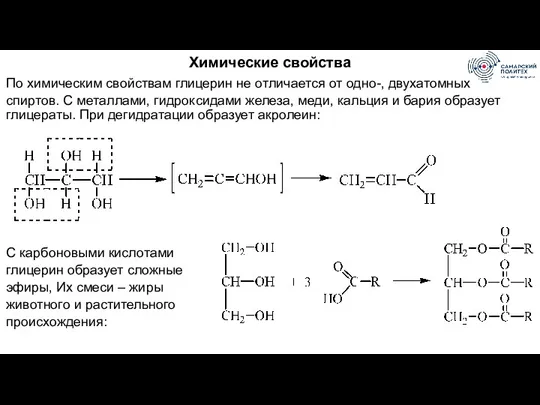
- 60. Химические свойства По химическим свойствам глицерин не отличается от одно-, двухатомных спиртов. С металлами, гидроксидами железа,
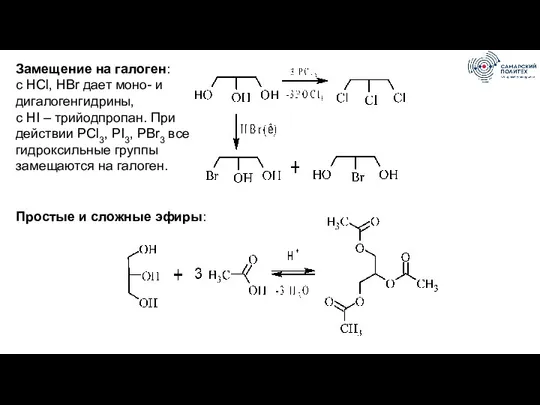
- 61. Замещение на галоген: с HCl, HBr дает моно- и дигалогенгидрины, с HI – трийодпропан. При действии
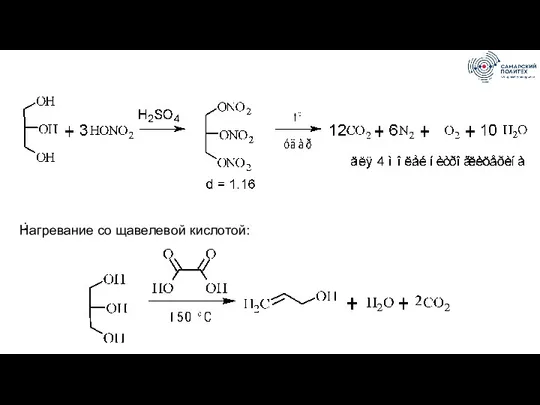
- 62. Нагревание со щавелевой кислотой: :
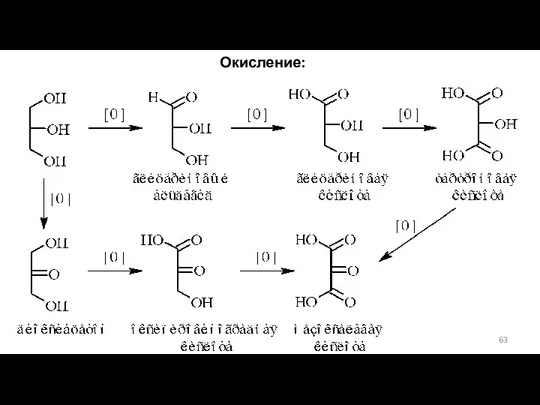
- 63. Окисление:
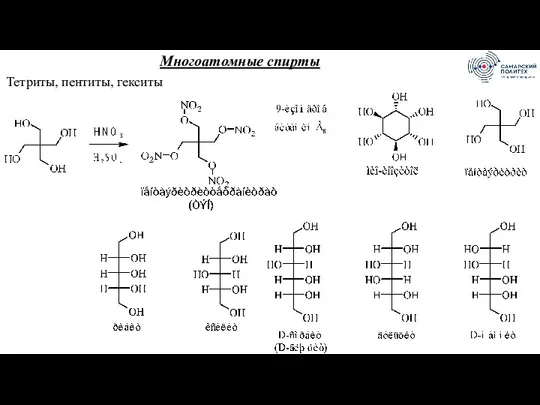
- 64. Многоатомные спирты Тетриты, пентиты, гекситы
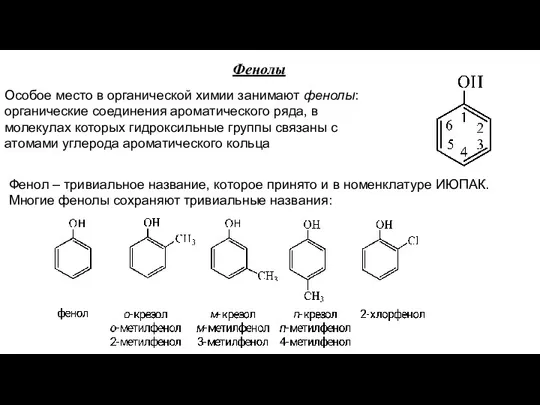
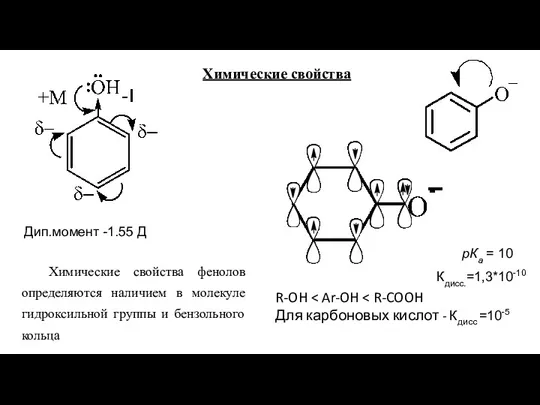
- 65. Фенолы Особое место в органической химии занимают фенолы: органические соединения ароматического ряда, в молекулах которых гидроксильные
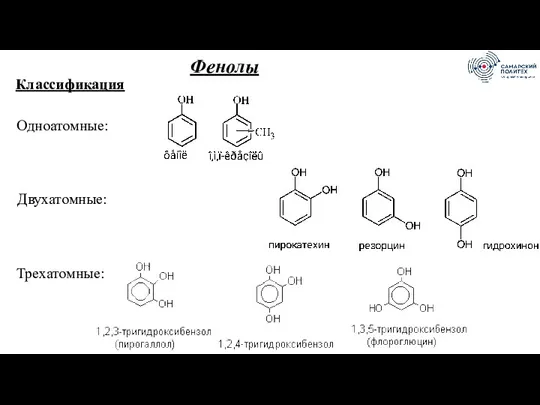
- 66. Фенолы Классификация Одноатомные: Двухатомные: Трехатомные:
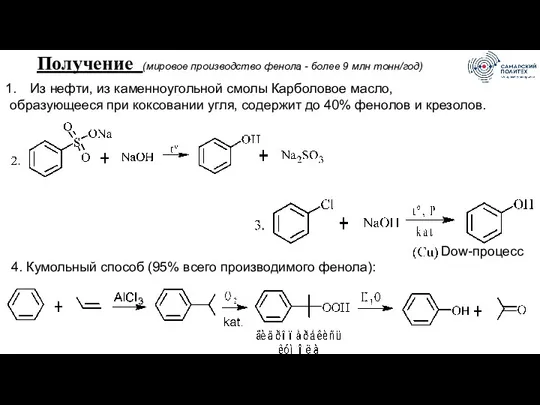
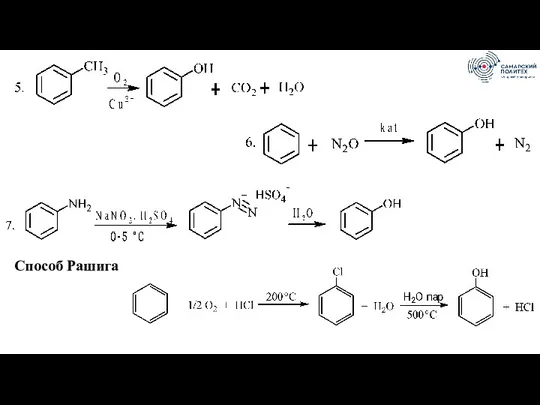
- 67. Получение (мировое производство фенола - более 9 млн тонн/год) Из нефти, из каменноугольной смолы Карболовое масло,
- 68. Способ Рашига
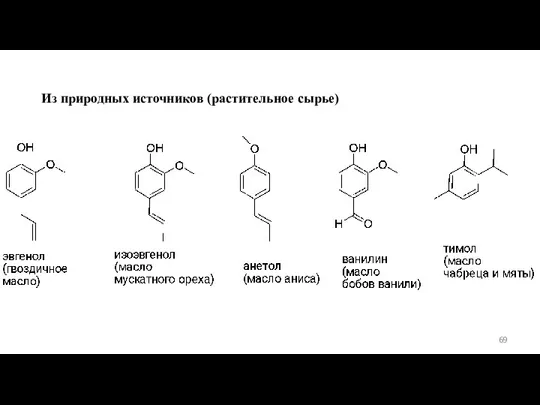
- 69. Из природных источников (растительное сырье)
- 70. Химические свойства Кдисс.=1,3*10-10 Дип.момент -1.55 Д Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и
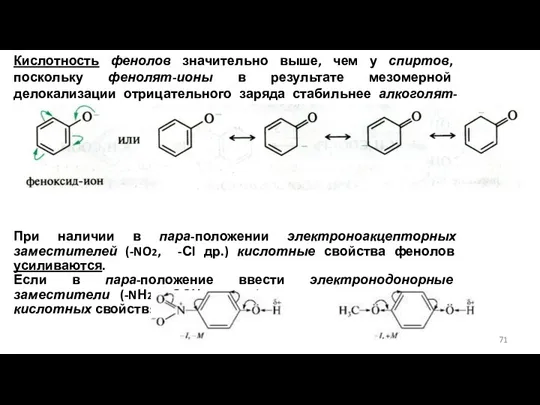
- 71. Кислотность фенолов значительно выше, чем у спиртов, поскольку фенолят-ионы в результате мезомерной делокализации отрицательного заряда стабильнее
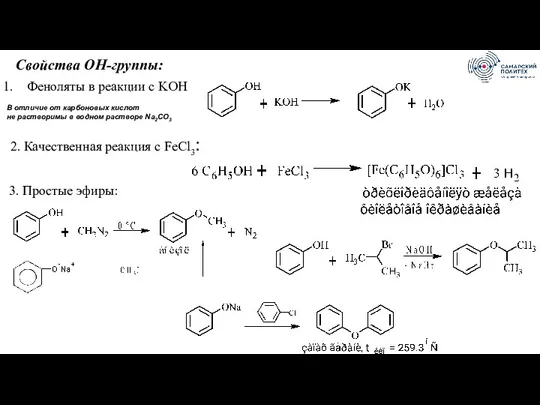
- 72. Свойства ОН-группы: Феноляты в реакции с KOH В отличие от карбоновых кислот не растворимы в водном
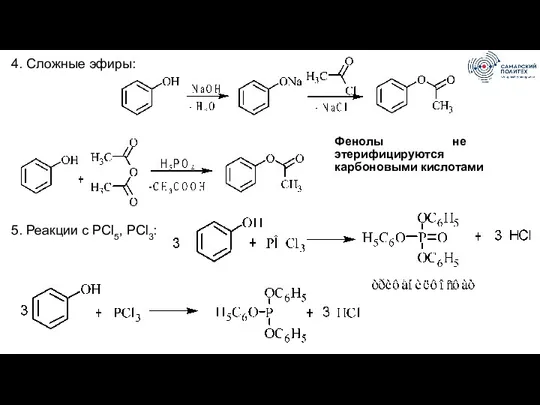
- 73. 4. Сложные эфиры: 5. Реакции с PCl5, PCl3: Фенолы не этерифицируются карбоновыми кислотами
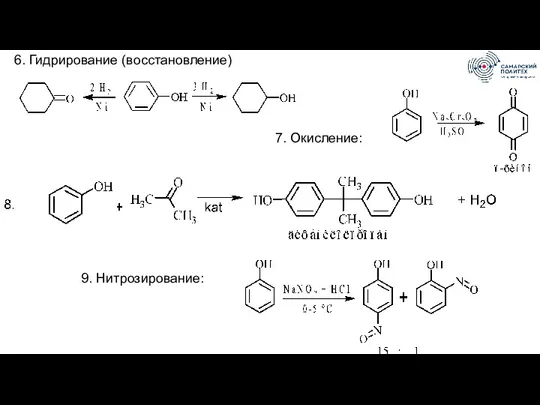
- 74. 6. Гидрирование (восстановление) 7. Окисление: 9. Нитрозирование:
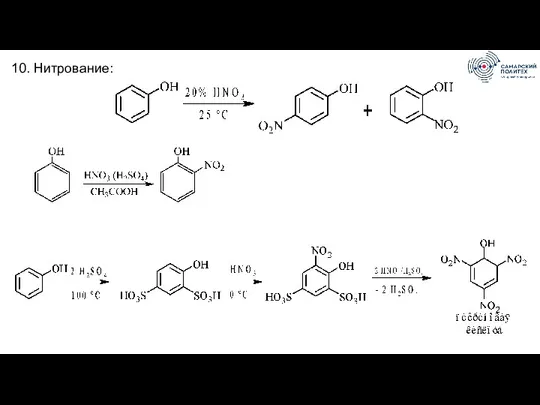
- 75. 10. Нитрование:
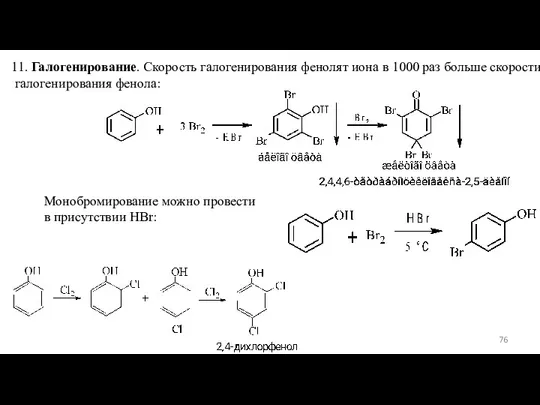
- 76. 11. Галогенирование. Скорость галогенирования фенолят иона в 1000 раз больше скорости галогенирования фенола: Монобромирование можно провести
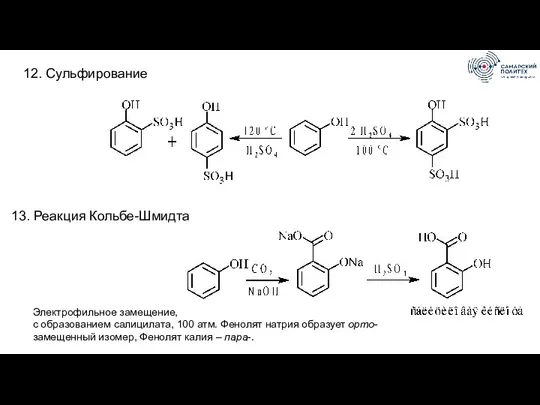
- 77. 12. Сульфирование 13. Реакция Кольбе-Шмидта Электрофильное замещение, с образованием салицилата, 100 атм. Фенолят натрия образует орто-замещенный
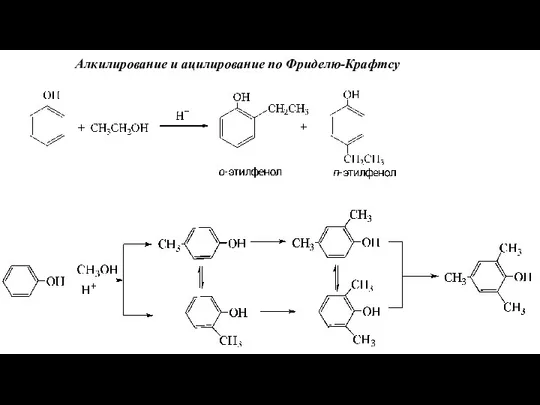
- 78. Алкилирование и ацилирование по Фриделю-Крафтсу
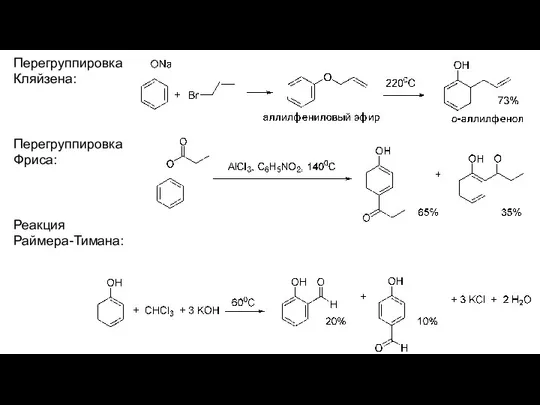
- 79. Перегруппировка Кляйзена: Перегруппировка Фриса: Реакция Раймера-Тимана:
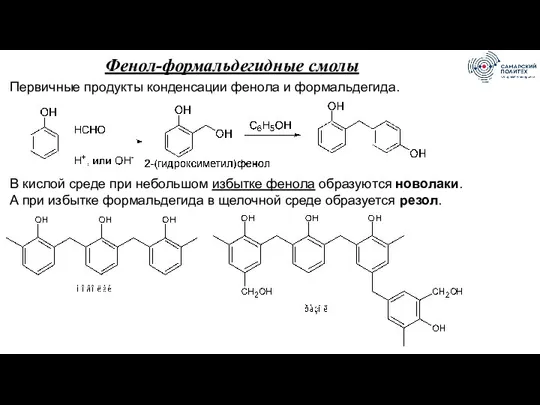
- 80. Фенол-формальдегидные смолы Первичные продукты конденсации фенола и формальдегида. В кислой среде при небольшом избытке фенола образуются
- 81. Двухатомные фенолы. Трехатомные фенолы. Нафтолы. (Самостоятельно)
- 82. Отдельные представители Фенол – кристаллическое вещество с т. пл. 43°С, обладает характерным едким запахом, вызывает ожоги
- 84. Скачать презентацию












































 Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4
Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4 Характеристика азота и фосфора. Физические и химические свойства
Характеристика азота и фосфора. Физические и химические свойства Строение, свойства и функции белков
Строение, свойства и функции белков Азот в нашей жизни
Азот в нашей жизни Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Кремний. Применение кремния
Кремний. Применение кремния Ферменти
Ферменти Аналитическая химия
Аналитическая химия Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Гірські породи
Гірські породи Пластмаси та полімери
Пластмаси та полімери Серная кислота
Серная кислота Сложные эфиры. Жиры
Сложные эфиры. Жиры Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Crystal defects
Crystal defects Непредельные углеводороды
Непредельные углеводороды Урок 25
Урок 25 Фосфор. Открытие фосфора
Фосфор. Открытие фосфора Жесткость воды
Жесткость воды Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Фенолы. Историческая справка
Фенолы. Историческая справка Химия в быту
Химия в быту Живая» и «мёртвая» вода
Живая» и «мёртвая» вода Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс