Содержание
- 2. Историческая справка В 1834г. немецкий химик-органик Фридлиб Фердинанд Рунге обнаружил в продуктах перегонки каменноугольной смолы белое
- 3. 1842г. Огюст Лоран определил состав вещества. Новое вещество обладало выраженными кислотными свойствами и было производным открытого
- 4. Шарль Фридерик Жерар считал полученное вещество спиртом и предложил называть его фенолом. Было установлено, что целая
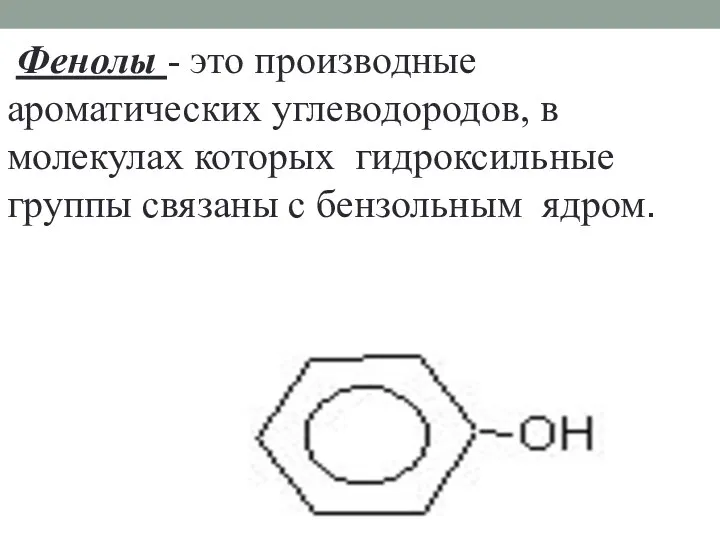
- 5. Фенолы - это производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с бензольным ядром.
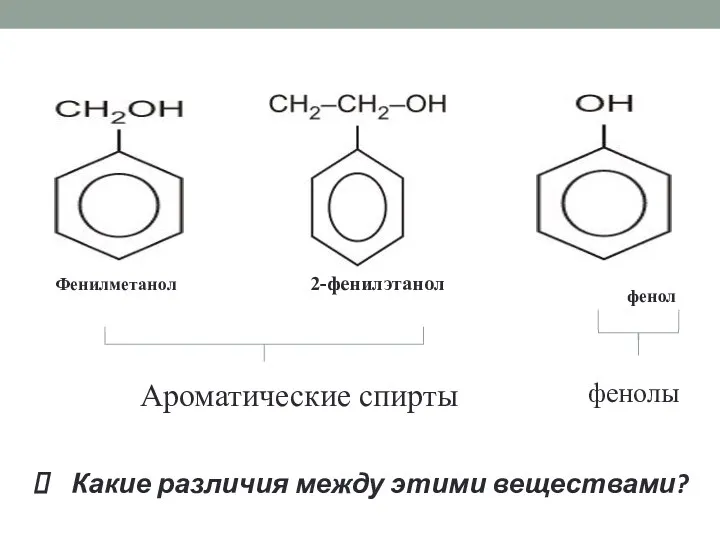
- 6. Фенилметанол 2-фенилэтанол фенол Какие различия между этими веществами? Ароматические спирты фенолы
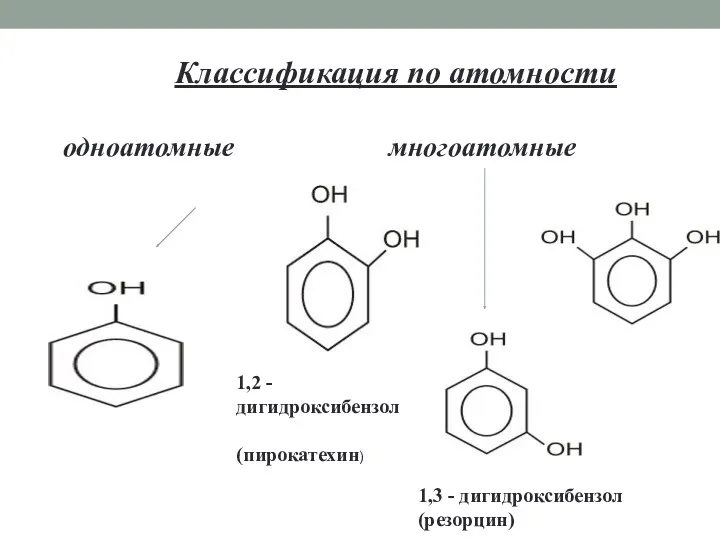
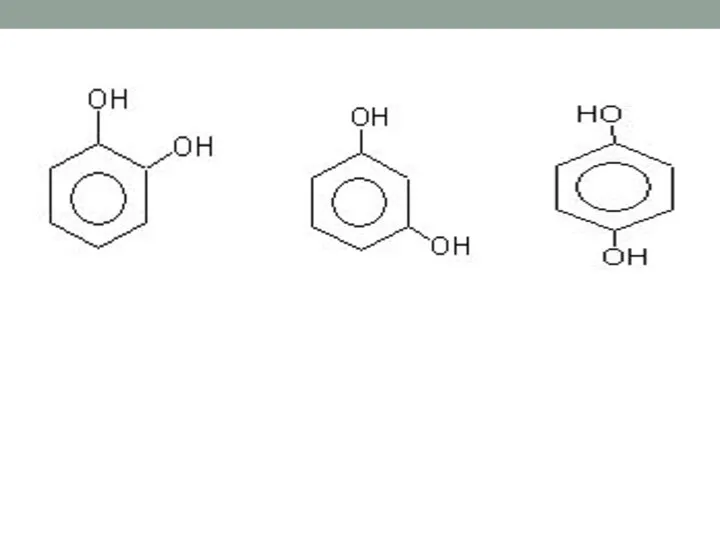
- 7. Классификация по атомности одноатомные многоатомные 1,2 - дигидроксибензол (пирокатехин) 1,3 - дигидроксибензол (резорцин)
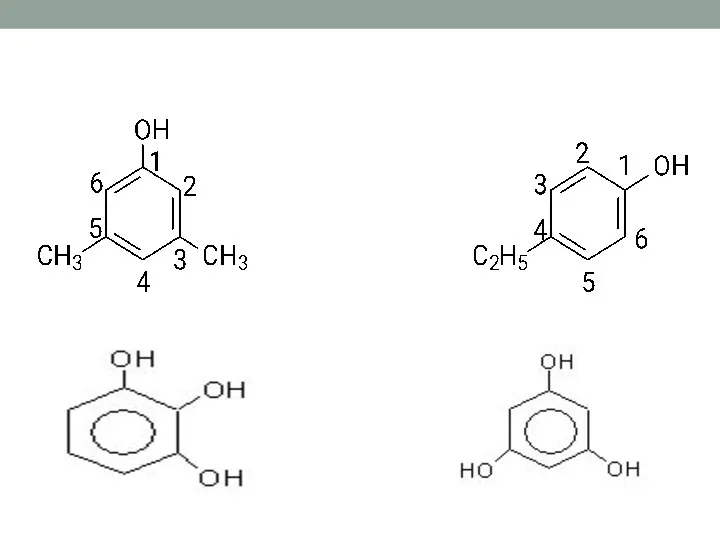
- 8. номенклатура Родоначальная структура- фенол Нумерацию в кольце начинают от атома, связанного с OH-группой, таким образом,чтобы имеющиеся
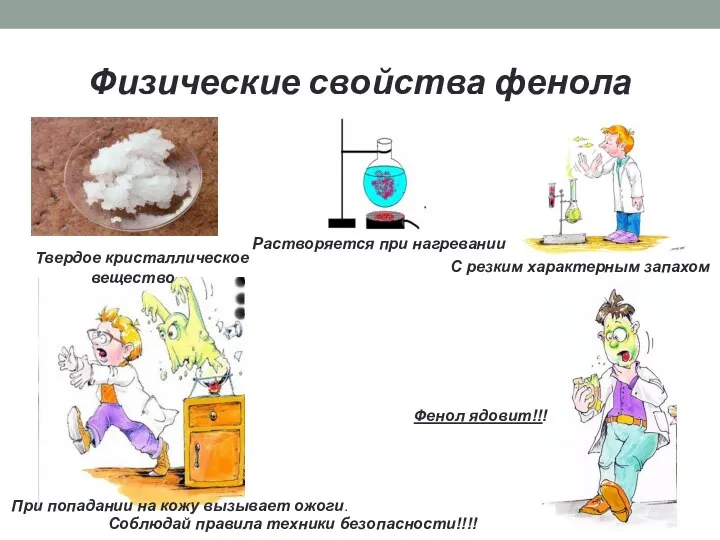
- 11. Физические свойства фенола Твердое кристаллическое вещество С резким характерным запахом Растворяется при нагревании Фенол ядовит!!! При
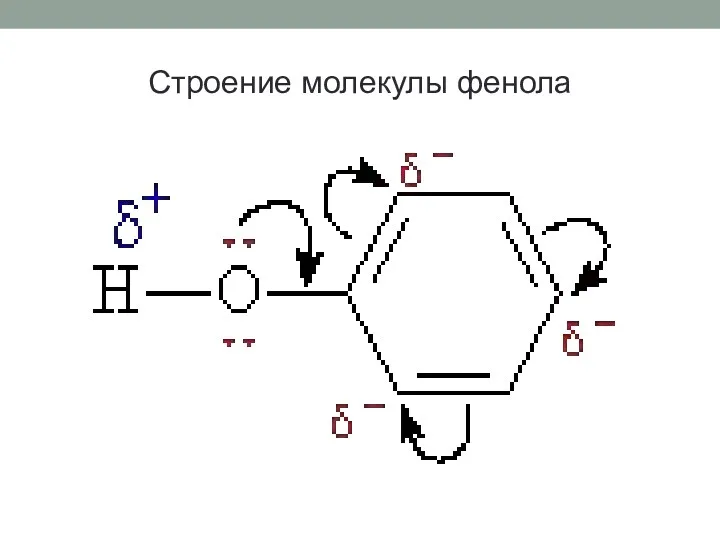
- 13. Неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь
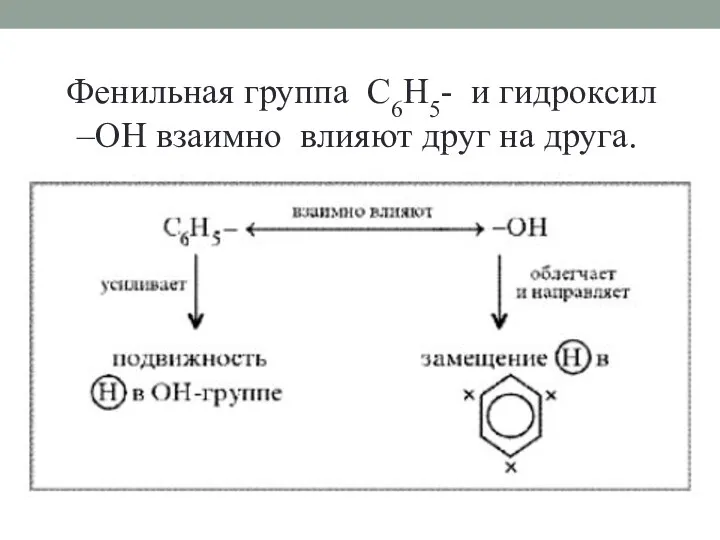
- 14. Фенильная группа C6H5- и гидроксил –OH взаимно влияют друг на друга.
- 15. Строение молекулы фенола
- 16. Химические свойства фенола I) Кислотные свойства фенола: замещение атома водорода гидроксильной группы. 1)Взаимодействие с активными металлами
- 17. 3) Взаимодействие с галогенопроизводными Образуются простые эфиры Сначала получают более реакционноспособные феноляты, а затем проводят их
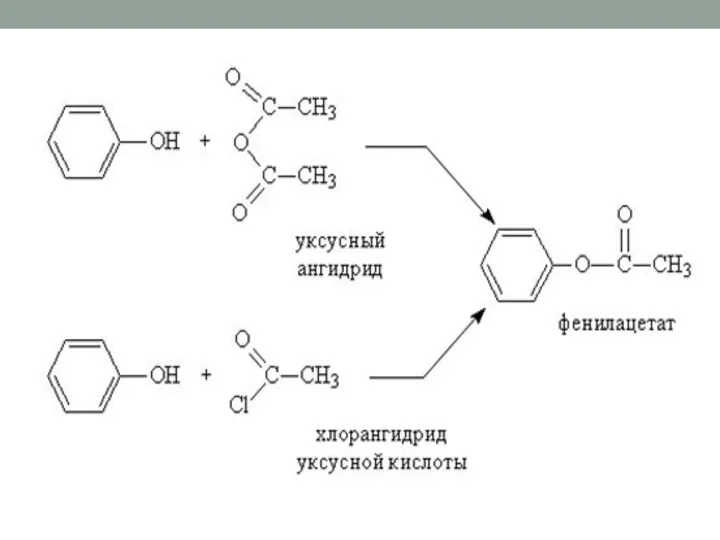
- 18. 4) О-Ацилирование фенолов. Сложные эфиры фенолов можно получить только взаимодействием фенолятов с галогенангидридами, ангидридами карбоновых кислоткислот:
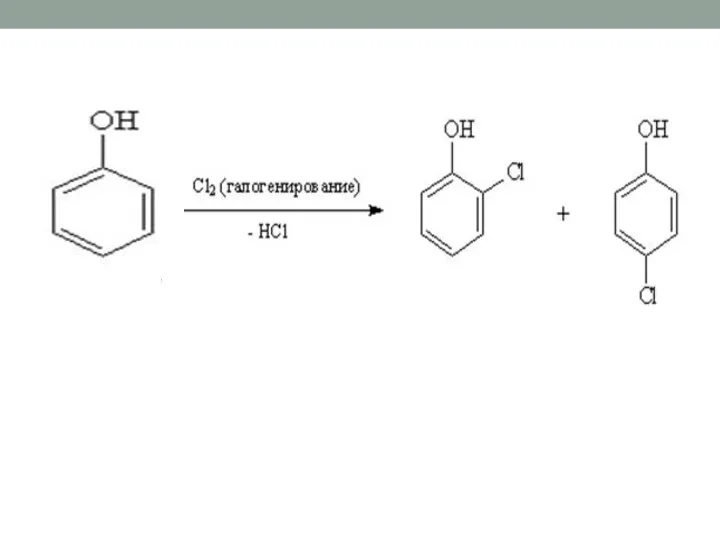
- 20. Реакции замещения атомов водорода в бензольном кольце (реакции электрофильного замещения).
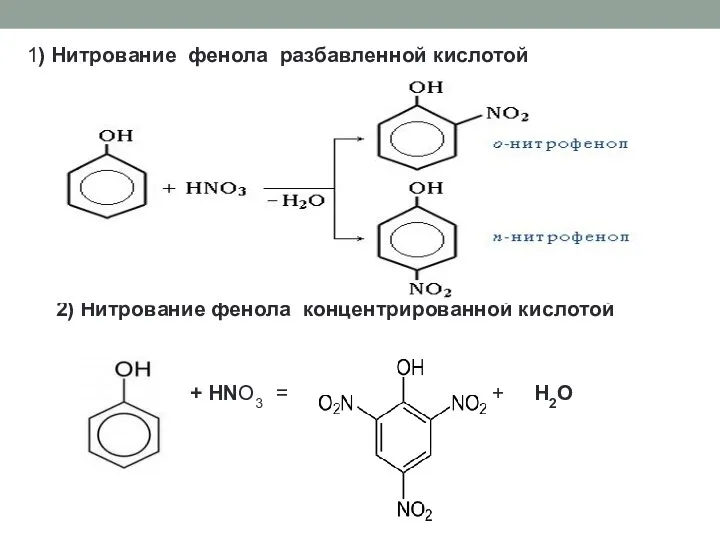
- 22. 1) Нитрование фенола разбавленной кислотой 2) Нитрование фенола концентрированной кислотой + HNO3 = + H2O
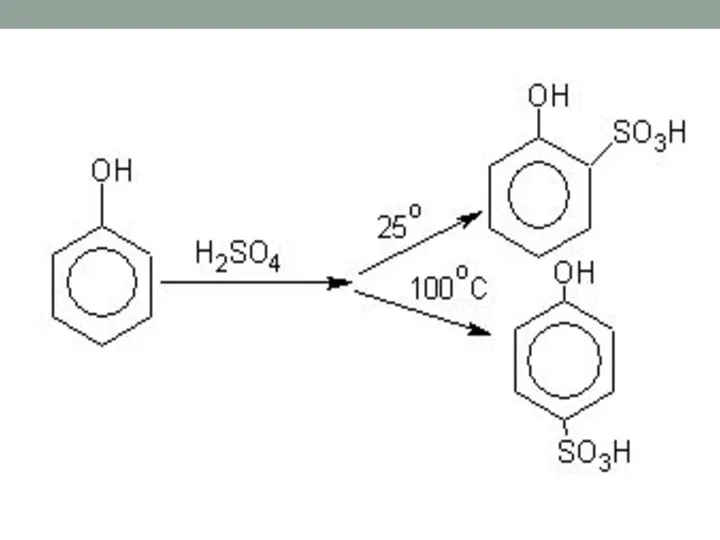
- 23. Реакция сульфирования . Фенол легко сульфируется концентрированной H2SO4, при этом при температуре 15-20оС преимущественно получается о-изомер,
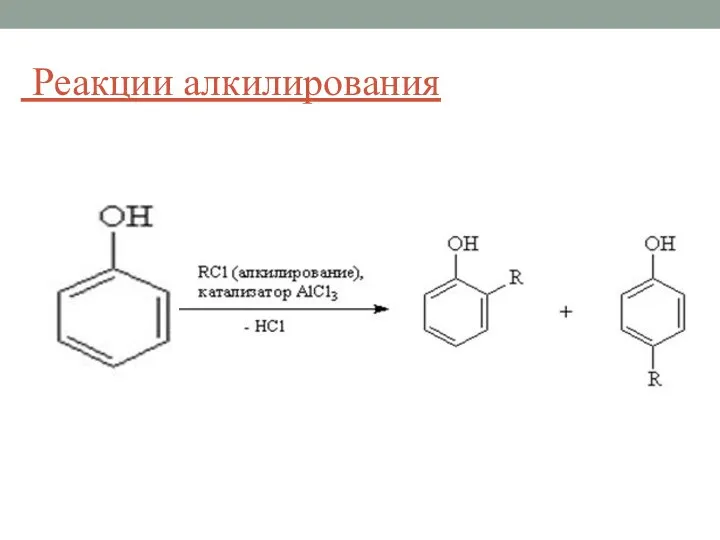
- 25. Реакции алкилирования
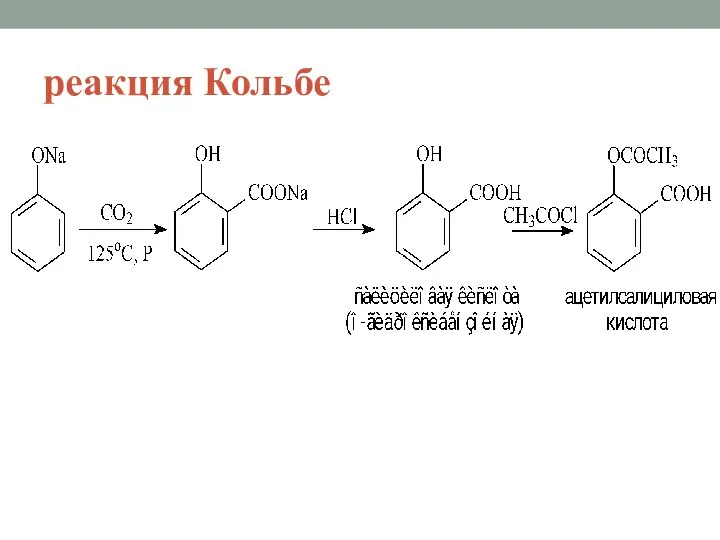
- 26. реакция Кольбе
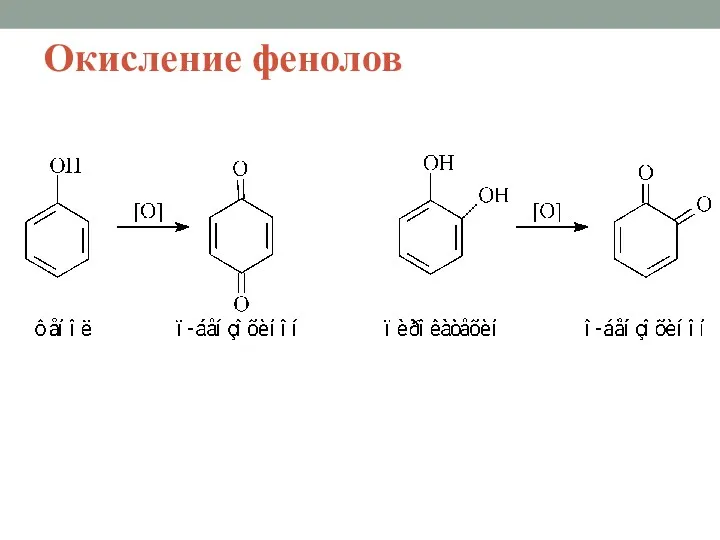
- 27. Окисление фенолов
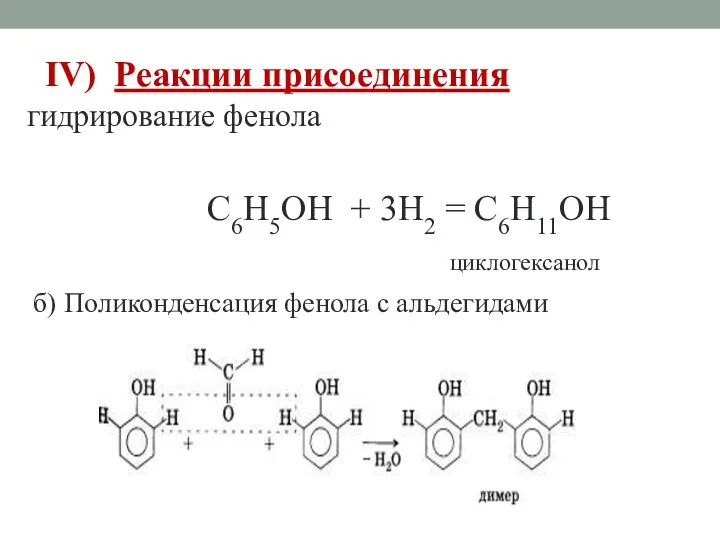
- 28. IV) Реакции присоединения гидрирование фенола C6H5OH + 3H2 = C6H11OH циклогексанол б) Поликонденсация фенола с альдегидами
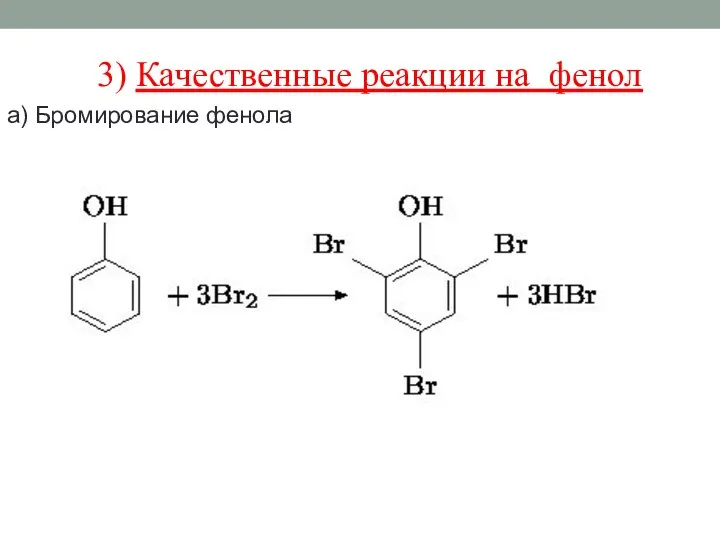
- 29. 3) Качественные реакции на фенол а) Бромирование фенола
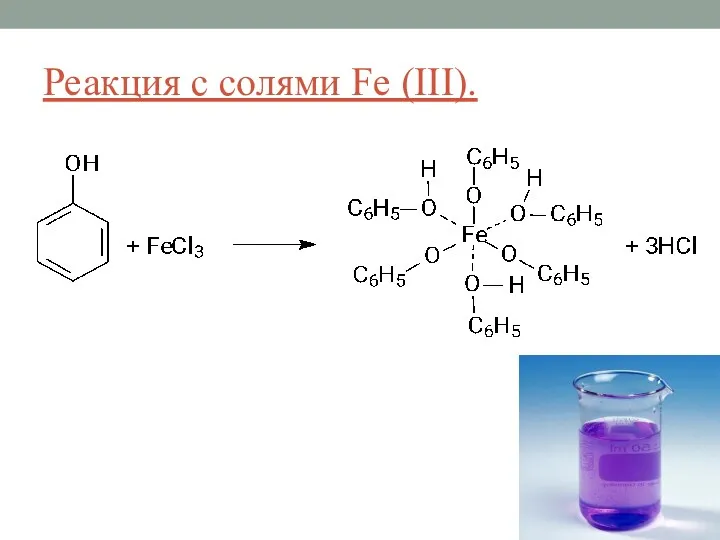
- 30. Реакция с солями Fe (III).
- 31. Резорцин – при взаимодействии с FeCl3 дают фиолетовое окрашивание, образуя трирезорцинолят железа, пирокатехин – грязно-зеленое, гидрохинон
- 32. Применение фенола
- 34. Скачать презентацию













 Химия в повседневной жизни человека
Химия в повседневной жизни человека Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Значення хімічних процесів у природі
Значення хімічних процесів у природі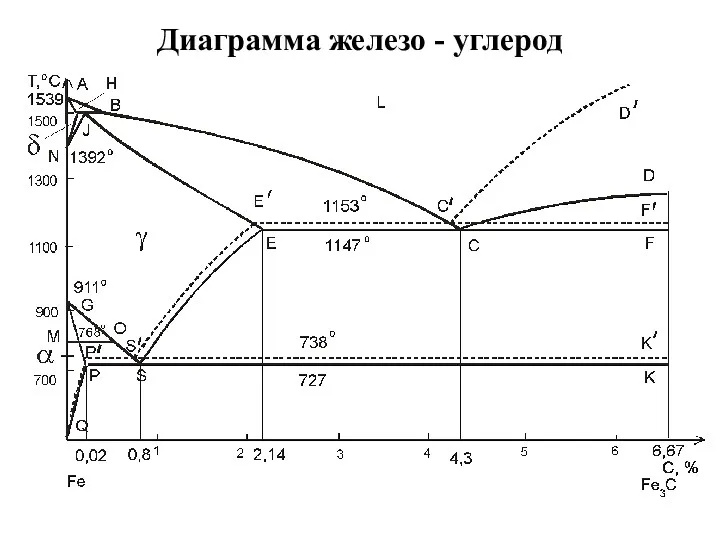 Диаграмма железо - углерод
Диаграмма железо - углерод 36fd4612109c46a6a8f3b83635fe0e02
36fd4612109c46a6a8f3b83635fe0e02 Основы химического равновесия
Основы химического равновесия Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Основные классы неорганических соединений
Основные классы неорганических соединений Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Характеристика хімічного елемента Hg
Характеристика хімічного елемента Hg Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов
Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Химический элемент и вещество
Химический элемент и вещество Номенклатура органических соединений
Номенклатура органических соединений Хром, марганец
Хром, марганец Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Химиядан сұрақтар
Химиядан сұрақтар Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Цепные химические реакции
Цепные химические реакции Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3 Витаминные препараты
Витаминные препараты Водород
Водород Электролитическая диссоциация
Электролитическая диссоциация Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Введение в химию. 8 класс
Введение в химию. 8 класс