Содержание
- 2. Жоспары: Бейметалдар туралы түсінік Сутегі.
- 3. Бейметалдарға жалпы сипаттама Д.И Менделеевтің периодтық жүйесінде 22 бейметалл орналасқан: 10 типтік бейметалдар : (H,C,N,P,O,S,F,CI, Br,I)
- 4. Бейметалл элементтерінің аздығына қарамастан жер бетінде және ғарышта олардың ролі өте зор. Күн жүйесінің және басқа
- 5. Тіршілік үшін 6 бейметалл аса маңызды C, O, N, H, P, S (органогенді элементтер) деп аталады.
- 6. Периодтық жүйедегі бейметалдардың орналасуы: Бейметалдар периодтық жүйеде егер бордан астатқа қарай ойша диагональ жүргізетін болсақ, оң
- 7. Бейметалдардың металдарға қарағанда иондану энергиясы, электронтартқыштығы және олардың электртерістілігі де жоғары болып келеді. Топ бойынша жоғарыдан
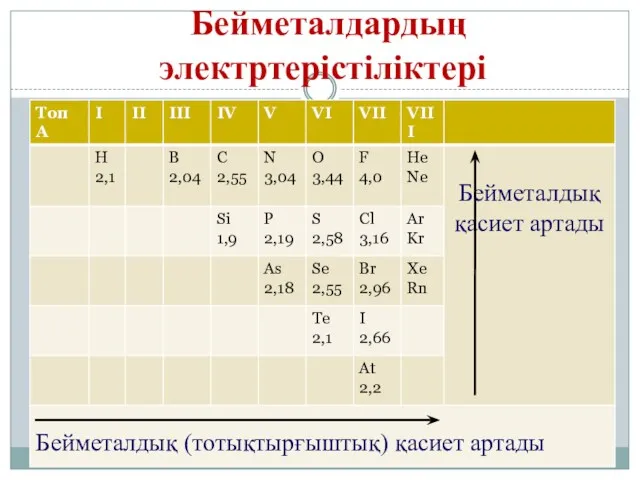
- 8. Бейметалдардың электртерістіліктері
- 9. Бейметалдардың физикалық қасиеттері Жылу өткізбейді (тек графит) Электрөткізгіштік байқалмайды (тек графит және қара фосфор) Жылтыры жоқ,
- 10. Бейметалдар тотықтырғыш және тотықсыздандырғыш (фтор, оттегі) Бейметалдар газ тәрізді ұшқыш сутекті қосылыстар түзеді. Олардың құрамы тотығу
- 11. Ұшқыш сутекті қосылыстарды үш топқа бөлуге болады: 1) Суда жақсы еритіндер (HCl, HBr, HJ, H2S, H2Se,
- 12. Ашылу тарихы Неміс дәрігері Парацельс (16 ғасыр) күкірт қышқылына темір салса бір “жанғыш ауаның” бөлініп шығатынын
- 13. Бұл мәселелерді ағылшын химигі 1766 жылы Генри Кавендиш шешті. Бұл газ жанғанда су түзілетін болғандықтан бертін
- 14. Сутек H 1 1S Табиғатта таралуы 1 , 0 0 7 9 Жер қыртысында (массалық үлесі
- 15. Сутегі молекуласы Н2 – екіатомды, химиялық байланыс түрі ковалентті полюссіз H – H H · +
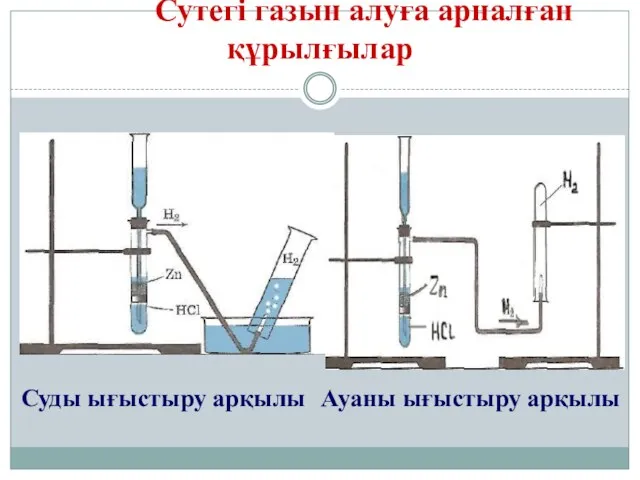
- 16. Сутегі газын алуға арналған құрылғылар Суды ығыстыру арқылы Ауаны ығыстыру арқылы
- 17. Физикалық қасиеті Сутегі газ түсі, иісі және дәмі жоқ. Өте жеңіл газ (ол 14,4 есе ауадан
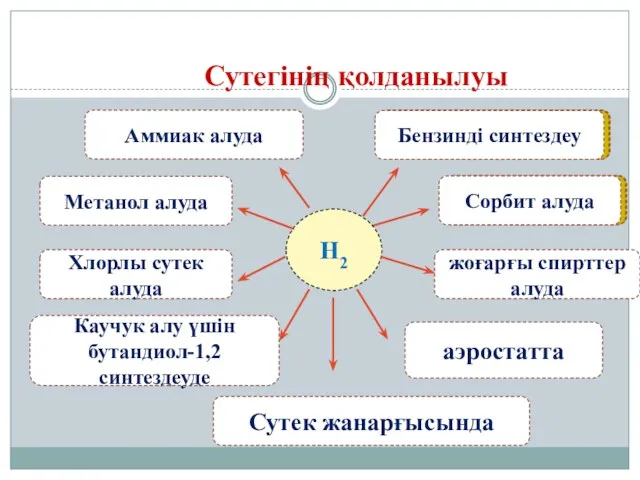
- 18. Сутегінің қолданылуы
- 20. Скачать презентацию














 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород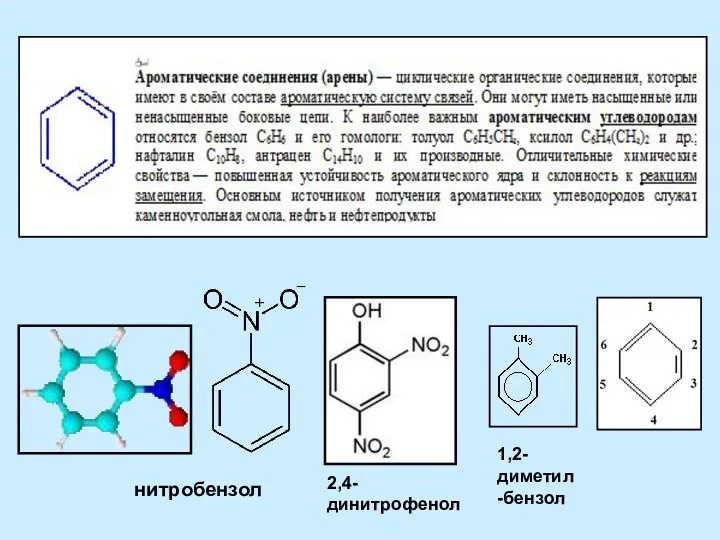 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод