Содержание
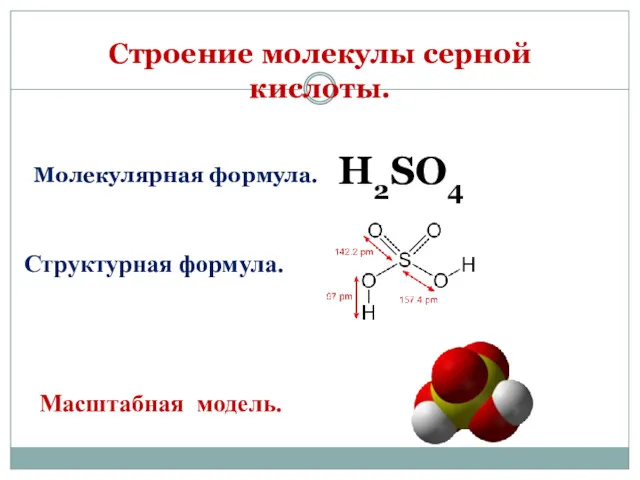
- 2. Строение молекулы серной кислоты. Масштабная модель. Структурная формула. H2SO4 Молекулярная формула.
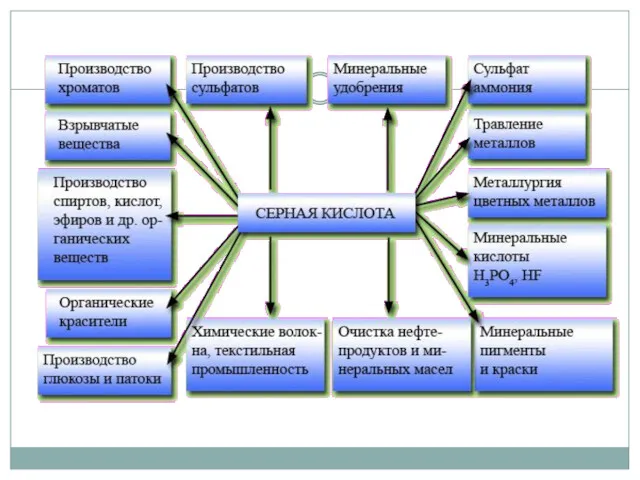
- 3. Серная кислота H2SO4, сильная двухосновная кислота. Безводная серная кислота бесцветная маслянистая жидкость, плотность 1,9203 г/см³, tпл
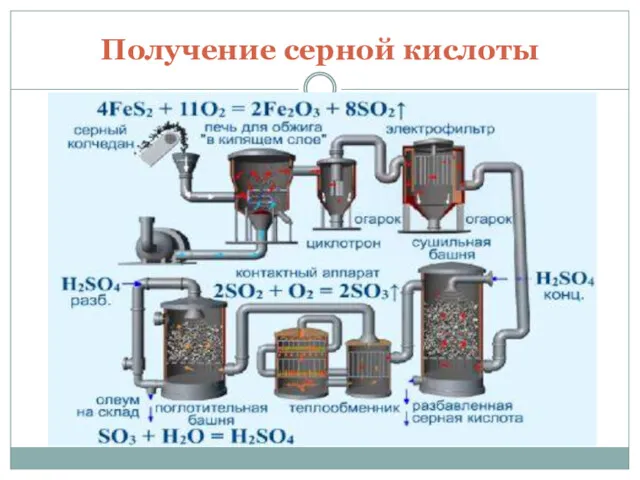
- 4. Получение серной кислоты S FeS2 H2S SO2 → SO3 → H2SO4 Пирит Серный колчедан
- 5. Получение серной кислоты
- 6. Правило разбавления кислот Сначала вода, потом кислота – иначе случится большая беда! http://files.school-collection.edu.ru/dlrstore/6ae368db-1a38-5b5c-82c3-aadd474e4be6/index.htm
- 7. Водоотнимающее свойство H2SO4 http://files.school-collection.edu.ru/dlrstore/7c646dda-e274-b217-58cf-1668d25430fb/index.htm
- 8. Разрушающее действие концентрированной серной кислоты (обугливание древесины) http://files.school-collection.edu.ru/dlrstore/e5984256-0b18-c23b-985b-397af5d9adbe/index.htm
- 9. Химические свойства разбавленной серной кислоты 1) Взаимодействие с металлами ( до Н2 ) Zn + H2SO4
- 10. Взаимодействие конц.H2SO4 с металлами http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6-aba916d777ee/index.htm
- 11. 2) Взаимодействие с оксидами металлов CuO + H2SO4 → CuSO4 + H2O ZnO + H2SO4 →
- 12. 3) Взаимодействие с основаниями 2NaOH + H2SO4 → Na2SO4 +2 H2O H+ + ОН- → H2O
- 13. K2CO3 + H2SO4 = K2SO4 + H2CO3 2H++ CO32- = H2O + CO2 4) Взаимодействие с
- 14. Качественная реакция MgSO4+BaCl2→BaSO4↓+ MgCl2 Белый молочный осадок http://files.school-collection.edu.ru/dlrstore/d8932e1e-fc13-f1de-2ace-288cbf49a4db/index.htm
- 15. Концентрированная серная кислота Концентрированная серная кислота-довольно сильный окислитель, особенно при нагревании.; окисляет HI и частично НВг
- 16. Продуктами восстановления кислоты обычно является оксид серы (IV), сероводород и сера (H2S и S) образуется в
- 18. Домашнее задание Параграф 27, стр. 204 зад. 5,7 и 8.Подготовка к проверочной по теме «Соединения серы»
- 20. Скачать презентацию













 Типичные окислители
Типичные окислители Количество вещества. 8 класс
Количество вещества. 8 класс Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Основания. Классификация оснований
Основания. Классификация оснований Водородный показатель
Водородный показатель Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Кристаллические решётки и их виды
Кристаллические решётки и их виды Алкалоиды, производные тропана
Алкалоиды, производные тропана Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров фосфор и его соединения
фосфор и его соединения Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Жидкое и растворимое стекло
Жидкое и растворимое стекло Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций O-alkylation catalysts
O-alkylation catalysts Электролитическая диссоциация
Электролитическая диссоциация Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Топырақ биоремедиациясы
Топырақ биоремедиациясы Равновесие в растворах электролитов
Равновесие в растворах электролитов Галогены. Свойства галогенов
Галогены. Свойства галогенов Ртуть
Ртуть Циклоалканы. 10 класс
Циклоалканы. 10 класс Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов