Содержание
- 2. Квантовая механика Квантовая механика – система понятий и уравнений, которые применяются для описания элементарных частиц, ядер,
- 3. Корпускулярно-волновой дуализм В 1924 г. французский физик Луи де Бройль высказал предположение: «Любая движущаяся частица одновременно
- 4. Корпускулярно-волновой дуализм Эта зависимость выражается уравнением: , где λ – длина волны; h – постоянная Планка,
- 5. Принцип неопределенности В 1925 г. немецкий физик В. Гейзенберг высказал положение: «Для микрочастицы атомного масштаба невозможно
- 6. Принцип неопределенности Математическое выражение этого положения: , где ∆q – неопределенность координат, или положения в пространстве;
- 7. Принцип неопределенности Из принципа неопределенности следует два вывода: Невозможно точно представить траекторию движения электрона в атоме;
- 8. Волновое уравнение В 1926 г. австрийский ученый Э. Шредингер предложил уравнение с помощью которого вычисляют вероятность
- 9. Волновое уравнение где сумма вторых производных волновой функции Ψ (пси) ; m – масса электрона; h
- 10. Квантово-механическая модель атома Квантово-механическая модель атома – это воображаемый вид атома, созданный на основе положений квантовой
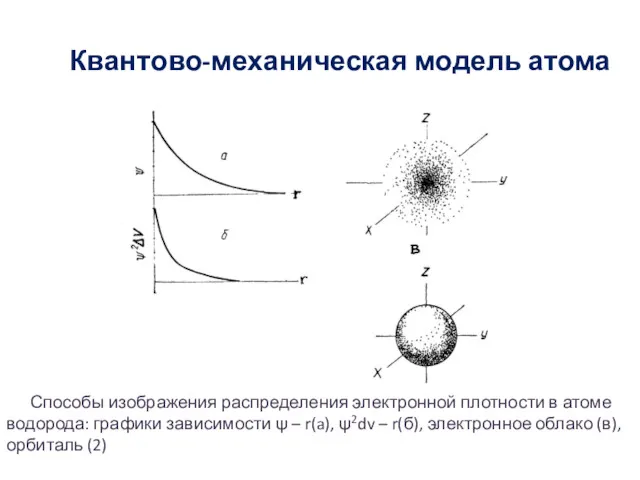
- 11. Квантово-механическая модель атома Способы изображения распределения электронной плотности в атоме водорода: графики зависимости ψ – r(a),
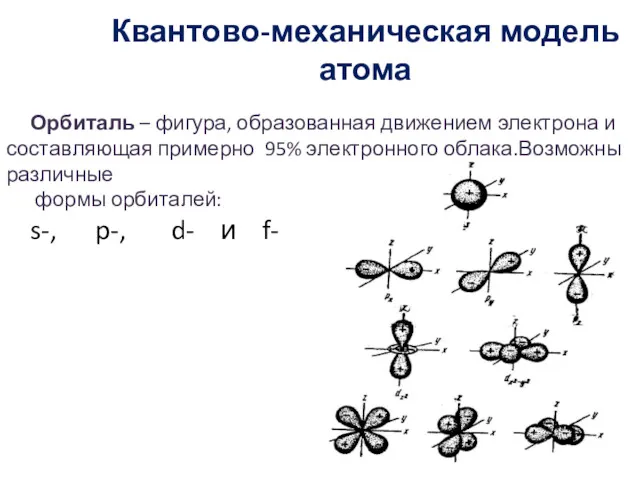
- 12. Квантово-механическая модель атома Орбиталь – фигура, образованная движением электрона и составляющая примерно 95% электронного облака.Возможны различные
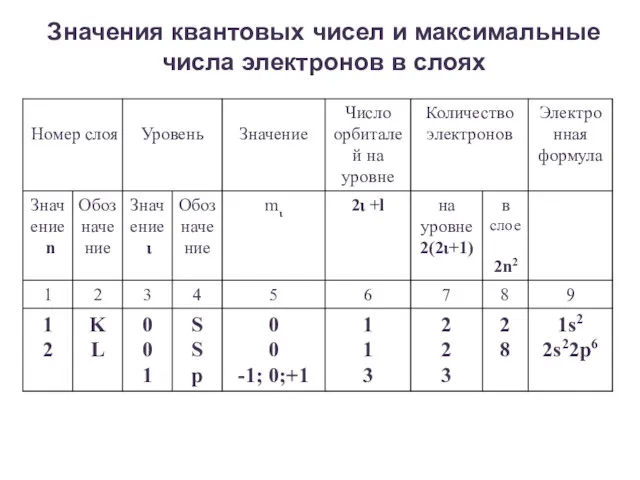
- 13. Квантовые числа Энергетическое состояние электрона в атоме характеризуется четырьмя квантовыми числами; n – главное, ℓ -
- 14. n - главное квантовое число определяет полный запас энергии электрона в размер электронной обитали. n принимает
- 15. l - побочное (орбитальное) квантовое число устанавливает уровень (подуровень) энергии и форму обитали, а следовательно, форму
- 16. ml - магнитное квантовое число Оно определяет пространственное расположение атомной орбитали и принимает целые значения от
- 18. Изображение с помощью граничных поверхностей s-, p-, d- и f-орбиталей.
- 19. s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально
- 20. d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1,
- 21. ms -спиновое квантовое число Экспериментально установленно, что электрон имеет еще одно свойство – спин. Спиновое квантовое
- 22. Заполнение атомных орбиталей
- 23. Принцип наименьшей энергии При застройке атома каждый электрон размещается на той обитали, которой соответствует минимальное значение
- 24. Принцип Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел,
- 25. Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам: при застройке на последнем слое не
- 26. Правило Хунда: суммарное спиновое число электронов данного уровня должно быть максимальным. Иными словами, орбитали данного уровня
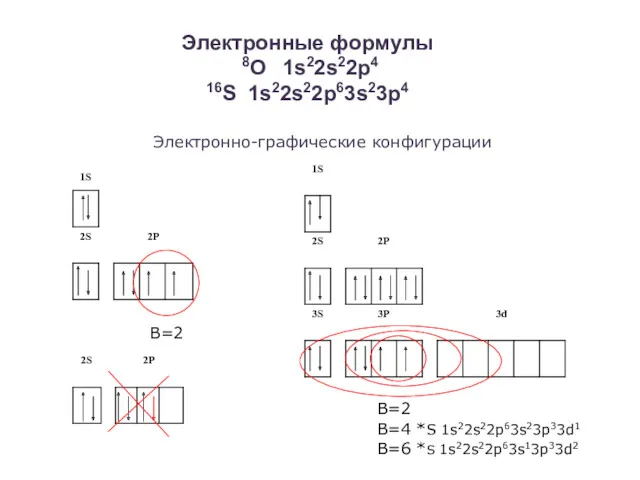
- 27. Электронные формулы 8О 1s22s22p4 16S 1s22s22p63s23p4 Электронно-графические конфигурации В=2 В=2 В=4 *S 1s22s22p63s23p33d1 В=6 *S 1s22s22p63s13p33d2
- 28. правилa Клечковского 1. Минимумом энергии обладают обитали с наименьшей суммой главного и побочного квантовых чисел n+l.
- 29. правилa Клечковского 2. При одинаковых значениях суммы n+l меньшей энергией обладает орбиталь с меньшем значением главного
- 30. Энергия атомных орбиталей возрастает согласно ряду 1s
- 31. Периодическая система элементов Исследуя изменение химических свойств элементов в зависимости от величины их относительной атомной массы
- 32. Физическая основа периодического закона была установлена в 1922 г. Н. Бором. Поскольку химические свойства обусловлены строением
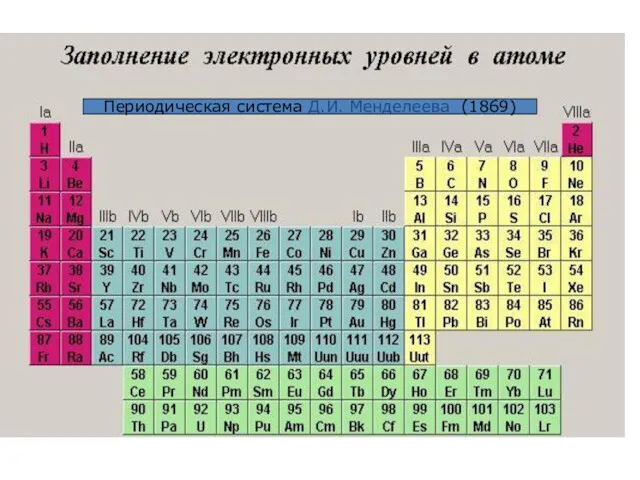
- 33. Периодическая система Д.И. Менделеева (1869)
- 34. периодическая система состоит из горизонтальных и вертикальных рядов – периодов и групп. Период – горизонтальный ряд,
- 35. По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – А – состоящие
- 36. В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s- и p-орбиталях внешнего
- 37. Первый период (n = 1, l = 0) состоит из двух элементов H (1s1) и He
- 38. четвертый период. Следующие за Ar калий и кальций имеют внешним 4s-электроны. Появление 4s-электронов при наличии свободных
- 39. Начиная со скандия (Z = 21) заполняется 3d-орбиталь, а во внешнем слое остаются 4s-электроны. в четвертом
- 40. Дальше в четвертом периоде после десяти d-элементов появляются p-элементы от Ga (4s24p1) до Kr (4s24p6) Пятый
- 41. Седьмой период отчасти повторяет шестой. 5f-элементы называются актиноидами. Их общая формула 5f2–146d0–17s2. Далее следует еще шесть
- 42. Периодичность атомных характеристик орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать
- 43. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек У s- и p-элементов изменение
- 44. Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда
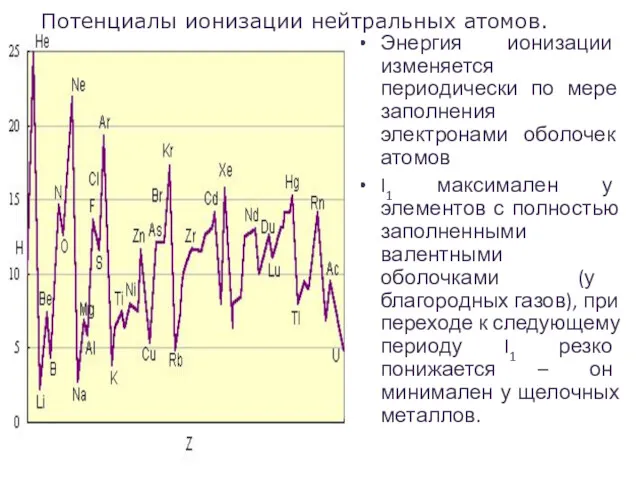
- 45. Энергией ионизации атома (I) называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
- 46. I выражается в кДж∙моль–1 или эВ∙атом–1. Значения I в электронвольтах численно равны потенциалам ионизации, выраженным в
- 47. Потенциалы (энергии) ионизации I1
- 48. Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов I1 максимален у элементов с полностью
- 49. Энергия связи электрона с ядром пропорциональна Z и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы
- 50. В побочных подгруппах d-электроны экранируются не только электронами заполненных оболочек, но и внешними s-электронами. Поэтому потенциал
- 51. Энергия сродства к электрону (Е)– энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное
- 52. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p6 и переходные элементы. У
- 53. Рассмотрим кислородсодержащие кислоты хлора, в молекулах которых хлор проявляет различные степени окисления: хлорноватистая хлористая хлорноватая хлорная
- 54. Электроотрицательность (ЭО) Для более полной характеристики тенденции элемента к присоединению или отдаче электронов введено понятие электроотрицательности
- 56. Значения квантовых чисел и максимальные числа электронов в слоях
- 58. Домашнее задание Что характеризует и какие значения принимает главное квантовое число? Сколько максимально электронов находится на
- 59. Как изменяются величины энергий ионизации у элементов главных и побочных подгрупп (по вертикали) и у d-элементов
- 60. Напишите современную формулировку периодического закона Д.И. Менделеева. Как меняются окислительные способности и кислотные свойства в ряду:
- 61. Химическая связь
- 62. Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по
- 63. Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего
- 64. Коссель Вальтер (4.I.1888–22.V.1956) Немецкий физик. Основные исследования посвящены развитию электронных представлений в химии. Предложил (1916) статическую
- 65. Льюис Гильберт (23.X.1875–23.III.1946) Льюис Гильберт Ньютон Американский физикохимик. Основные работы посвящены химической термодинамике и теории строения
- 66. Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или
- 67. Сложение дипольных элементов в молекулах NH3 и NF3.
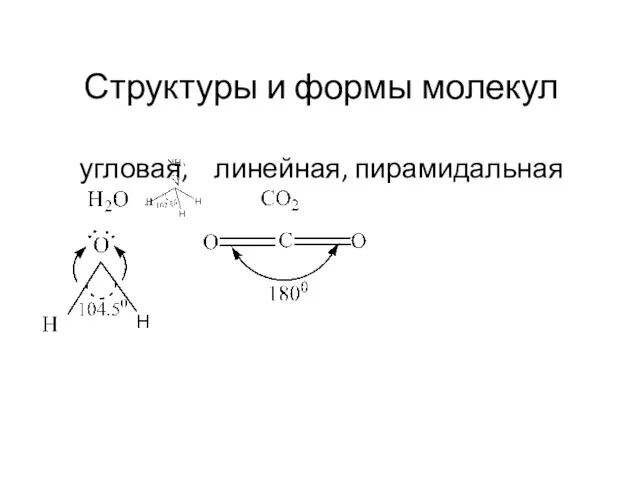
- 68. Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, наличием неподеленных электронных пар, так
- 69. Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на расстоянии l друг
- 70. Структуры и формы молекул угловая, линейная, пирамидальная
- 71. Типы химических связей Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной
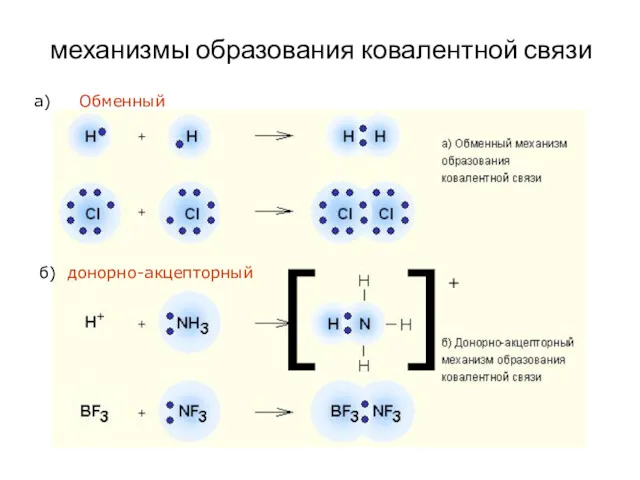
- 72. механизмы образования ковалентной связи а) Обменный б) донорно-акцепторный +
- 73. Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся
- 74. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка
- 75. Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов,
- 76. Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому
- 77. Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3.
- 78. Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи обусловлен дисперсионными силами (индуцированный диполь – индуцированный
- 79. Химическая связь в твердых телах Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и
- 80. Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл.= 801°C, а
- 81. В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью,
- 82. Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях
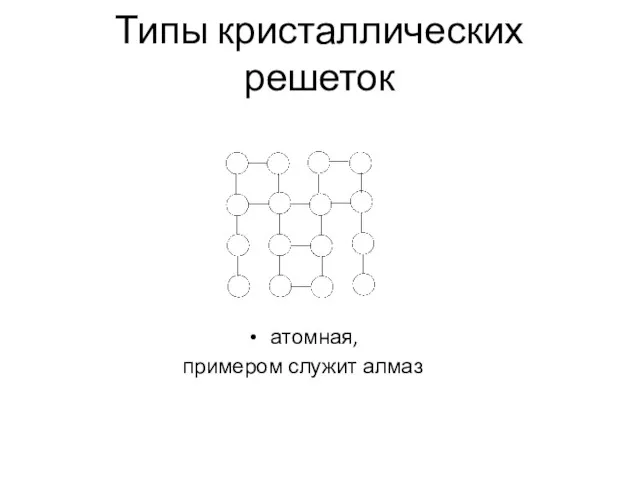
- 83. Типы кристаллических решеток атомная, примером служит алмаз
- 84. ионная примером служит поваренная соль
- 85. металлическая
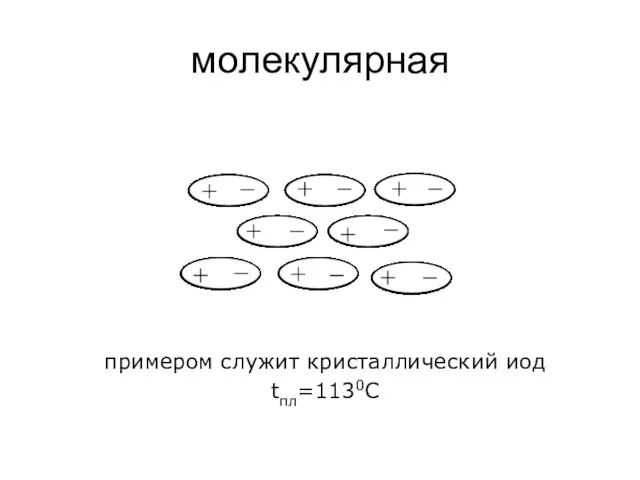
- 86. молекулярная примером служит кристаллический иод tпл=1130С
- 87. Кварц – кристаллическая форма оксида кремния
- 88. Метод валентных связей (МВС) основан на предположении, что химическая связь осуществляется одной или несколькими электронными парами,
- 89. Виды и кратность связи Направленность ковалентной химической связи В зависимости от направления перекрывания электронных облаков различают
- 90. σ – связь возникает при перекрывании орбиталей вдоль линии, соединяющей ядра взаимодействующих атомов. Схематическое изображение:
- 92. -связь возникает при перекрывании двух орбиталей, расположенных перпендикулярно линии, соединяющей ядра атомов. Она характеризуется двумя областями
- 93. Схематическое изображение:
- 94. Энергетически σ и π – связи неравноценны Еπ Разрыв π – связи происходит первой. π- связь
- 95. Свойства ковалентной связи Насыщаемость – это способность атома использовать все свои валентные возможности. Валентность – это
- 96. Направленность. Атомные орбитали направлены в пространстве, следовательно, и химические связи, возникающие при перекрывании атомных орбиталей, имеют
- 97. гибридизация Гибридизация АО – это смешивание и выравнивание АО, образующих σ-связи, по форме и энергии. Т.е,
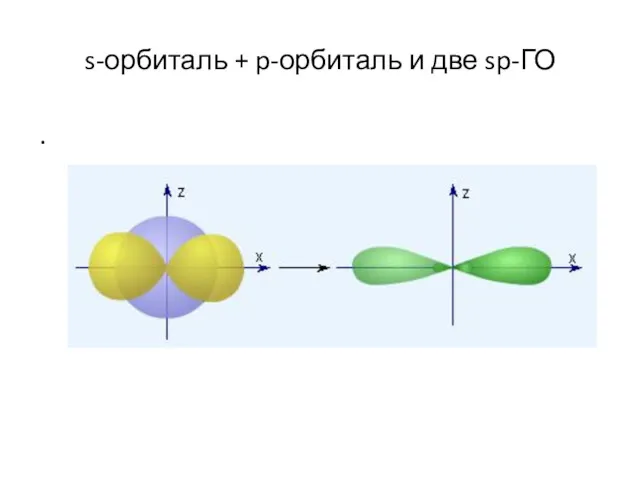
- 98. SP- гибридизация гибридныe орбитали (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО
- 99. s-орбиталь + p-орбиталь и две sp-ГО .
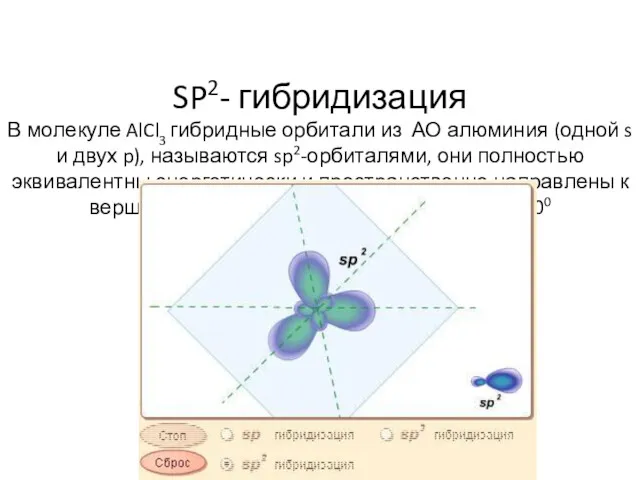
- 100. SP2- гибридизация В молекуле AlCl3 гибридные орбитали из АО алюминия (одной s и двух p), называются
- 101. Связи в молекуле бензола.
- 102. Основные положения теории гибридизации : Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали
- 103. Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или
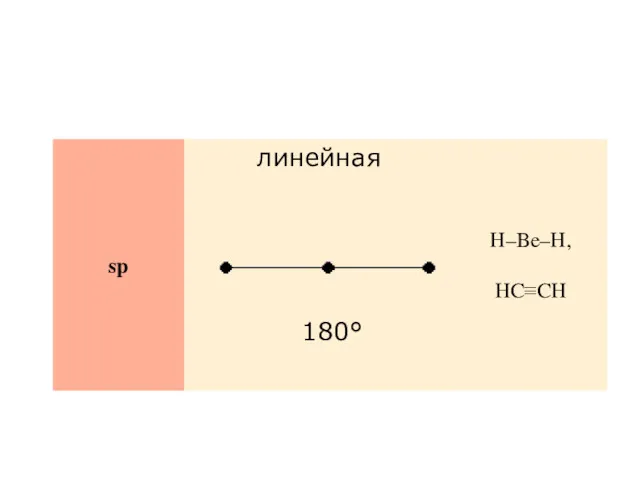
- 104. 180°
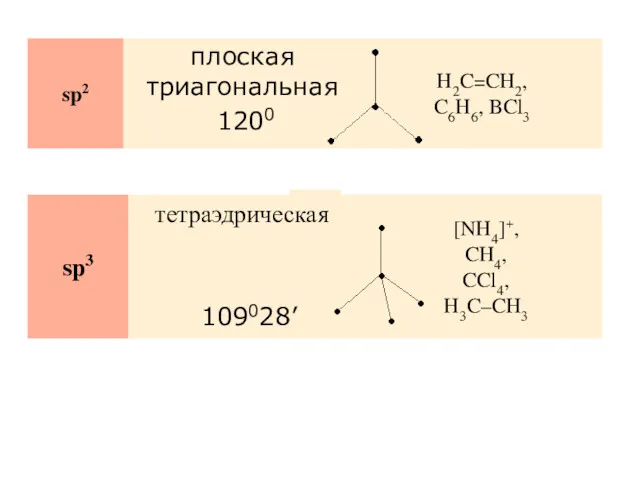
- 105. 120° 109°28'
- 106. 120°
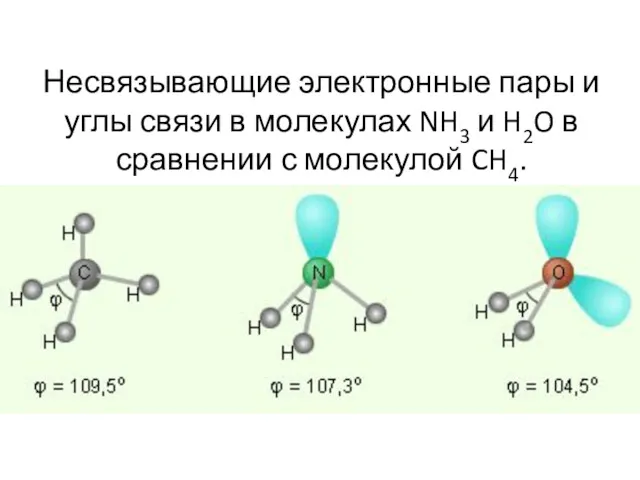
- 107. Pассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp3-ГО,
- 108. Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4.
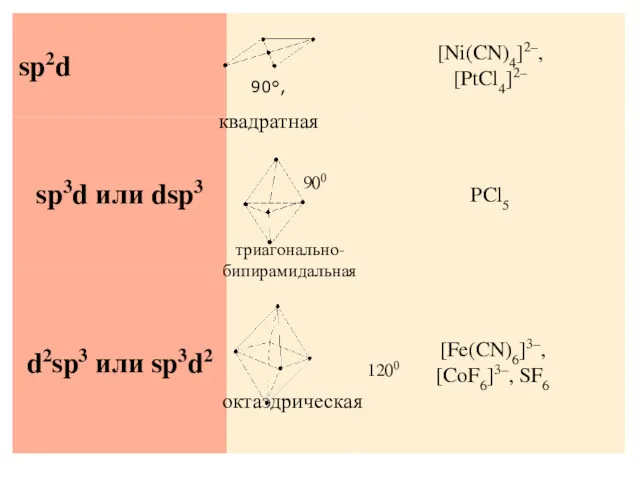
- 109. Метод Гиллеспи–Найхолма метод основан на том, что реальная геометрия молекулы определяется не только гибридизацией АО, но
- 111. Комплексные соединения Многие положительно заряженные ионы (Cu2+, Ag+) обладают способностью присоединять ионы противоположного знака (Сl–, СN–)
- 112. Примеры комплексных соединений: K2[Cu(CN)4], [Аg(NН3)2]Cl, [Ni(NH3)6]Cl2, K2[HgI4], [Cr(H2O)6]Cl3.
- 113. Центральное положение в комплексном соединении занимает ион металла – комплексообразователь, или центральный ион. Вокруг центрального иона
- 114. а – [CoCl2(H2O)4]•2H2O две молекулы H2O, находящиеся во внешней координационной сфере, не показаны; б – CoCl2•2H2O
- 115. При наличии у атомов одной из молекул свободной орбитали, а у атомов другой молекулы - электронной
- 116. лиганды являются донорами электронов . Например, NН3, Н2О, NO - нейтральные полярные молекулы, или анионы (Сl–,
- 117. Заряд комплексного иона может быть: а) положительным: [Cu (NH3)4]2+Cl2 – координирующее число=4 б) отрицательным: K3[Fe (CN)6]3-
- 119. Скачать презентацию






























































































![Примеры комплексных соединений: K2[Cu(CN)4], [Аg(NН3)2]Cl, [Ni(NH3)6]Cl2, K2[HgI4], [Cr(H2O)6]Cl3.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/152672/slide-111.jpg)

![а – [CoCl2(H2O)4]•2H2O две молекулы H2O, находящиеся во внешней координационной](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/152672/slide-113.jpg)


![Заряд комплексного иона может быть: а) положительным: [Cu (NH3)4]2+Cl2 –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/152672/slide-116.jpg)
 Липиды
Липиды Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Глицерин. Свойства и применение
Глицерин. Свойства и применение Крекинг нефти
Крекинг нефти Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Химическая связь
Химическая связь Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Вода – это жизнь!
Вода – это жизнь! The production of stable isotopes
The production of stable isotopes Молибден. Нахождение в природе
Молибден. Нахождение в природе Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Аммиак
Аммиак Что нас объединяет?
Что нас объединяет? Таблицы. Определение характера оксидов
Таблицы. Определение характера оксидов Основи
Основи Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Ионы и ионная химическая связь
Ионы и ионная химическая связь Металлы главных подгрупп
Металлы главных подгрупп Производство извести
Производство извести Металлы. Свойства металлов
Металлы. Свойства металлов Химия. D-элементтер
Химия. D-элементтер Методы определения вязкости жидкости
Методы определения вязкости жидкости Химический состав клетки
Химический состав клетки Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium)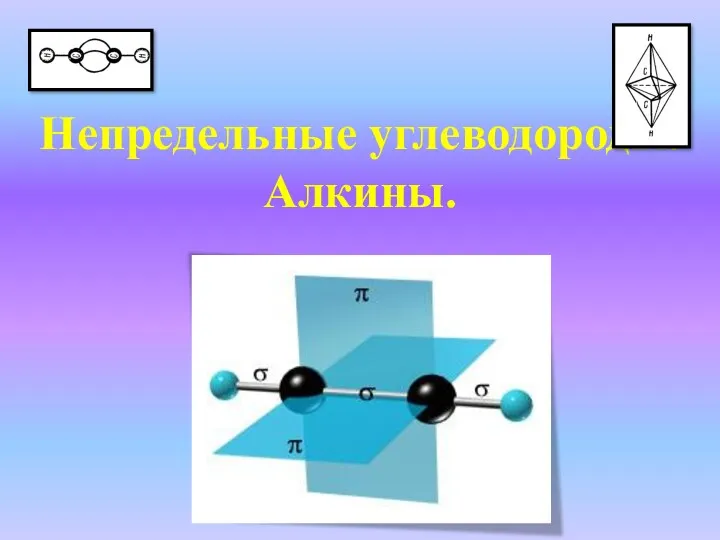 Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины