1
С0 – 4e → С+4 4
HNO3 + P → H3PO4 + NO2 + H2O
N+5 + 1e → N+4
P0 – 5e → P+5
5
Запишем уравнение реакции и расставим коэффициенты методом электронного баланса.
HNO3 (за счет N+5) – окислитель, пр. восстановления
C – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
Посмотрим опыт 1 Взаимодействие
азотной кислоты с углеродом
Посмотрим опыт 2 Взаимодействие
азотной кислоты с фосфором
Запишем уравнение реакции и расставим коэффициенты методом электронного баланса.
4
4
1
4
2
4
1
5
5
1
5
5
 Подгруппа углерода
Подгруппа углерода Каталитический крекинг
Каталитический крекинг Драгоценные камни
Драгоценные камни Коррозия металлов
Коррозия металлов Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Мыло
Мыло Бензол. Чикишев С. (2)
Бензол. Чикишев С. (2) Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Топлива и их свойства
Топлива и их свойства Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Водород. Химический знак - H
Водород. Химический знак - H Типы химических реакций. Опыты
Типы химических реакций. Опыты Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов Роль металлов в нашей жизни
Роль металлов в нашей жизни Химическая связь
Химическая связь Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном ЕГЭ 2017. Подготовка к вопросу № 26
ЕГЭ 2017. Подготовка к вопросу № 26 ФОСФОР и его соединения
ФОСФОР и его соединения Группы сходных химических элементов
Группы сходных химических элементов Инертные газы
Инертные газы Строение электронных оболочек атомов
Строение электронных оболочек атомов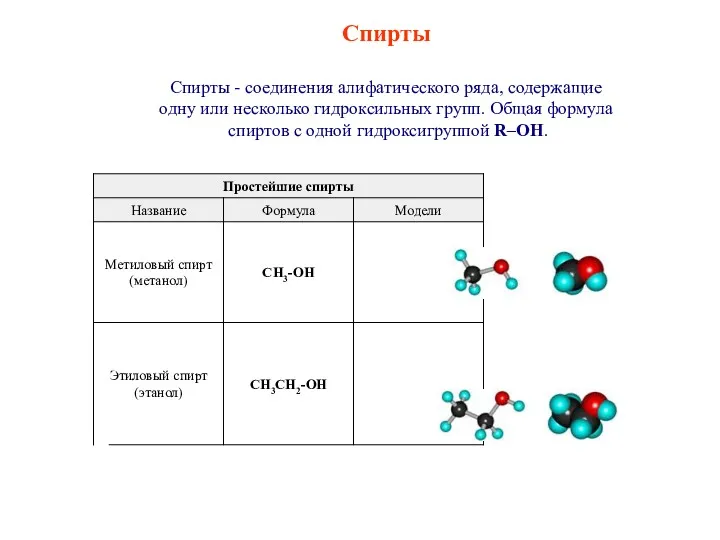 Спирты. Классификация спиртов
Спирты. Классификация спиртов Нефелометрический анализ
Нефелометрический анализ Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Типы химических реакций
Типы химических реакций Биохимия эритроцита
Биохимия эритроцита Марганец
Марганец