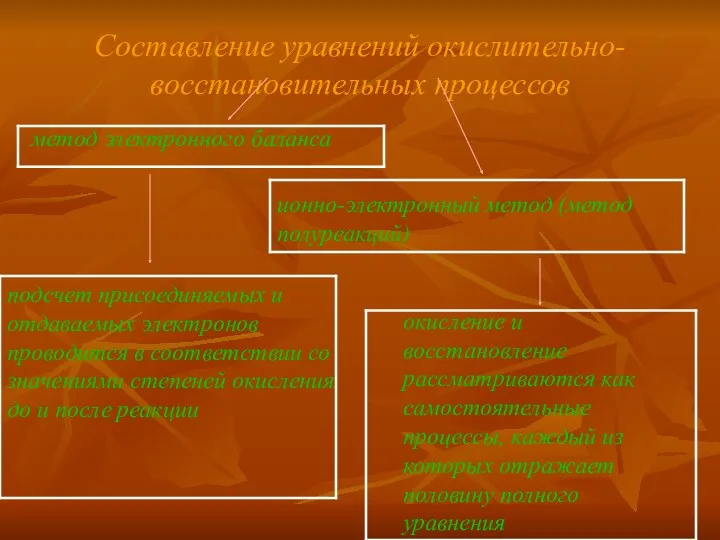
Найденные коэффициенты подставляют в уравнение реакции перед соответствующими формулами веществ в
левой и правой частях.
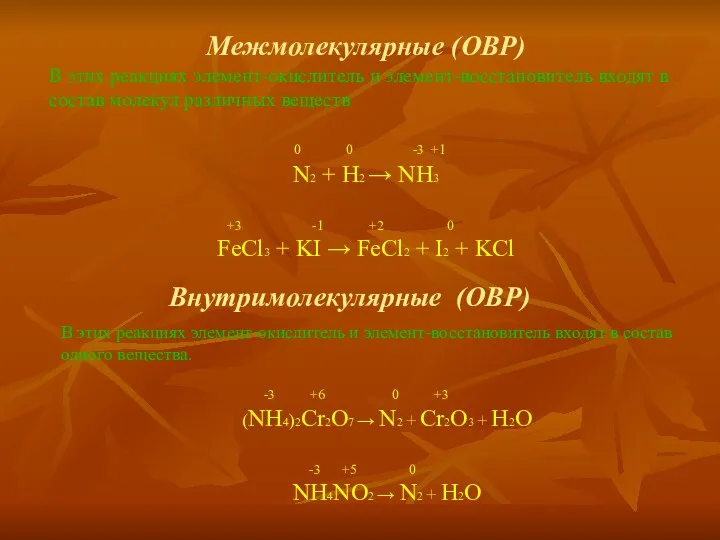
Для серной кислоты (в левой части), сульфата калия и воды (в правой части) подсчет коэффициентов проводят сравнением числа атомов или ионов в левой и правой частях схемы. Исходя из электронного баланса, переносим в схему полученные коэффициенты перед соответствующими компонентами
2KMgO4 + 10KI + H2 SO4 K2 SO4 + 2MgSO4 + 5I2 + H2O
В результате запишем суммарное уравнение:
2KMgO4 + 10KI + 8H2 SO4 = 2MgSO4 + 5I2 + 6K2 SO4 + 8H2O
В левой части число ионов соответствует 12, а в правой – 2. поэтому в правой части перед H2 SO4 записывается коэффициент 6. в правой части число сульфат-ионов равно 8, следовательно, в реакцию должны вступить 8 моль серной кислоты, поэтому в левой части для серной кислоты подставляем коэффициент 8. так как число водородных атомов в левой части теперь равно 16, то для воды соответствует коэффициент 8.


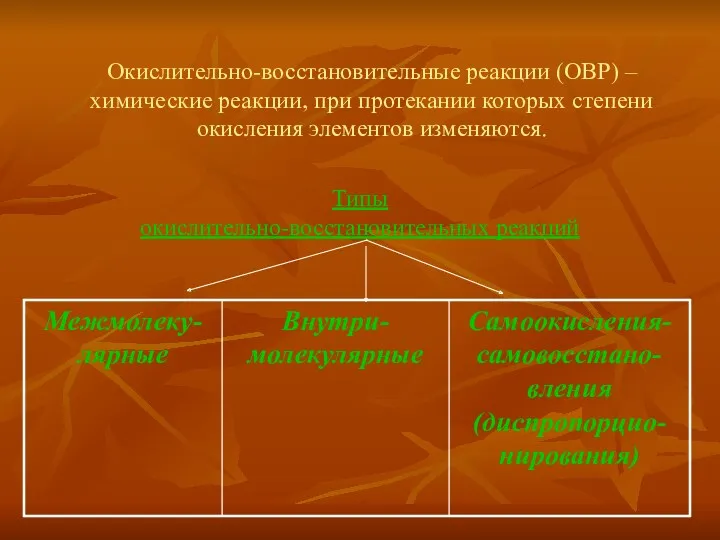



 Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Одноатомные и многоатомные спирты
Одноатомные и многоатомные спирты Практическая работа по разделению смесей
Практическая работа по разделению смесей Химия пәні. Заттар және олардың қасиеттері
Химия пәні. Заттар және олардың қасиеттері Жиры и масла
Жиры и масла Непредельные углеводороды: алкены, олефины
Непредельные углеводороды: алкены, олефины Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Электрохимические методы анализа
Электрохимические методы анализа Химическая связь
Химическая связь Введение в кристаллографию
Введение в кристаллографию Фосфор и его соединения
Фосфор и его соединения Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Кислород
Кислород Растворы. Часть 2
Растворы. Часть 2 Общие способы получения металлов
Общие способы получения металлов Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений Основные сведения о строении атома
Основные сведения о строении атома Фенол қосылыстары
Фенол қосылыстары Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Ядерное топливо
Ядерное топливо Альдегиды и кетоны
Альдегиды и кетоны Особенности строения твердых тел
Особенности строения твердых тел Циклические углеводороды
Циклические углеводороды D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы