Содержание
- 2. Азот «открывали» несколько раз и разные люди. Его называли по-разному, приписывая едва ли не мистические свойства
- 3. Символ элемента: N. Порядковый номер: 7. Положение в таблице: 2-й период, группа - VA Химический элемент
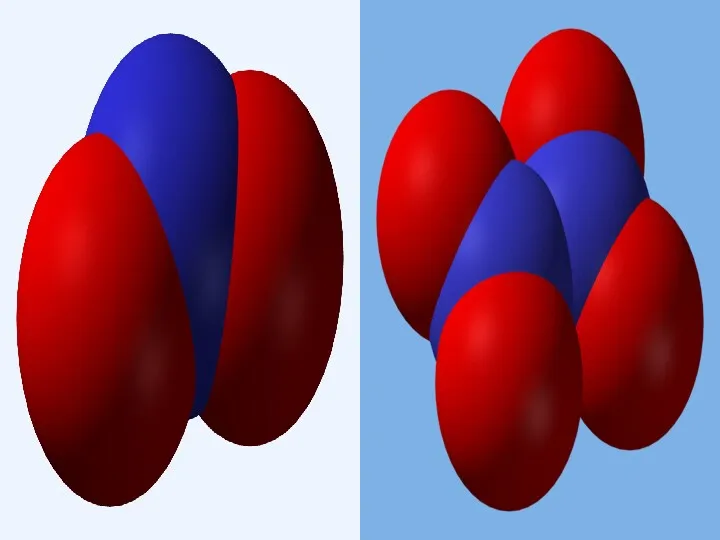
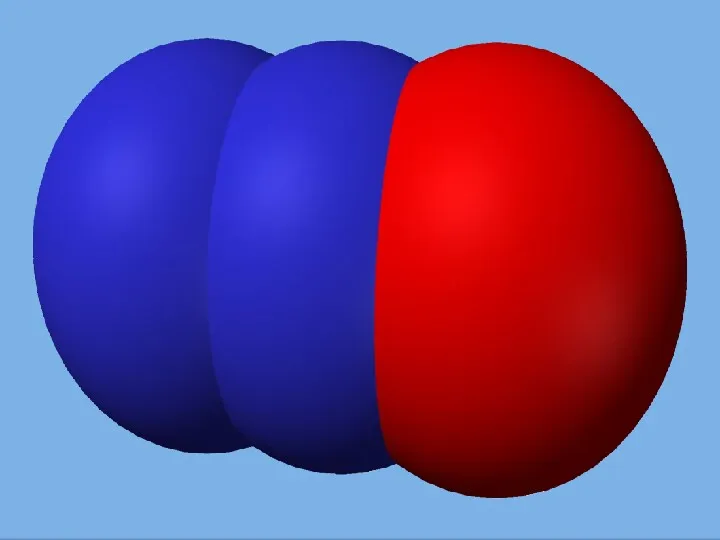
- 4. Азот - нетоксичный газ, без цвета, без вкуса, без запаха, слабый проводник тепла и электричества.
- 5. Испаряясь, азот охлаждает очаг возгорания и вытесняет кислород, необходимый для горения, поэтому пожар прекращается. Так как
- 6. Жидкий азот способен при определенной температуре и под воздействием соответствующего давления преобразовываться в кристаллическое твердое вещество.
- 7. В лаборатории азот легко может быть получен при нагревании концентрированного нитрита аммония: NH4NO2= N2 + 2H2O.
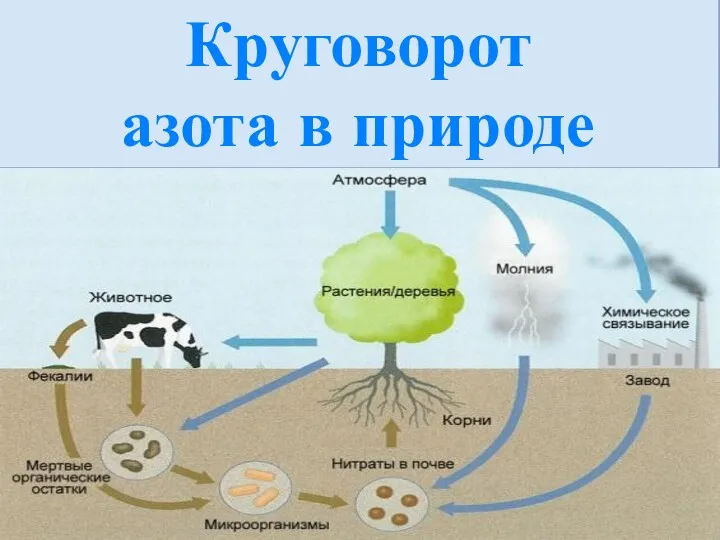
- 9. Круговорот азота в природе
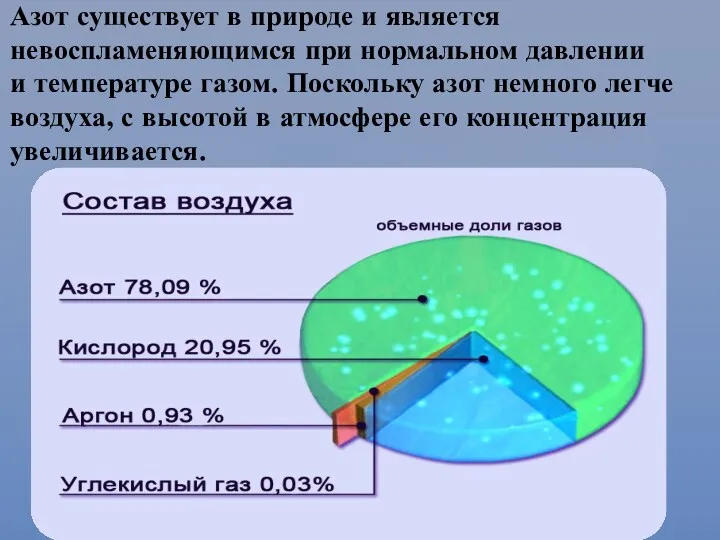
- 10. Азот существует в природе и является невоспламеняющимся при нормальном давлении и температуре газом. Поскольку азот немного
- 11. Нитраты являются необходимой частью азотного питания растений, без которых невозможны сложные биологические процессы синтеза белка. Нитраты
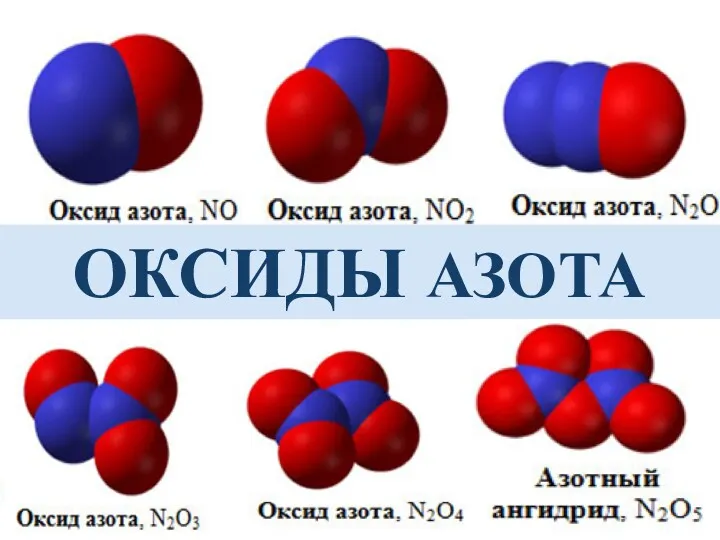
- 12. ОКСИДЫ АЗОТА
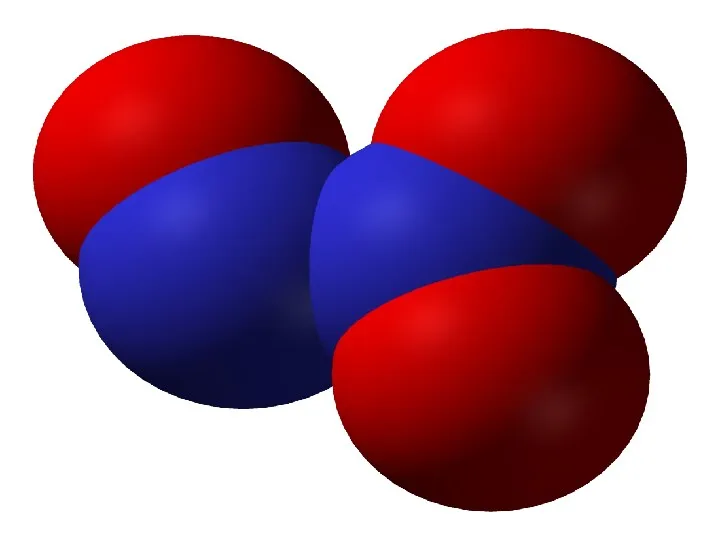
- 14. Оксид азота(II) - NO Физические свойства. Бесцветный газ, при низких температурах - голубая жидкость. В твердом
- 15. Химические свойства. Очень реакционноспособное вещество. Может проявлять и окислительные и восстановительные свойства. 1.При обычной температуре окисляется
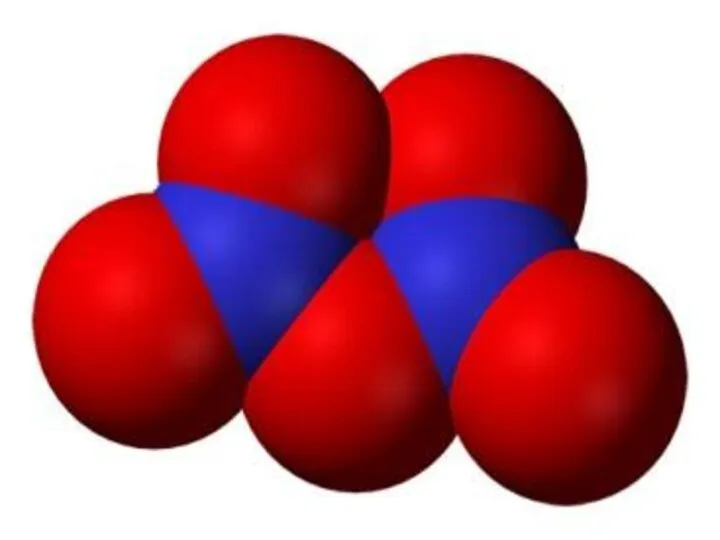
- 17. Физические свойства. Это красно-бурый газ с резким запахом. При низких температурах из-за наличия у атомов азота
- 18. Химические свойства. Взаимодействие с водой: 2NO2 + H2O(хол) = HNO3 + HNO2 3NO2 + H2O(гор) =
- 20. Физические свойства. Бесцветный газ с тошнотворным cладковатым запахом, обладает анестезирующим действием. Растворим в воде. t0(плав) =
- 22. Физические свойства. Это синяя жидкость при обычных условиях. В твердом состоянии - белое или голубоватое вещество.
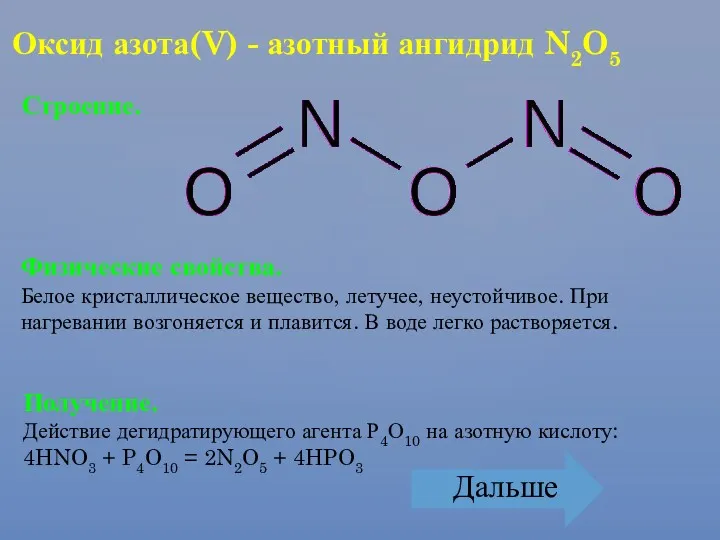
- 24. Оксид азота(V) - азотный ангидрид N2O5 Строение. Физические свойства. Белое кристаллическое вещество, летучее, неустойчивое. При нагревании
- 25. Химические свойства. Оксид азота(V) - кислотный оксид. 1. При растворении в воде образует азотную кислоту: N2O5
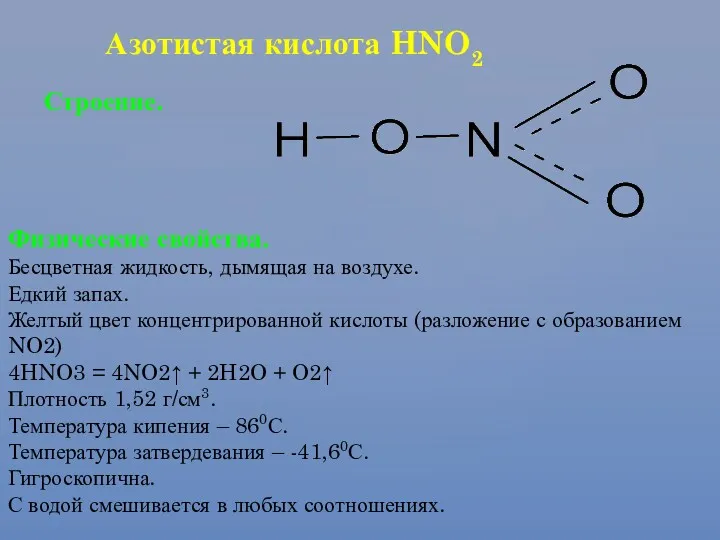
- 26. Азотистая кислота HNO2 Строение. Физические свойства. Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной
- 27. Химические свойства. Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциациация в водном растворе: HNO3
- 28. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 29. С овощами и фруктами в организм человека поступают до 70 – 80% нитратов. Сами по себе
- 30. Пути попадания нитратов в организм человека: - Основная масса нитратов попадает в организм человека с консервированными
- 32. Скачать презентацию



















 Жидкие вещества
Жидкие вещества Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Жидкокристаллические индикаторы
Жидкокристаллические индикаторы Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Орбитали и связи
Орбитали и связи Ароматические кислоты и их соли
Ароматические кислоты и их соли Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Спирты. Классификация спиртов
Спирты. Классификация спиртов Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Откуда берутся кристаллы
Откуда берутся кристаллы Основной государственный экзамен Химия 2021. Задание 5
Основной государственный экзамен Химия 2021. Задание 5 Текстуры и структуры метаморфических горных пород
Текстуры и структуры метаморфических горных пород Азот и его соединения
Азот и его соединения Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау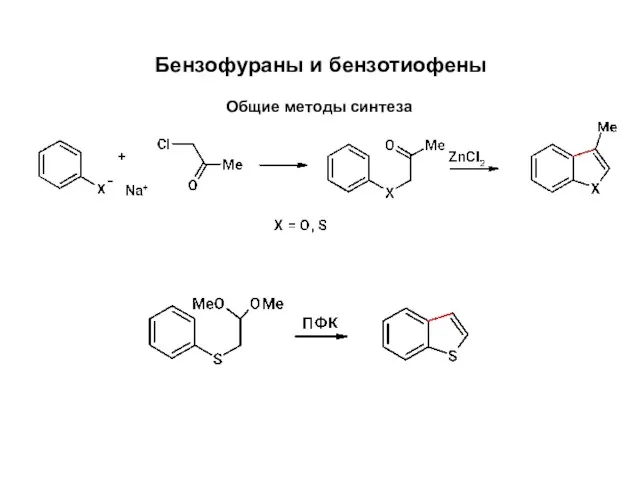 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза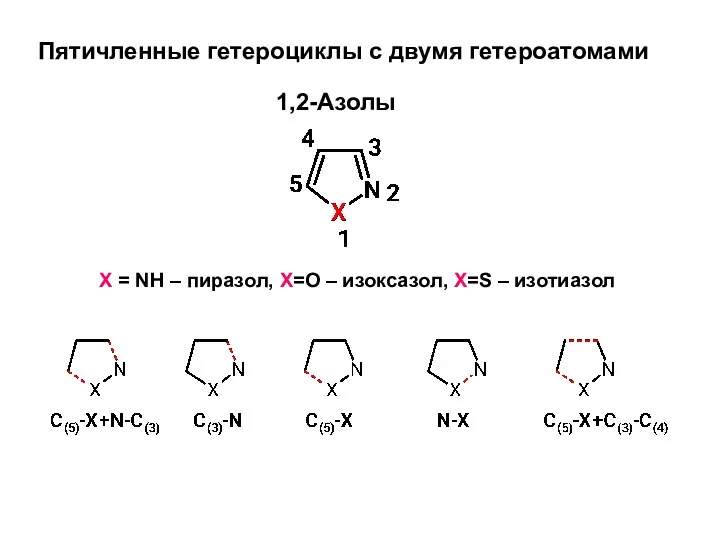 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Теория электролитической диссоциации
Теория электролитической диссоциации Классификация и свойства кислот
Классификация и свойства кислот Теории происхождения нефти
Теории происхождения нефти Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Художественная обработка металла
Художественная обработка металла