Содержание
- 2. Простые вещества Металлы Na, Fe, Al, Zn… Неметаллы O2, H2, Cl2, S, P, C…
- 3. Сложные вещества Оксиды Соли Кислоты Основания
- 4. ОКСИДЫ
- 5. Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
- 6. Оксиды Степень окисления кислорода в оксидах равна – 2. Один из способов получения оксидов – реакция
- 7. Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и
- 8. H2O — оксид водорода, или вода. На Земле вода встречается во всех трёх агрегатных состояниях —
- 9. CO2 — оксид углерода(IV), двуокись углерода или углекислый газ. Как вы уже знаете, углекислый газ нужен
- 10. Оксид углерода (II) СO Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения
- 11. Оксид железа (III) Fe2O3 В природе этот оксид встречается в виде минерала гематита. Он составляет основу
- 12. В природе встречается в виде кварцевого песка, кварца, горного хрусталя. Оксид кремния (IV) SiO2 Горный хрусталь
- 13. Классификация оксидов Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают
- 15. Основные оксиды. Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду. Основные оксиды образуются
- 16. Кислотные оксиды. Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду. Кислотные оксиды образуют
- 17. Амфотерные оксиды. Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
- 18. Несолеобразующие оксиды. Несолеобразующие оксиды — оксиды, не реагирующие с кислотами или основаниями при обычных условиях. К
- 19. Номенклатура оксидов В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического
- 20. Химические свойства оксидов .
- 22. Скачать презентацию



















 Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms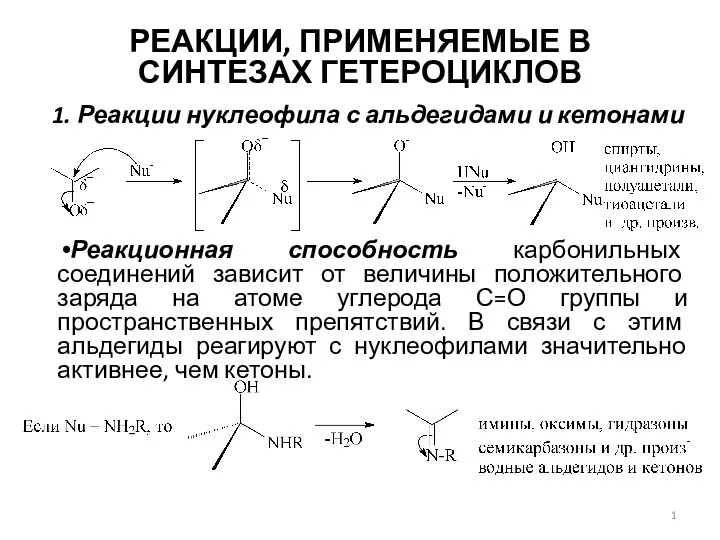 Реакции, применяемые в синтезах гетероциклов
Реакции, применяемые в синтезах гетероциклов Неметаллы. Азот
Неметаллы. Азот Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики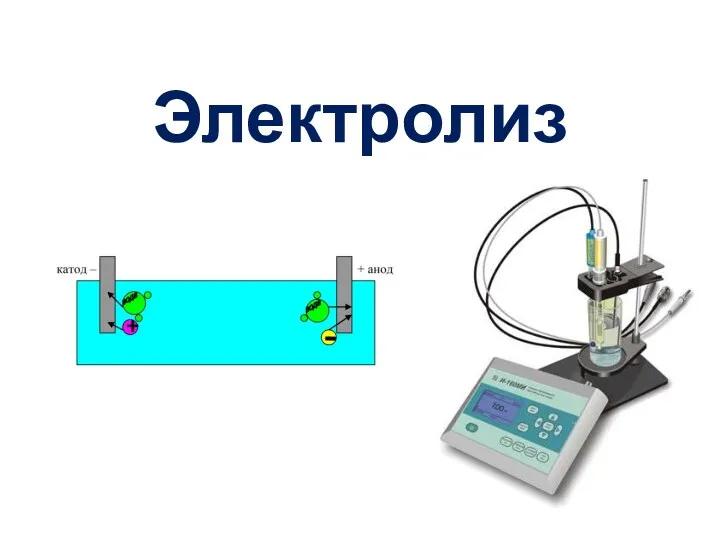 Электролиз – ОВ процесс
Электролиз – ОВ процесс Нитраттарды қолдану
Нитраттарды қолдану Углеводы. 10 класс
Углеводы. 10 класс Токсикология пестицидов
Токсикология пестицидов Некоторые d-элементы
Некоторые d-элементы Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Элемент цинк
Элемент цинк Кто хочет стать химиком
Кто хочет стать химиком Элементы IV А - группы
Элементы IV А - группы Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов
Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов Количественный анализ. Титриметрический анализ
Количественный анализ. Титриметрический анализ Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Водород - топливо будущего
Водород - топливо будущего Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Углерод
Углерод Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Кевлар. Структура кевлара
Кевлар. Структура кевлара Концентраційні межі поширення полум'я. Лекція 7
Концентраційні межі поширення полум'я. Лекція 7