Содержание
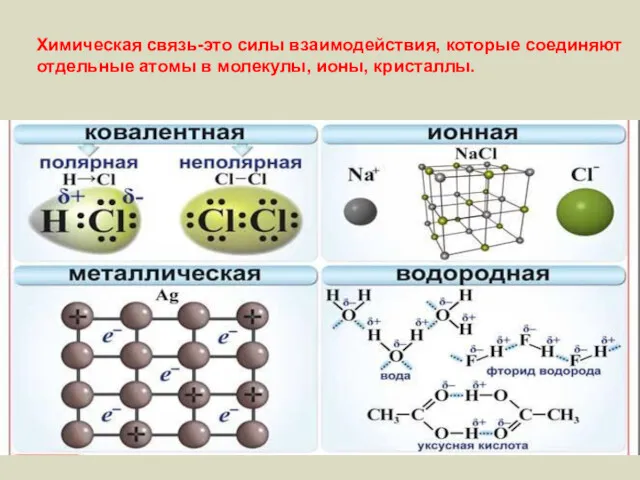
- 2. Химическая связь-это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
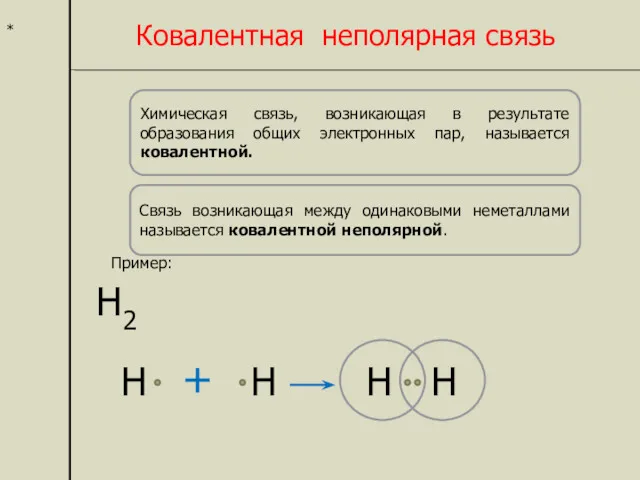
- 3. * Ковалентная неполярная связь Химическая связь, возникающая в результате образования общих электронных пар, называется ковалентной. Связь
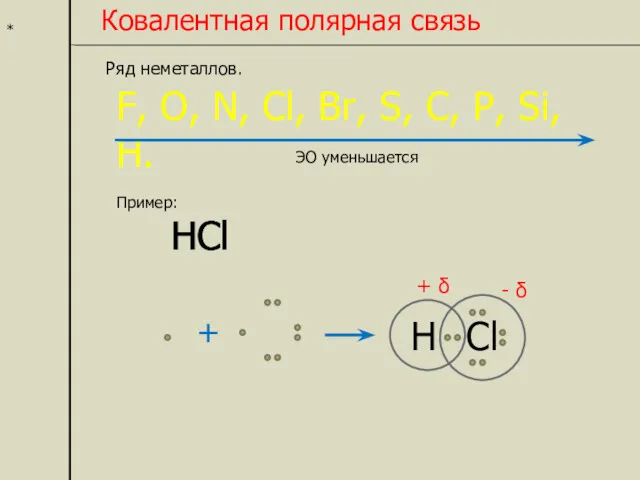
- 4. * Ковалентная полярная связь Ряд неметаллов. F, O, N, Cl, Br, S, C, P, Si, H.
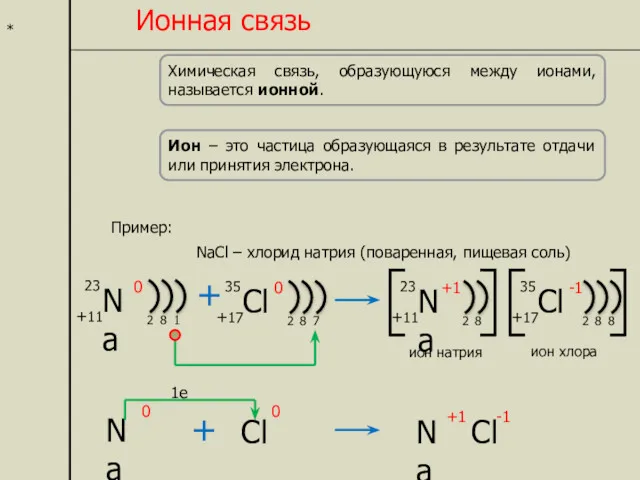
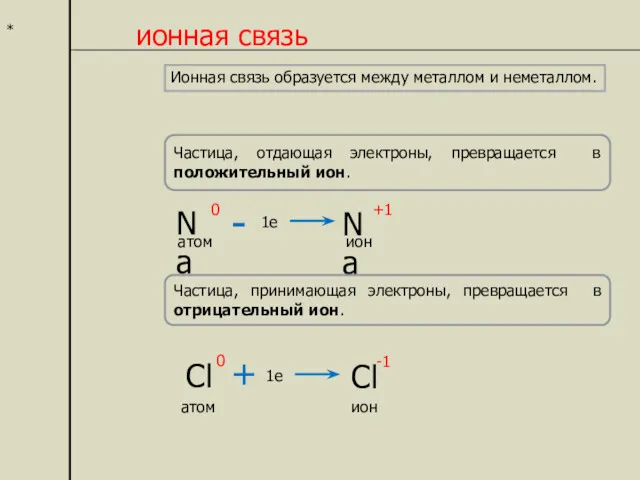
- 5. * Ионная связь Химическая связь, образующуюся между ионами, называется ионной. Ион – это частица образующаяся в
- 6. * ионная связь Частица, отдающая электроны, превращается в положительный ион. Частица, принимающая электроны, превращается в отрицательный
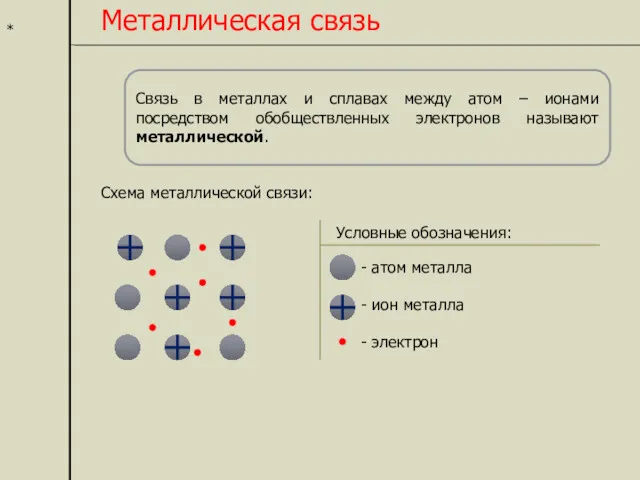
- 7. * Металлическая связь Связь в металлах и сплавах между атом – ионами посредством обобществленных электронов называют
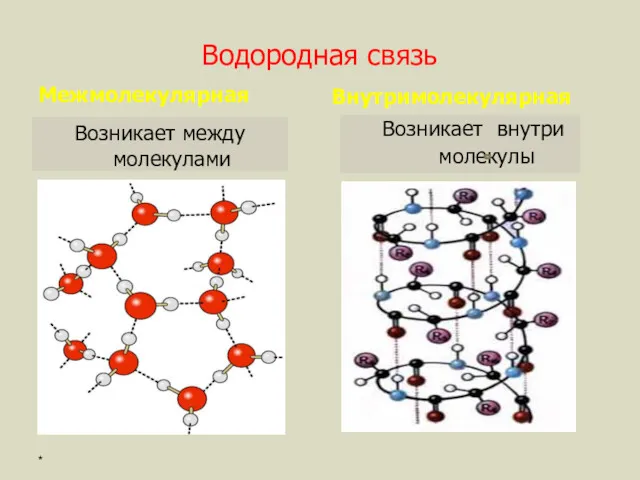
- 8. Водородная связь Межмолекулярная Возникает между молекулами Внутримолекулярная Возникает внутри молекулы *
- 9. Сравнение различных видов связи Сходство: любой вид связи образуется за счет перехода электронов Различие: способ образования
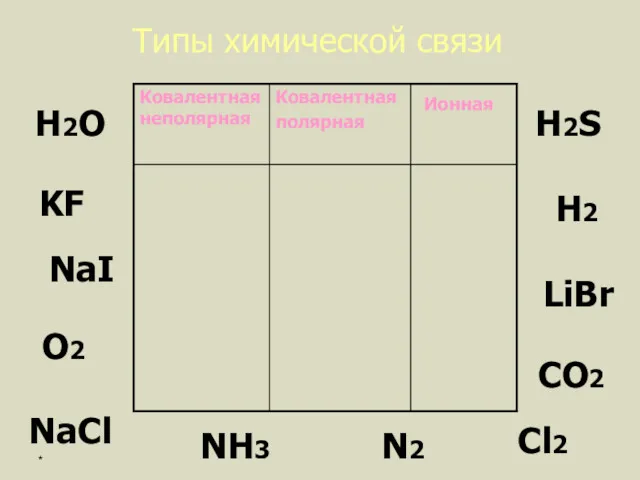
- 10. Типы химической связи KF H2 H2O Н2S О2 NH3 N2 LiBr NaCl CO2 Cl2 NaI *
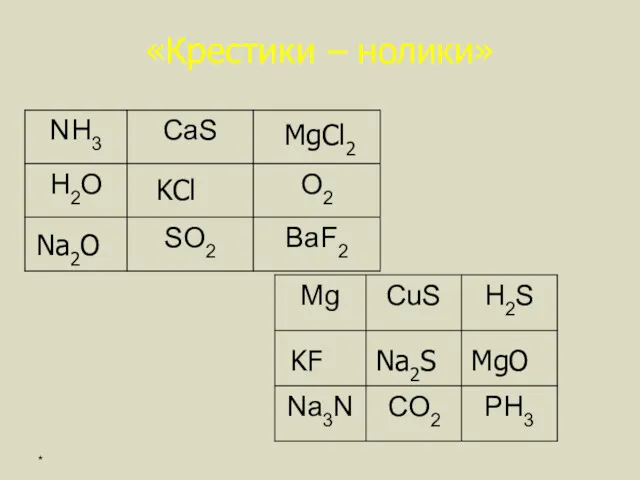
- 11. «Крестики – нолики» Na2O MgCl2 KCl KF Na2S MgO *
- 12. «Третий лишний» Na Mg H2 O2 CaO AlJ3 H2S HF Н2 HCl CS2 H2 *
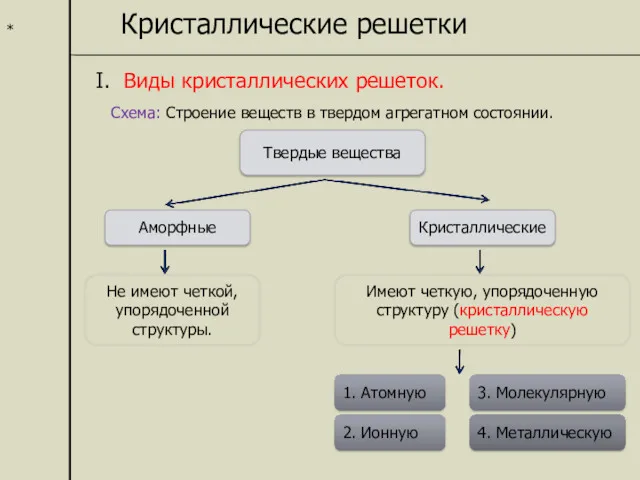
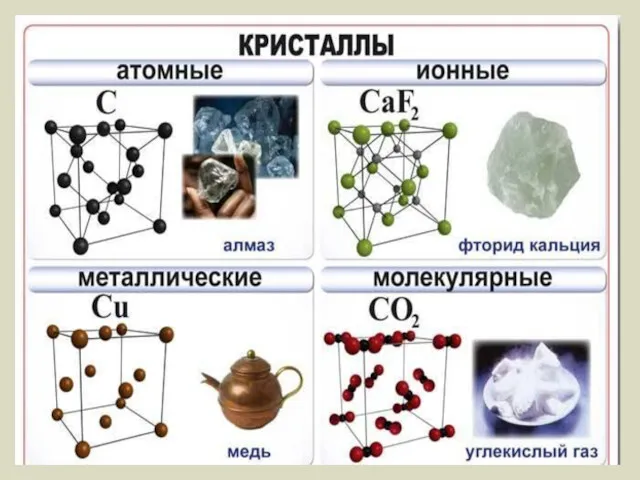
- 13. * Кристаллические решетки I. Виды кристаллических решеток. Схема: Строение веществ в твердом агрегатном состоянии. Твердые вещества
- 14. *
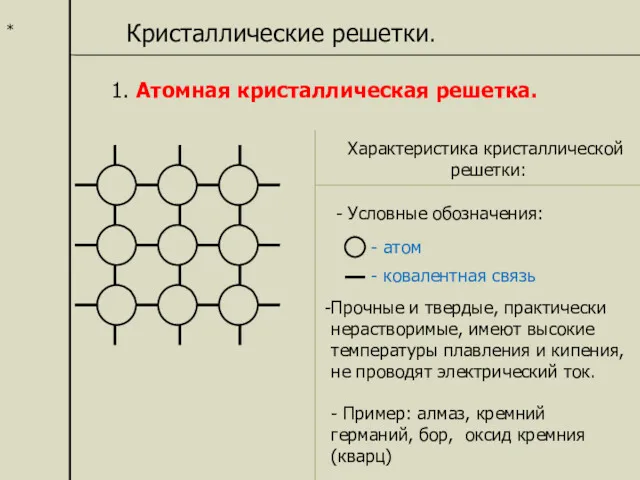
- 15. * Кристаллические решетки. 1. Атомная кристаллическая решетка. Характеристика кристаллической решетки: - атом - ковалентная связь Прочные
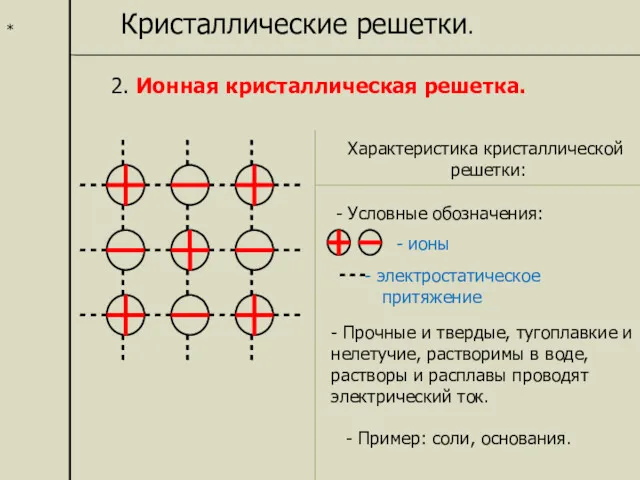
- 16. * Кристаллические решетки. 2. Ионная кристаллическая решетка. Характеристика кристаллической решетки: - ионы электростатическое притяжение - Прочные
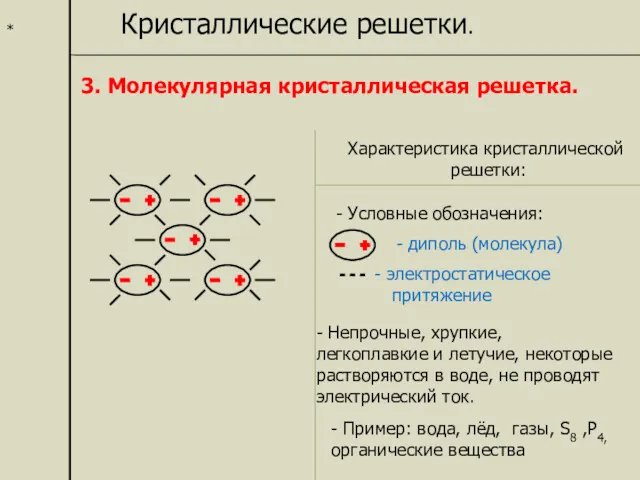
- 17. * Кристаллические решетки. 3. Молекулярная кристаллическая решетка. Характеристика кристаллической решетки: - диполь (молекула) электростатическое притяжение -
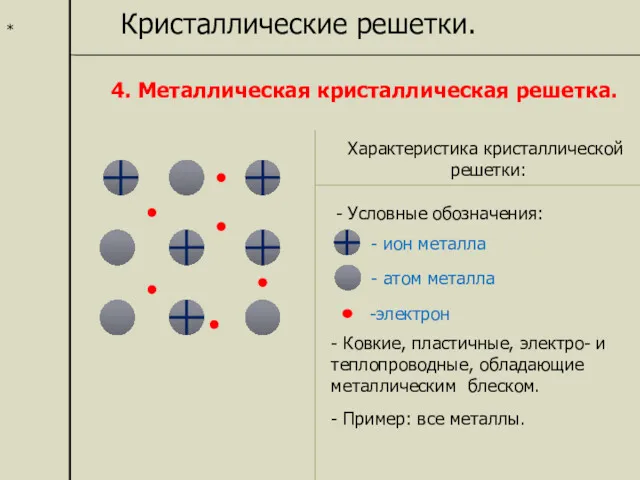
- 18. * Кристаллические решетки. 4. Металлическая кристаллическая решетка. Характеристика кристаллической решетки: - ион металла электрон - Ковкие,
- 19. Установите соответствие Между названием вещества и видом химической связи в нем Между названием вещества и типом
- 21. Скачать презентацию



 Галогены. Нахождение в природе
Галогены. Нахождение в природе Биохимия
Биохимия Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Аммиак
Аммиак Реакционные аппараты
Реакционные аппараты Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Концентраційні межі поширення полум'я. Лекція 7
Концентраційні межі поширення полум'я. Лекція 7 Начала химической термодинамики
Начала химической термодинамики The halogens
The halogens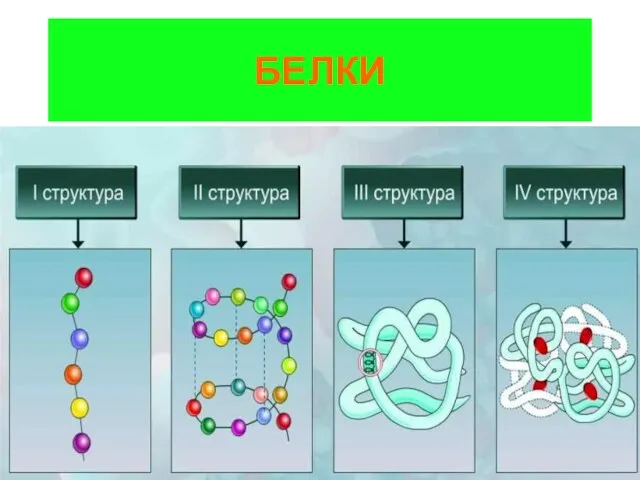 Белки. Строение
Белки. Строение Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Кисень та хімічні властивості кисню. 7 клас
Кисень та хімічні властивості кисню. 7 клас Непредельные углеводороды. Алкены (этиленовые углеводороды)
Непредельные углеводороды. Алкены (этиленовые углеводороды) Классификация дисперсных систем
Классификация дисперсных систем Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Кристаллические и аморфные тела
Кристаллические и аморфные тела Получение и применение альдегидов
Получение и применение альдегидов Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Основные классы неорганических соединений
Основные классы неорганических соединений Строение атома. Химия. 11 класс
Строение атома. Химия. 11 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Полимеры. Структура и свойства
Полимеры. Структура и свойства Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Предмет органической химии. Теория химического строения органических веществ
Предмет органической химии. Теория химического строения органических веществ Спирт µндіру технологиясы
Спирт µндіру технологиясы Азот
Азот Реакции ионного обмена
Реакции ионного обмена Строение и свойства циклоалканов
Строение и свойства циклоалканов