Содержание
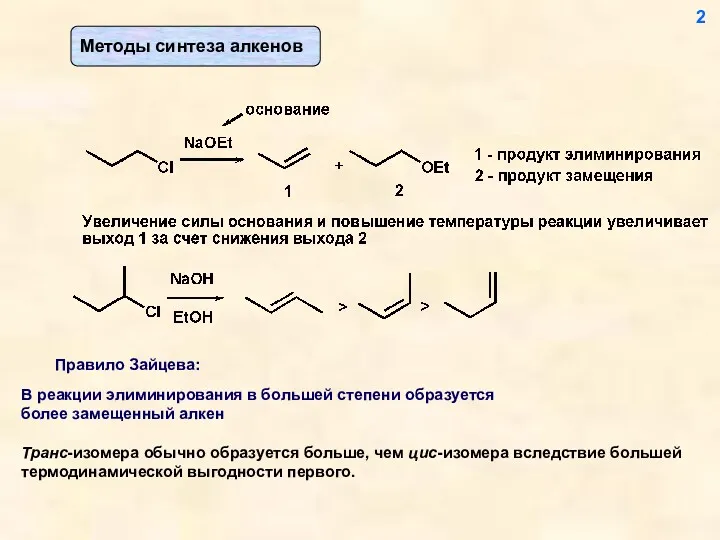
- 2. Транс-изомера обычно образуется больше, чем цис-изомера вследствие большей термодинамической выгодности первого. 2
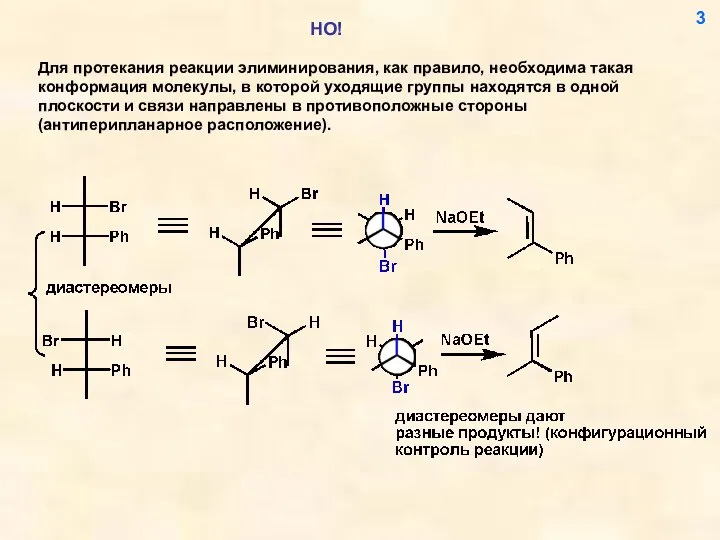
- 3. 3
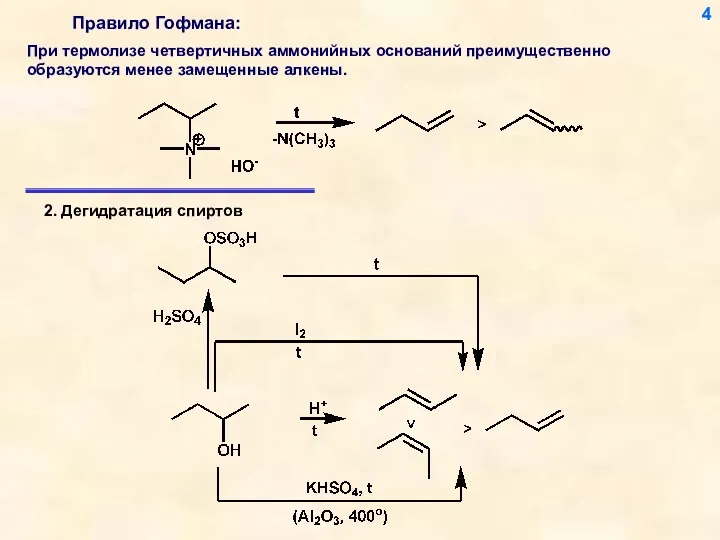
- 4. 4
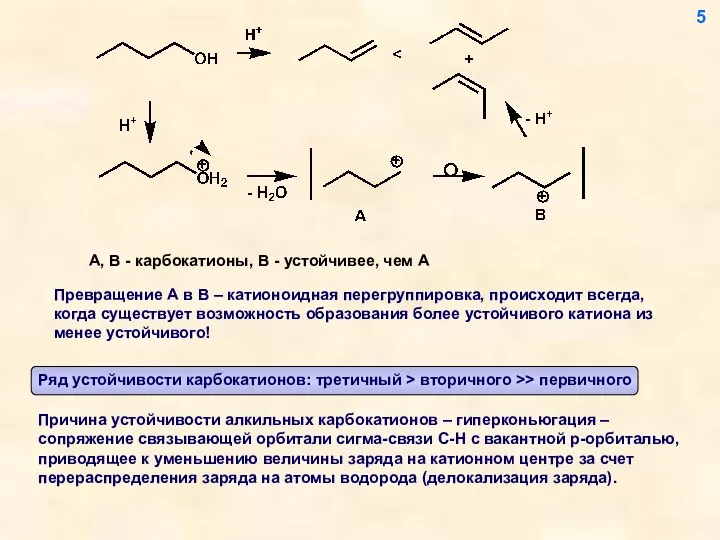
- 5. A, B - карбокатионы, В - устойчивее, чем А Превращение А в В – катионоидная перегруппировка,
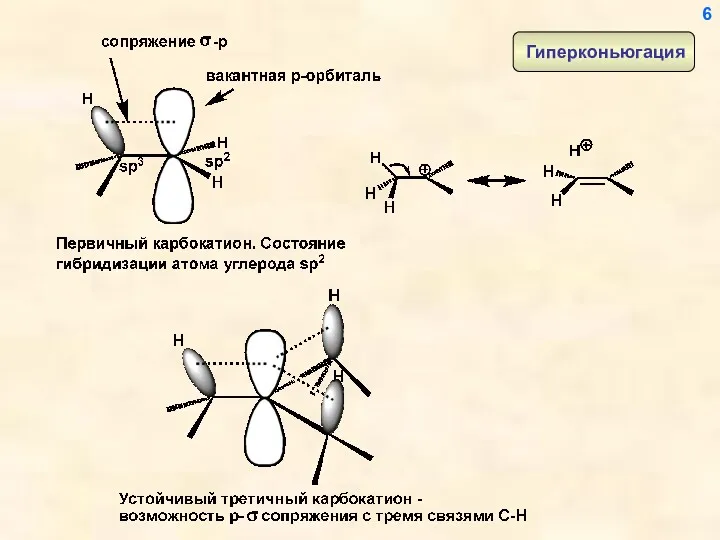
- 6. 6
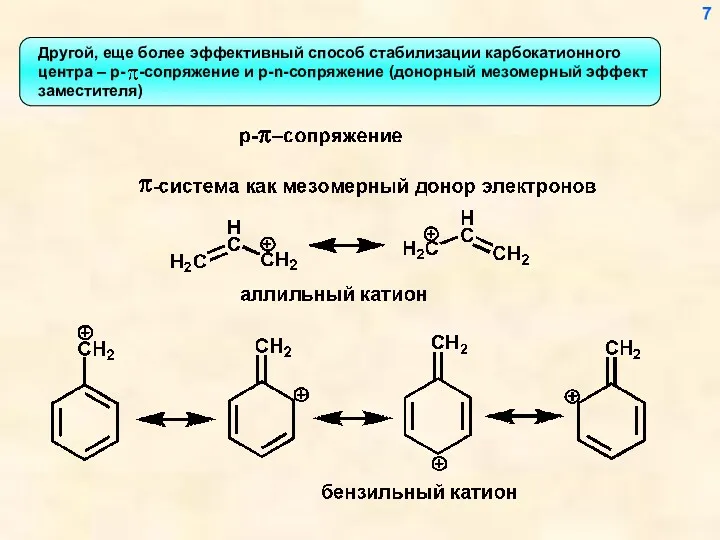
- 7. Другой, еще более эффективный способ стабилизации карбокатионного центра – р- -сопряжение и р-n-сопряжение (донорный мезомерный эффект
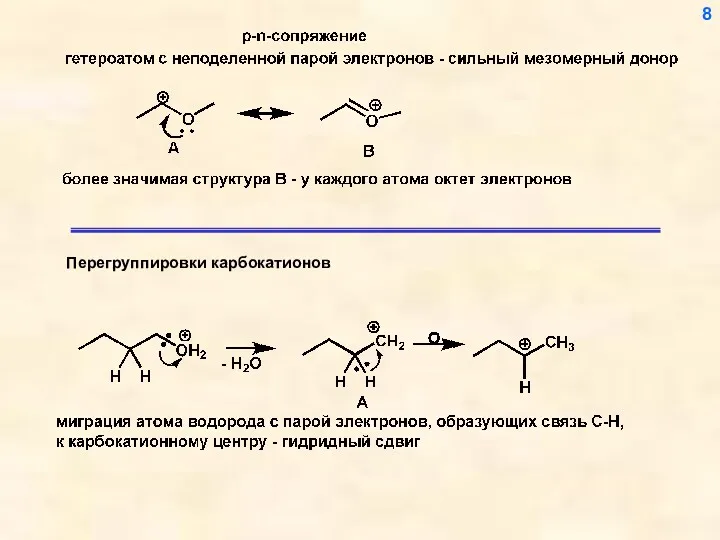
- 8. 8
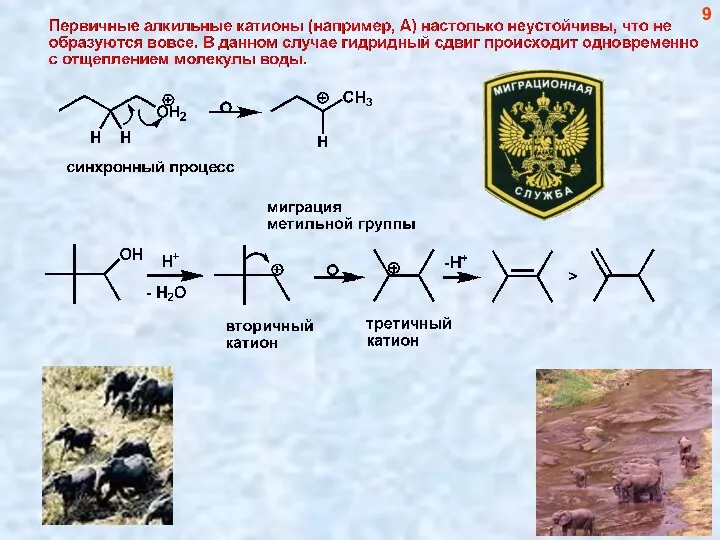
- 9. 9
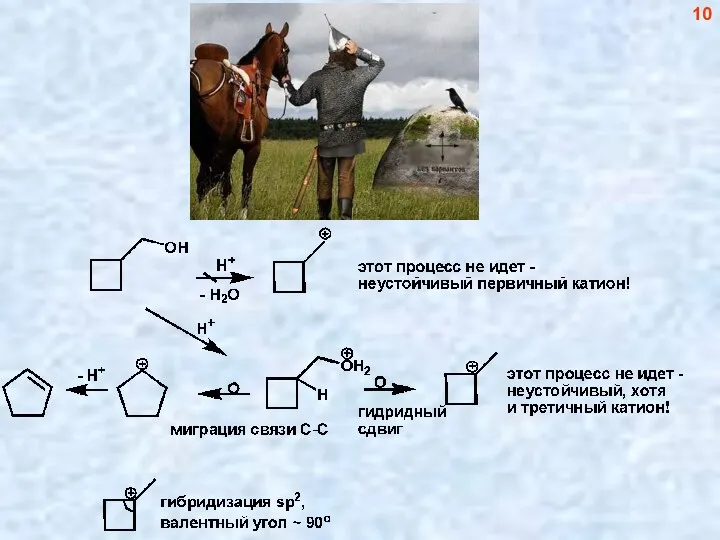
- 10. 10
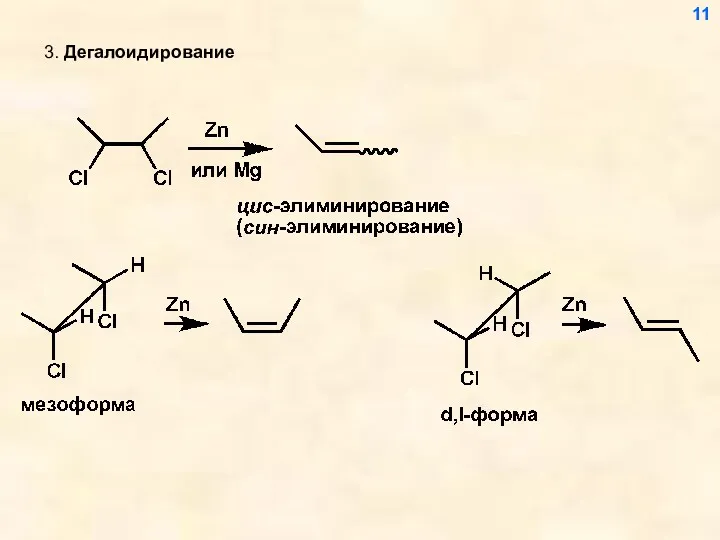
- 11. 3. Дегалоидирование 11
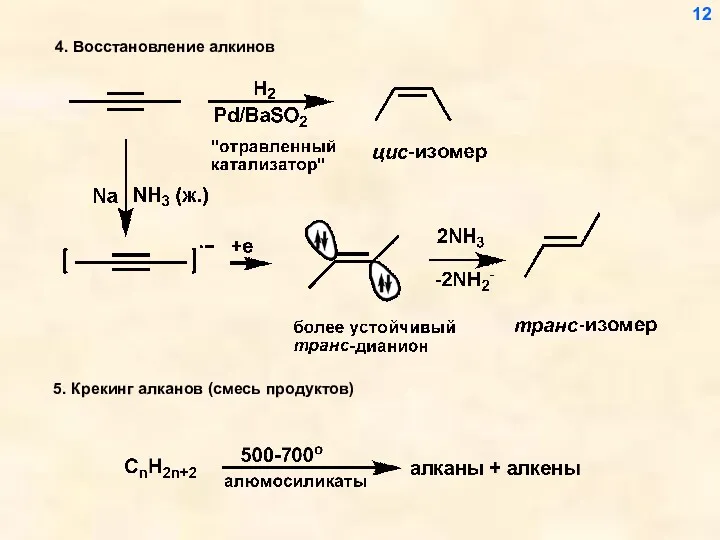
- 12. 4. Восстановление алкинов 12
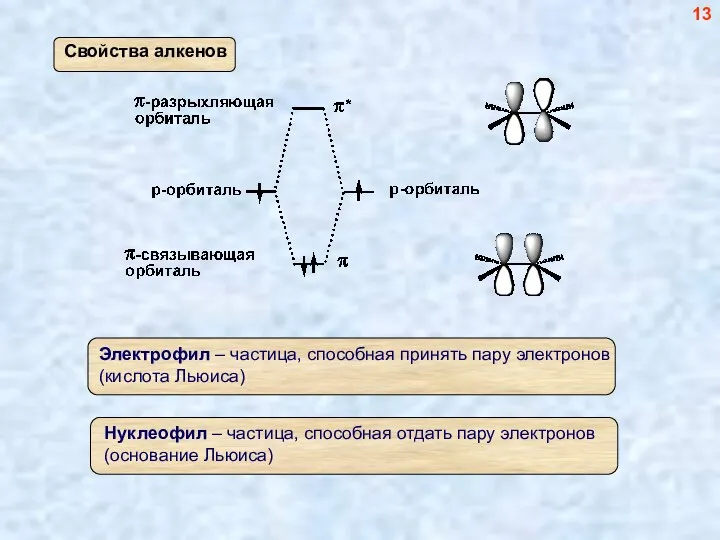
- 13. 13
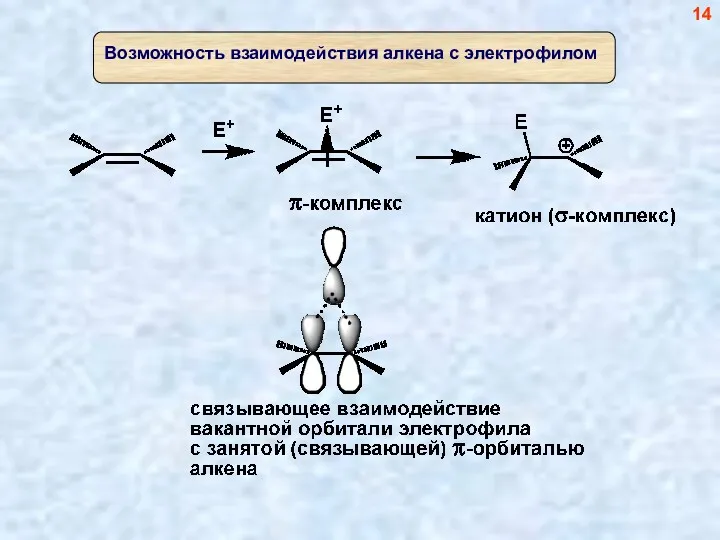
- 14. 14
- 15. Невозможность взаимодействия алкена с электрофилом (запрет по симметрии) 15
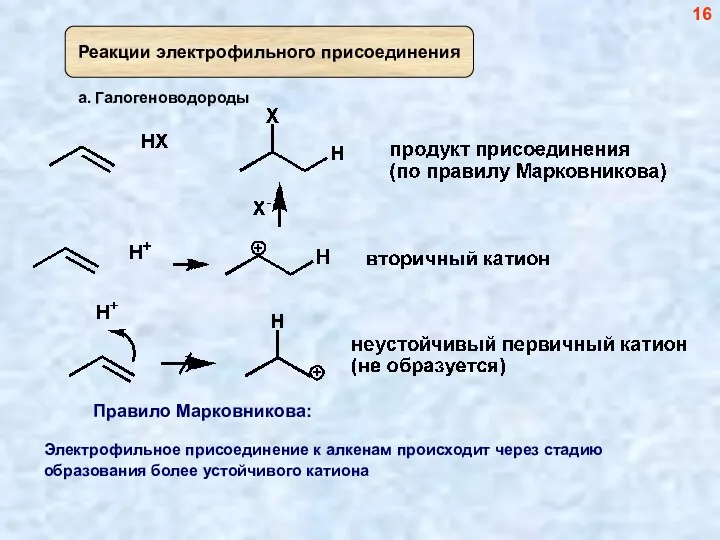
- 16. 16
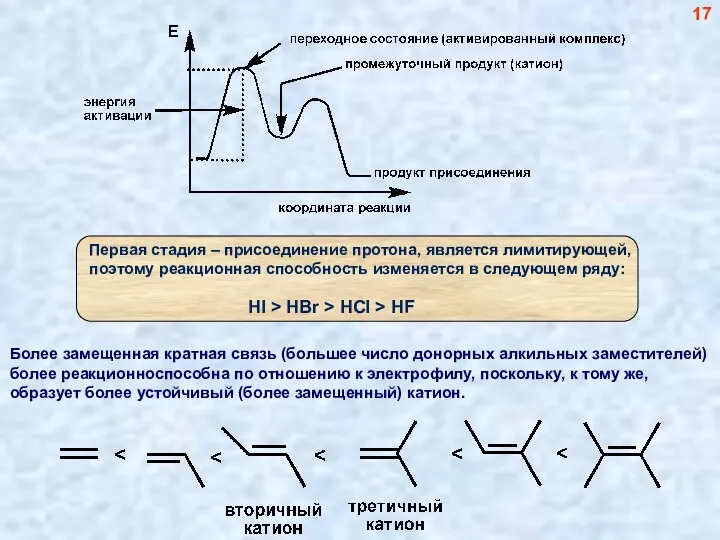
- 17. Более замещенная кратная связь (большее число донорных алкильных заместителей) более реакционноспособна по отношению к электрофилу, поскольку,
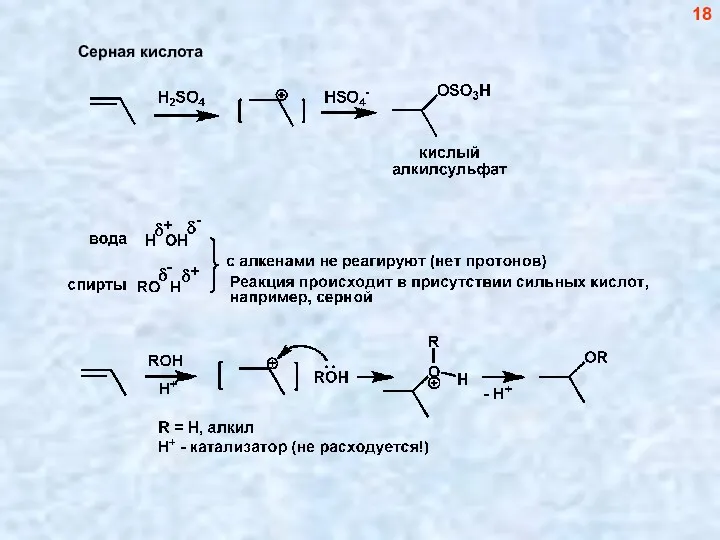
- 18. 18
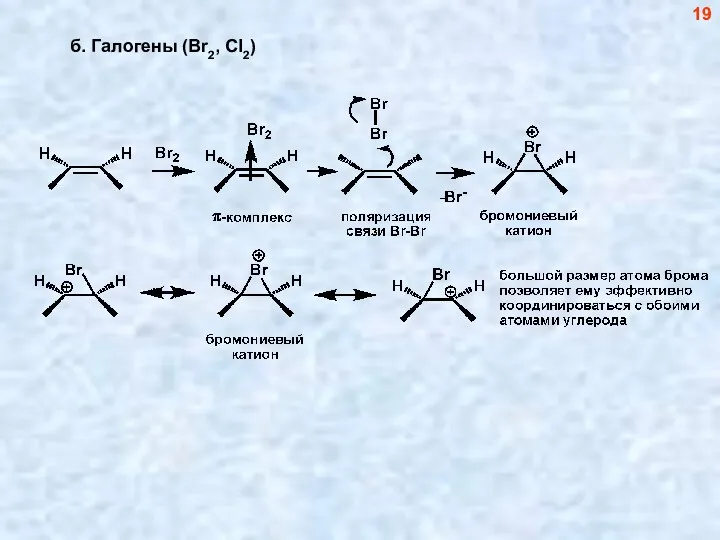
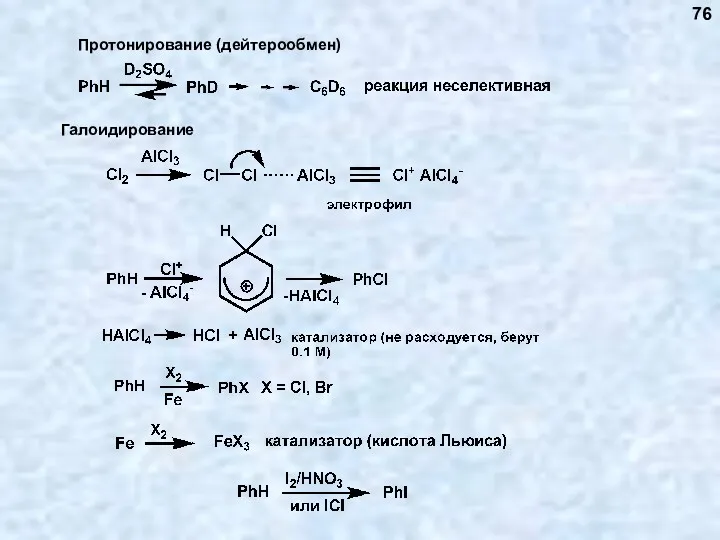
- 19. б. Галогены (Br2, Cl2) 19
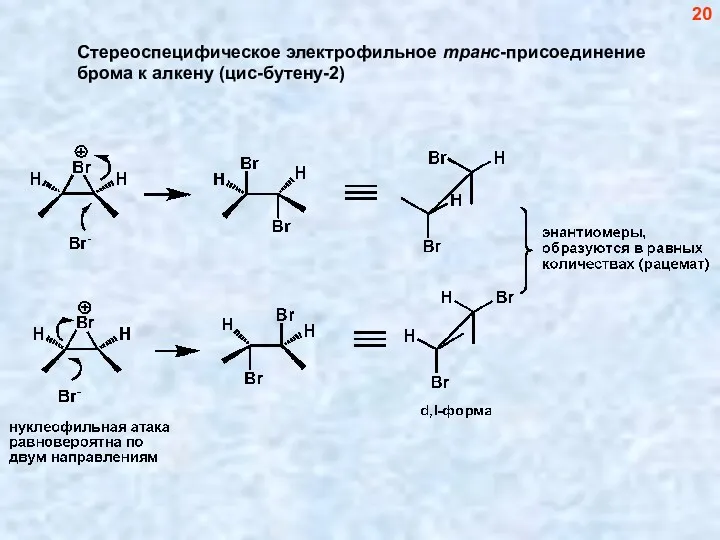
- 20. Стереоспецифическое электрофильное транс-присоединение брома к алкену (цис-бутену-2) 20
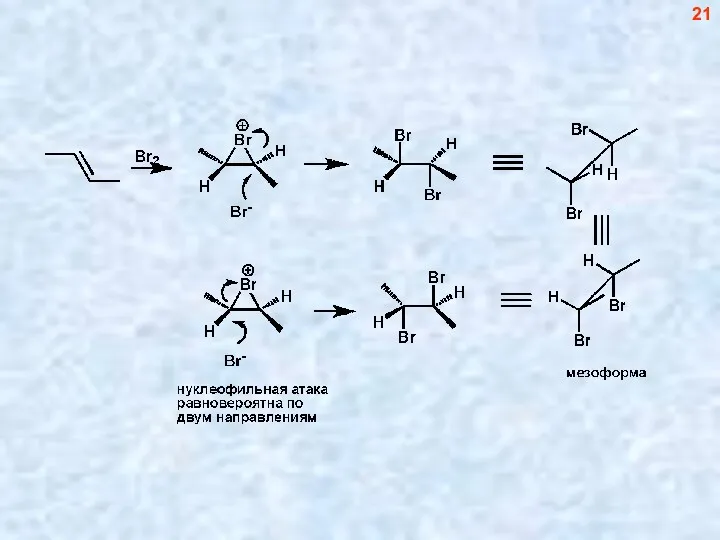
- 21. 21
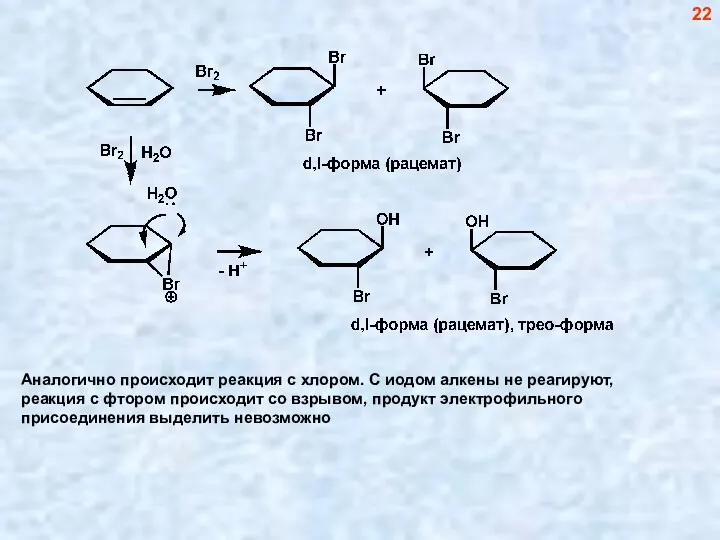
- 22. Аналогично происходит реакция с хлором. С иодом алкены не реагируют, реакция с фтором происходит со взрывом,
- 23. 23
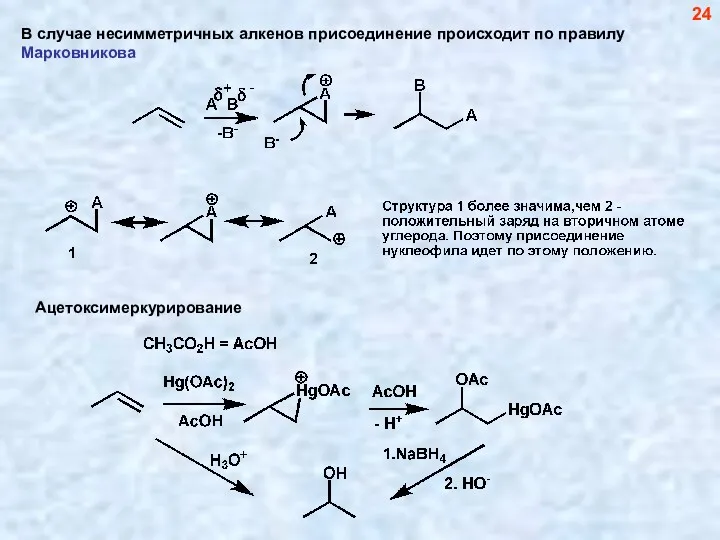
- 24. В случае несимметричных алкенов присоединение происходит по правилу Марковникова 24
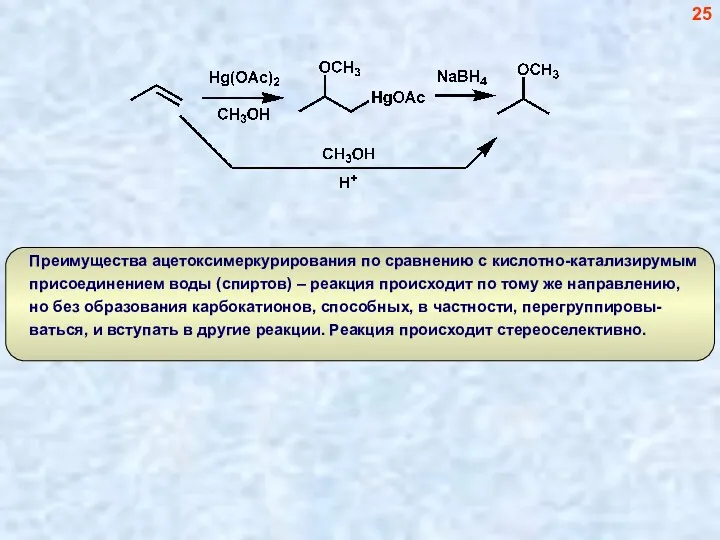
- 25. 25
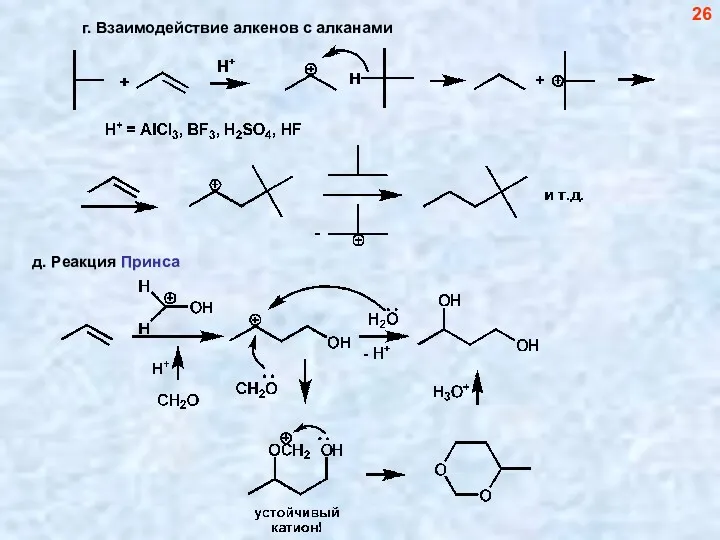
- 26. г. Взаимодействие алкенов с алканами 26
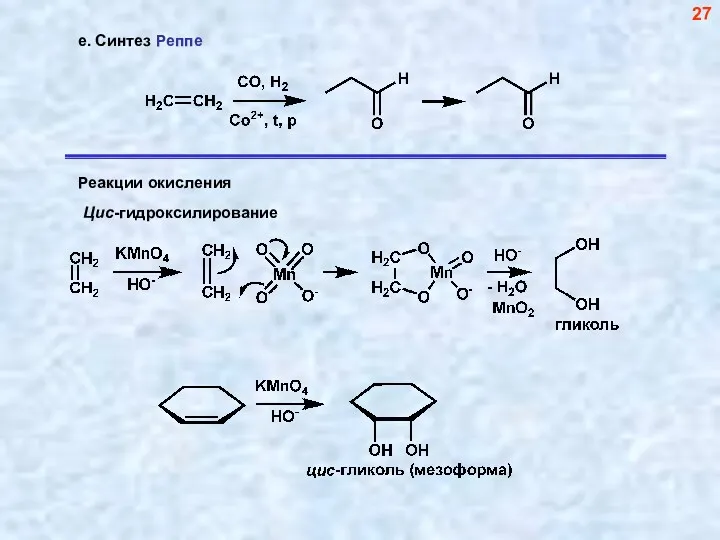
- 27. 27
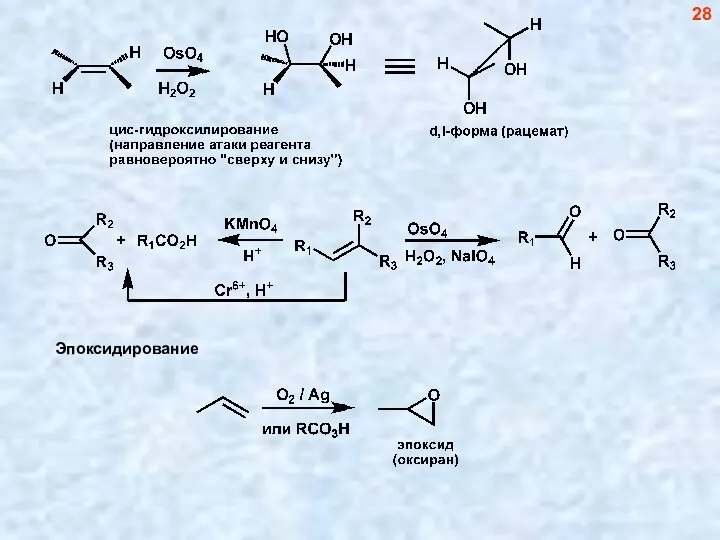
- 28. 28
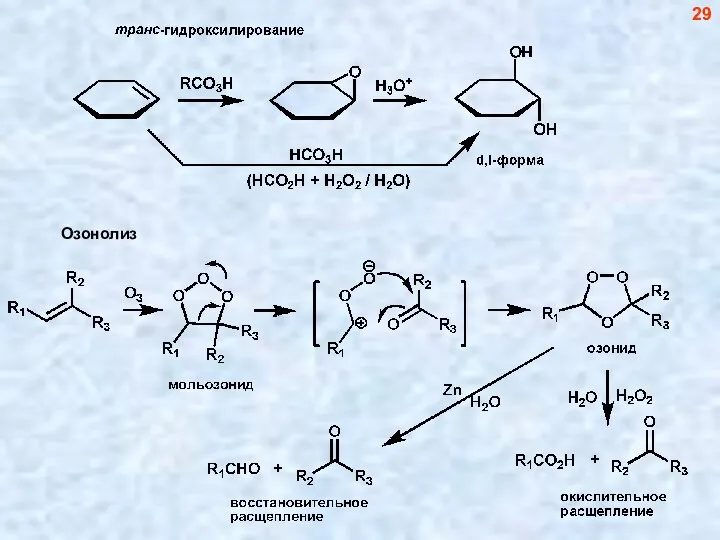
- 29. 29
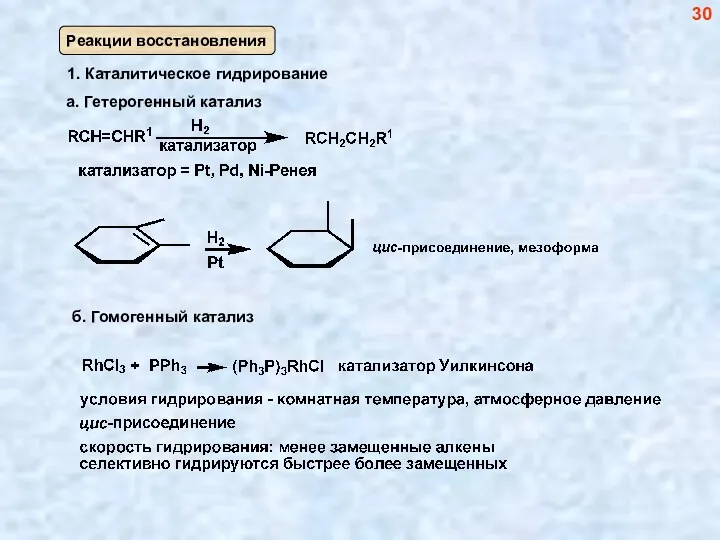
- 30. б. Гомогенный катализ 30
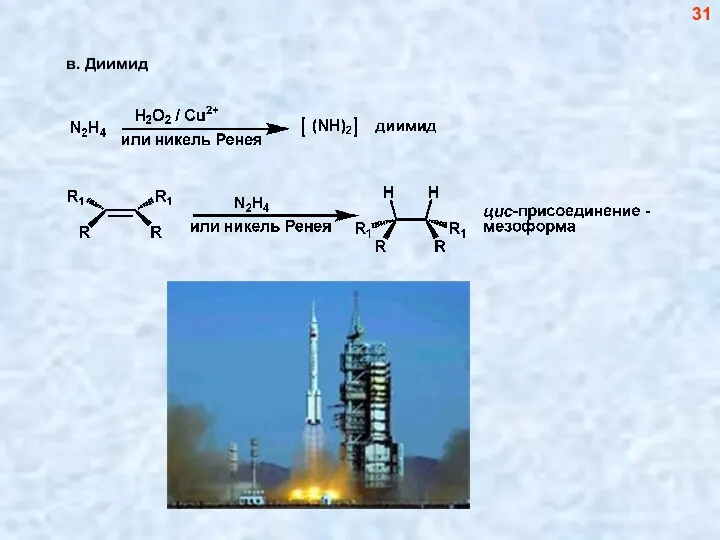
- 31. в. Диимид 31
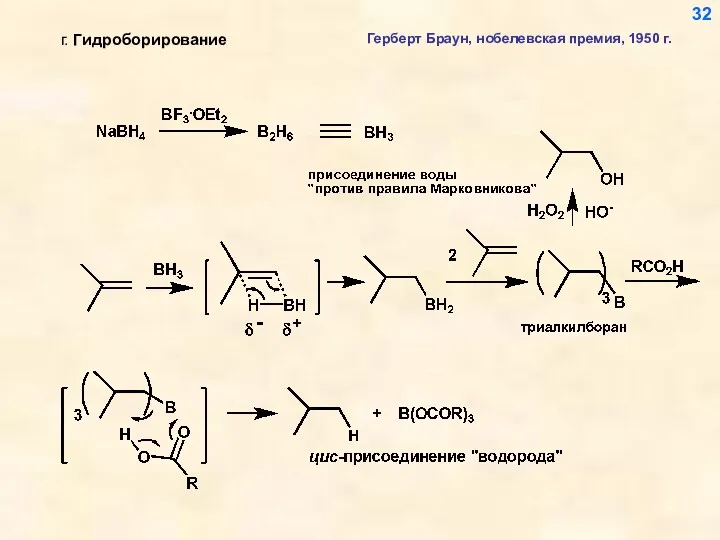
- 32. 32
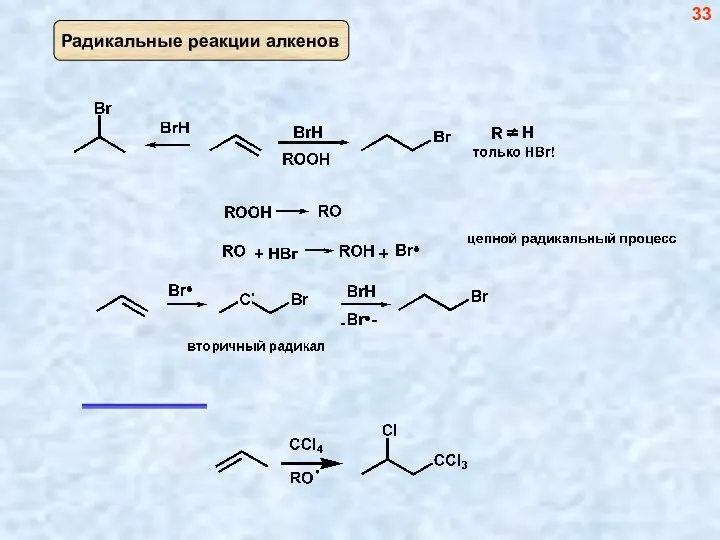
- 33. 33
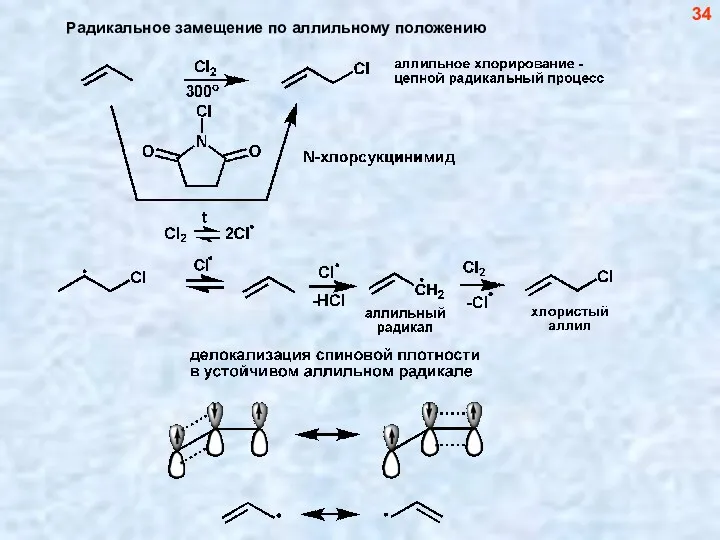
- 34. 34 Радикальное замещение по аллильному положению
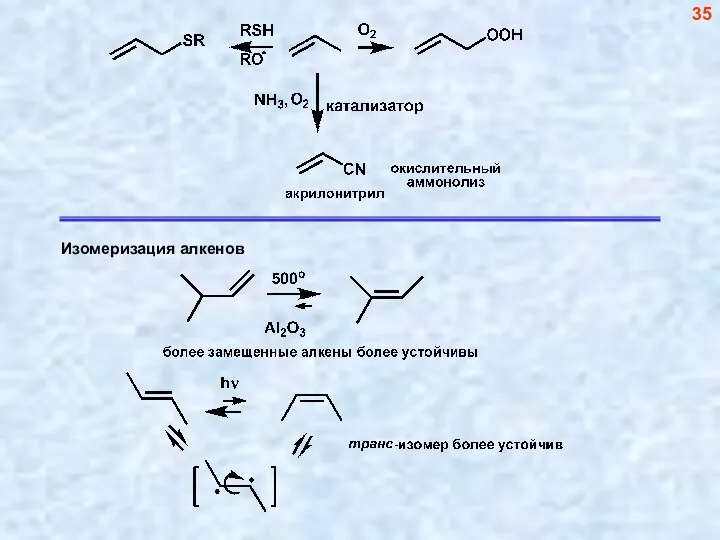
- 35. 35
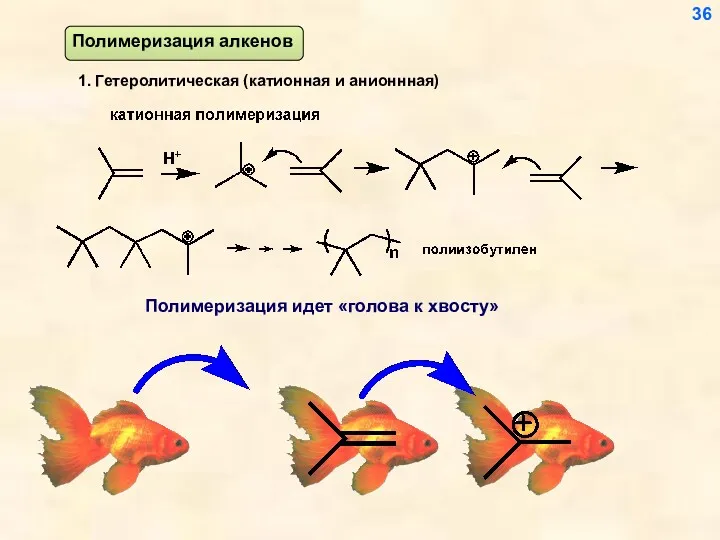
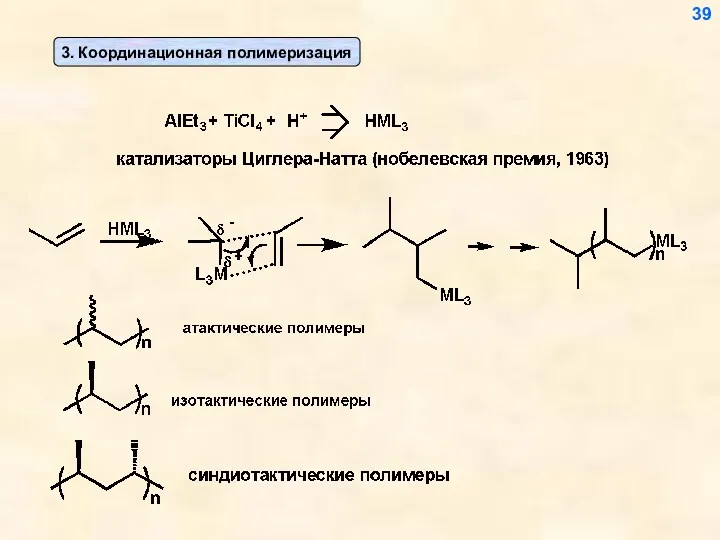
- 36. 1. Гетеролитическая (катионная и анионнная) Полимеризация идет «голова к хвосту» 36
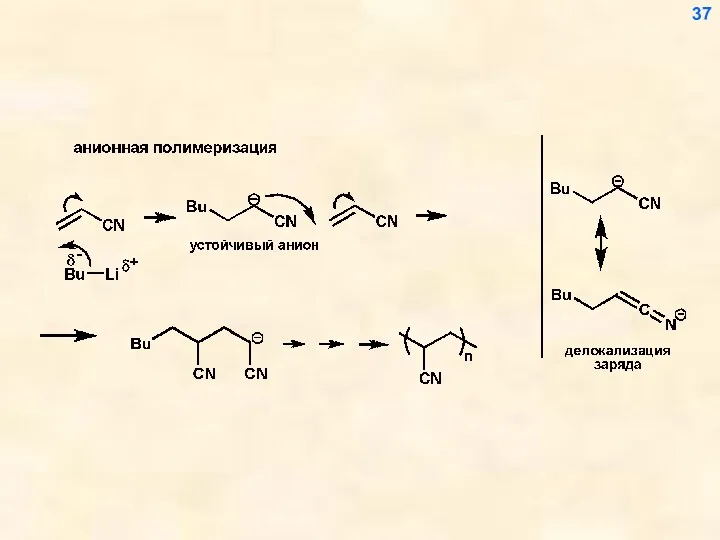
- 37. 37
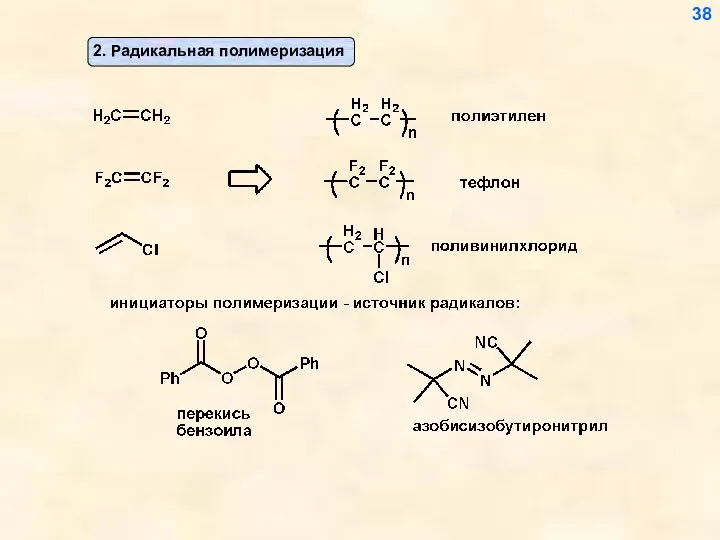
- 38. 38
- 39. 39
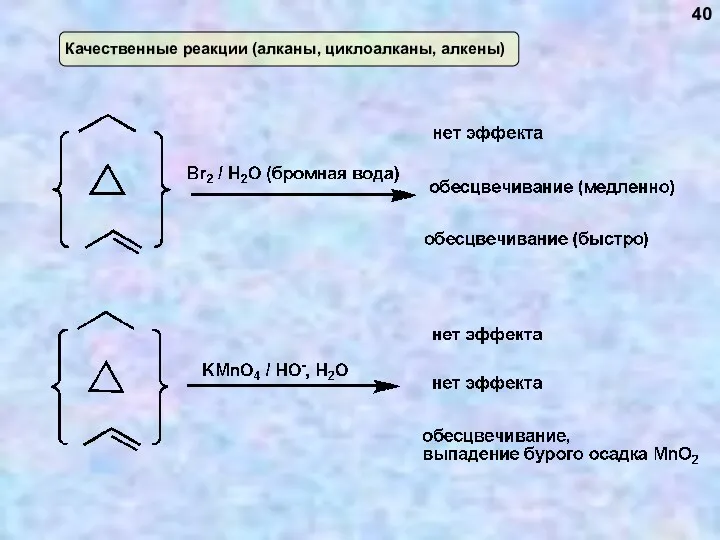
- 40. Качественные реакции (алканы, циклоалканы, алкены) 40
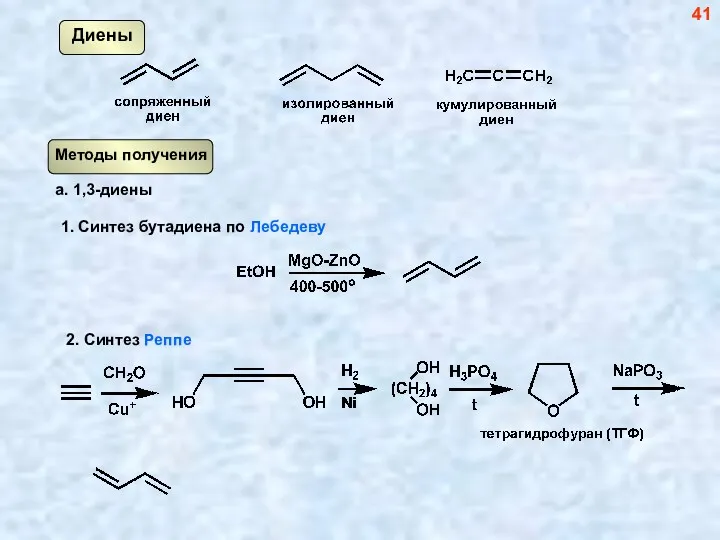
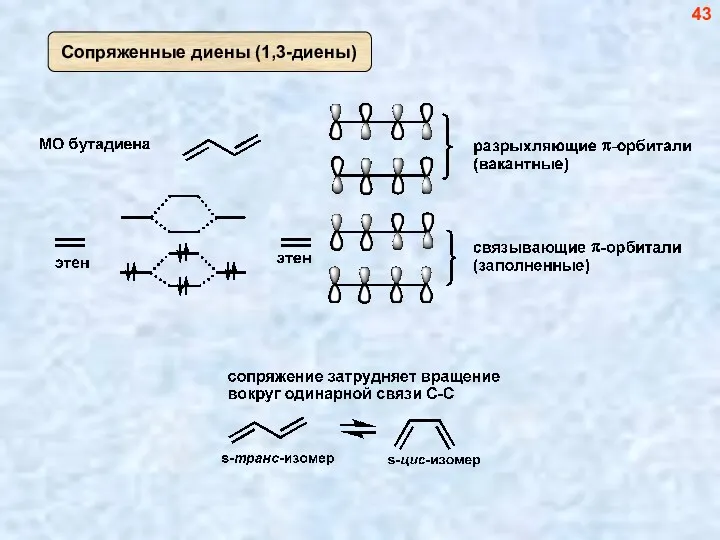
- 41. Диены 41
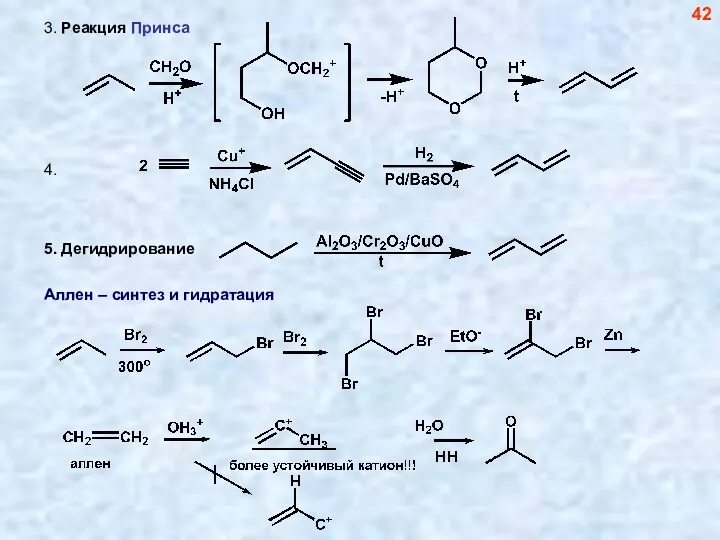
- 42. 42
- 43. 43
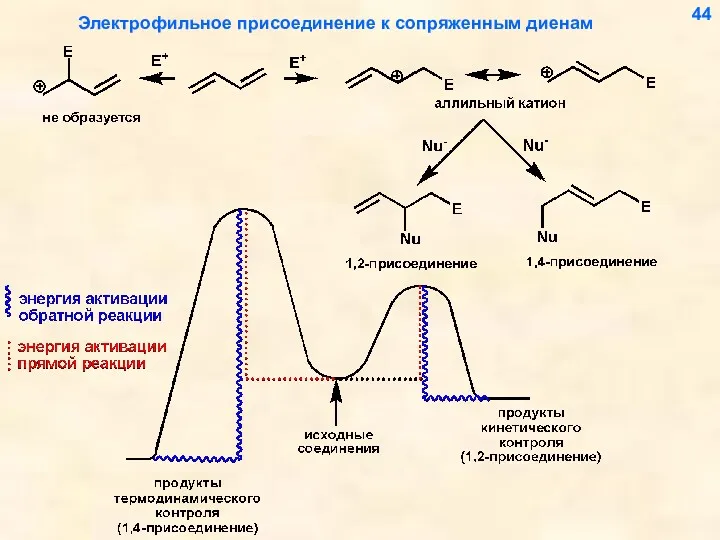
- 44. Электрофильное присоединение к сопряженным диенам 44
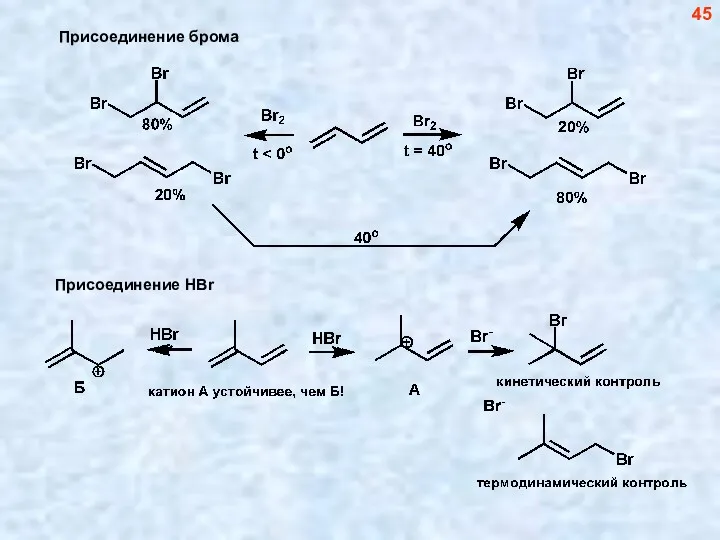
- 45. 45
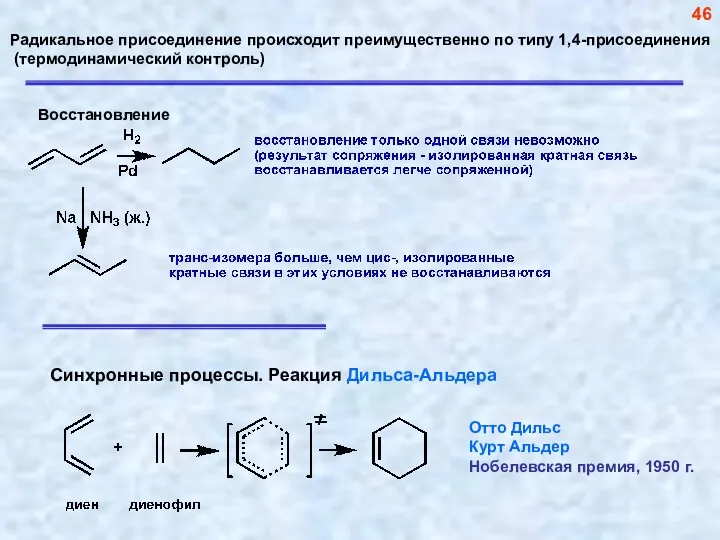
- 46. Радикальное присоединение происходит преимущественно по типу 1,4-присоединения (термодинамический контроль) 46
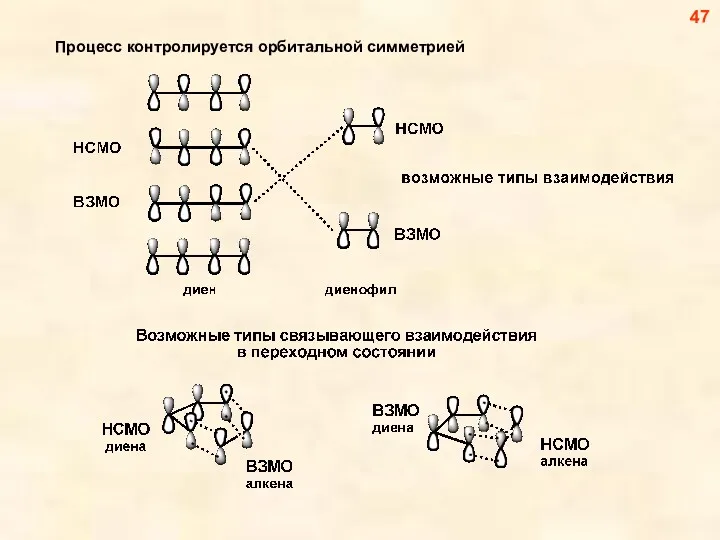
- 47. Процесс контролируется орбитальной симметрией 47
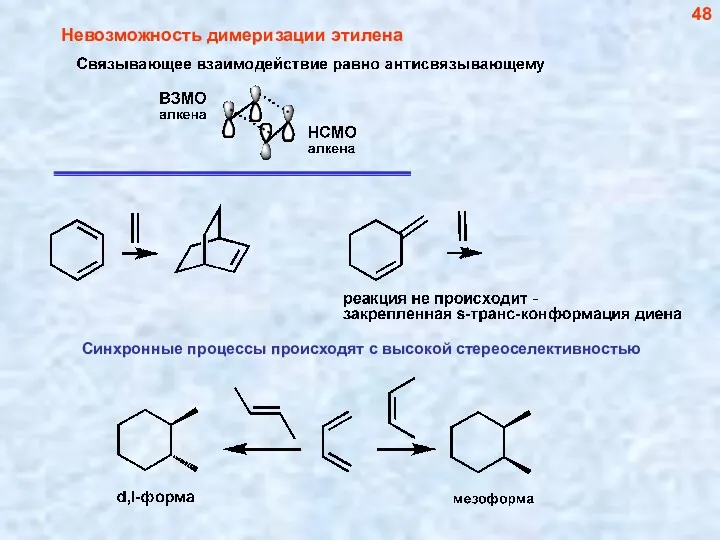
- 48. Невозможность димеризации этилена 48
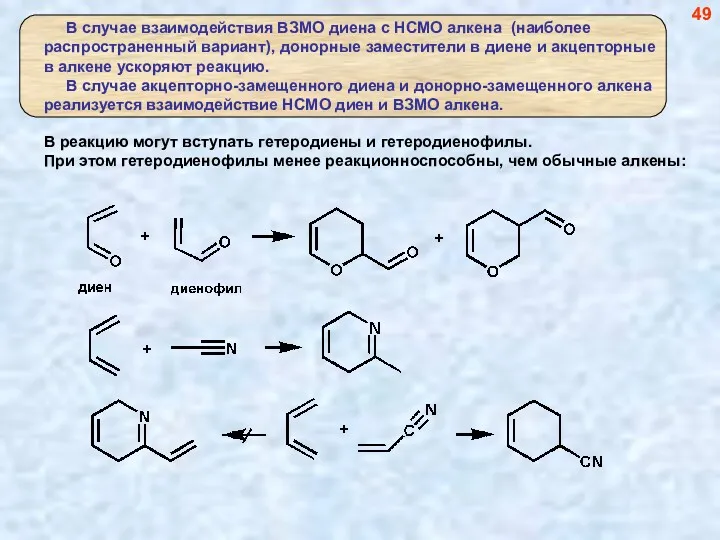
- 49. 49 В реакцию могут вступать гетеродиены и гетеродиенофилы. При этом гетеродиенофилы менее реакционноспособны, чем обычные алкены:
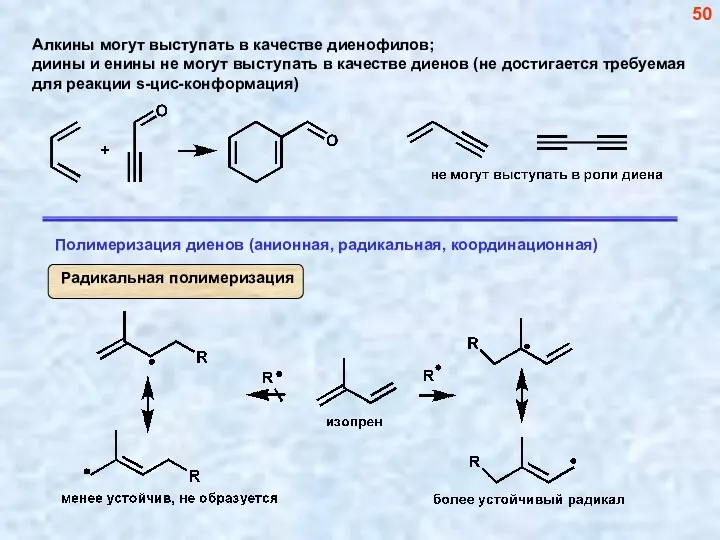
- 50. 50
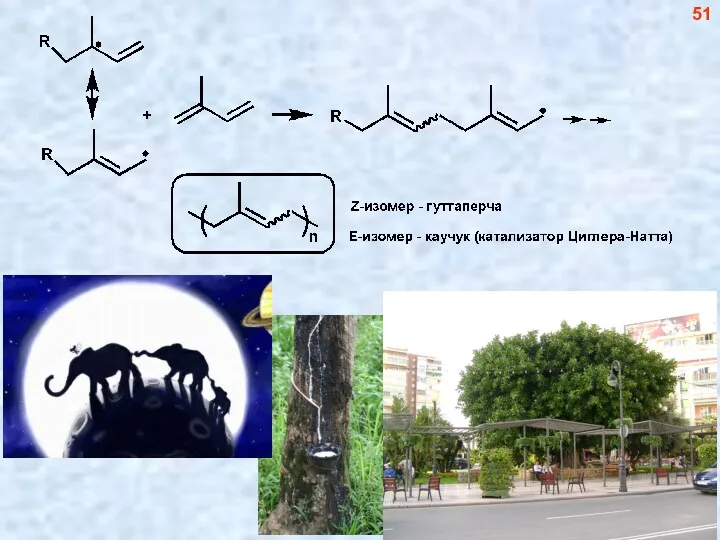
- 51. 51
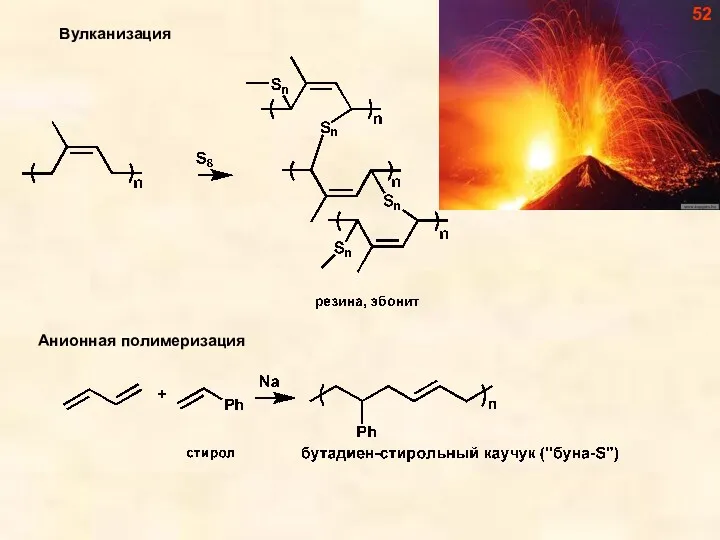
- 52. 52
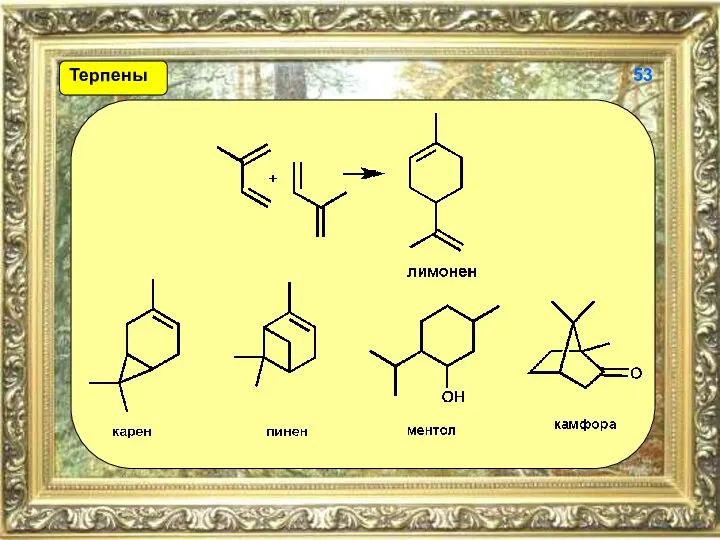
- 53. 53
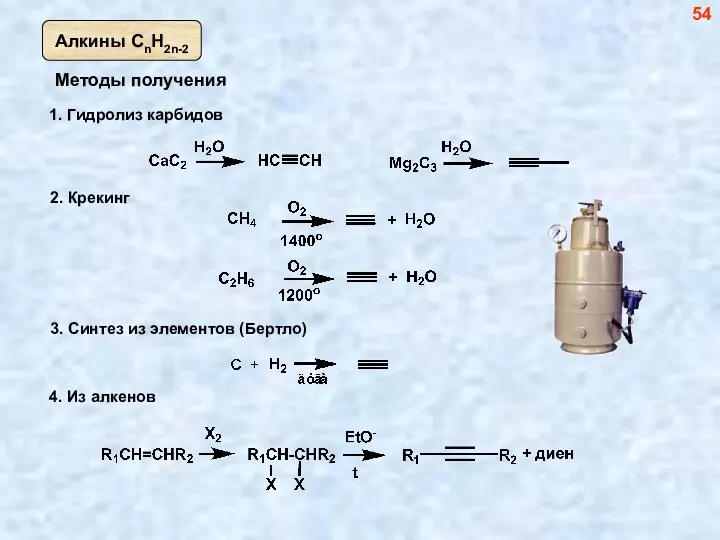
- 54. Методы получения 2. Крекинг 54
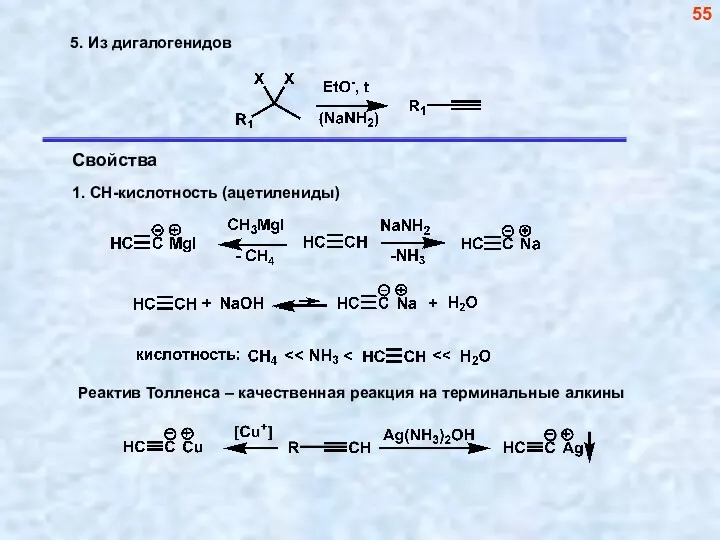
- 55. 55
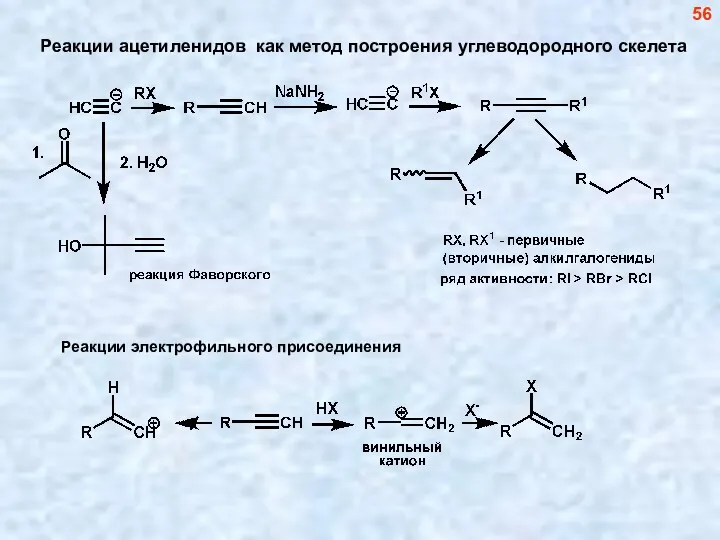
- 56. Реакции ацетиленидов как метод построения углеводородного скелета 56
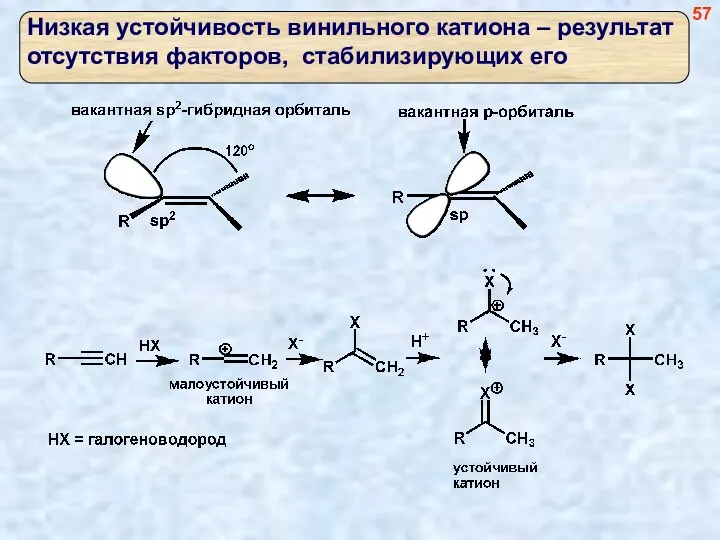
- 57. 57
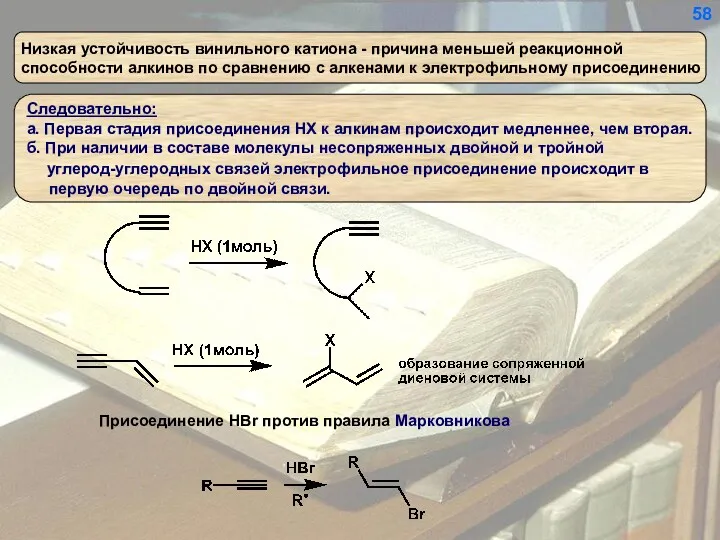
- 58. 58
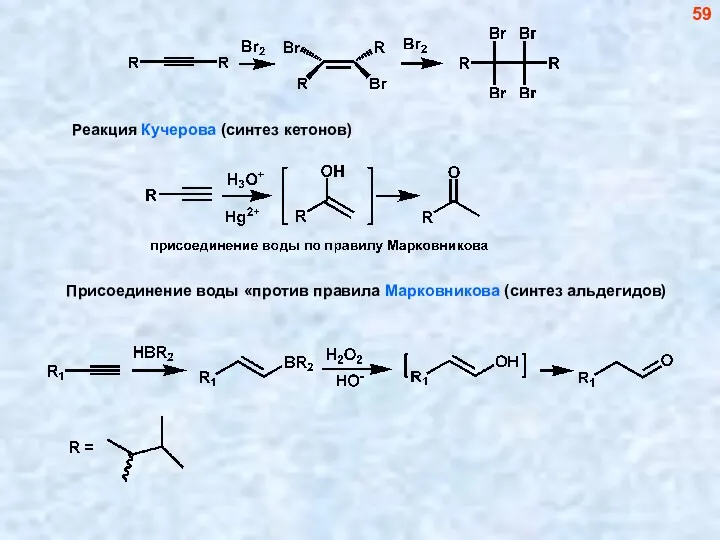
- 59. 59
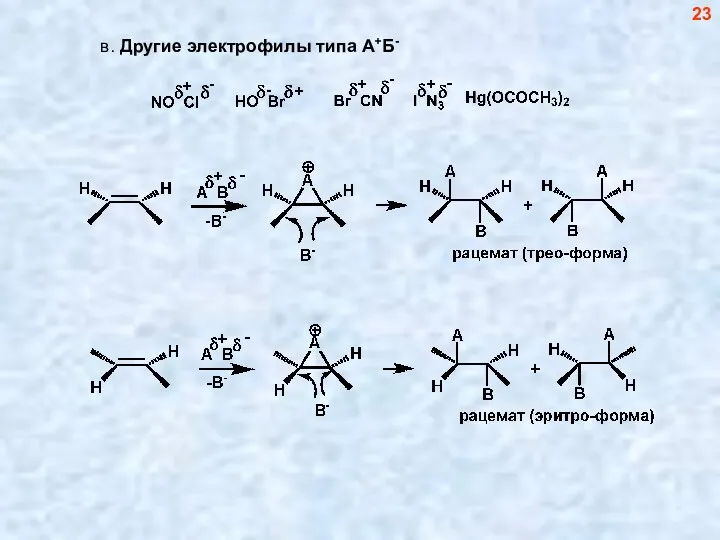
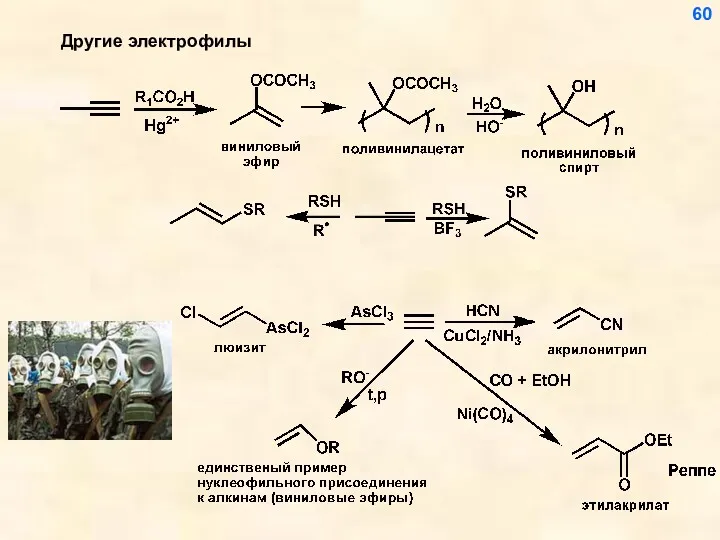
- 60. Другие электрофилы 60
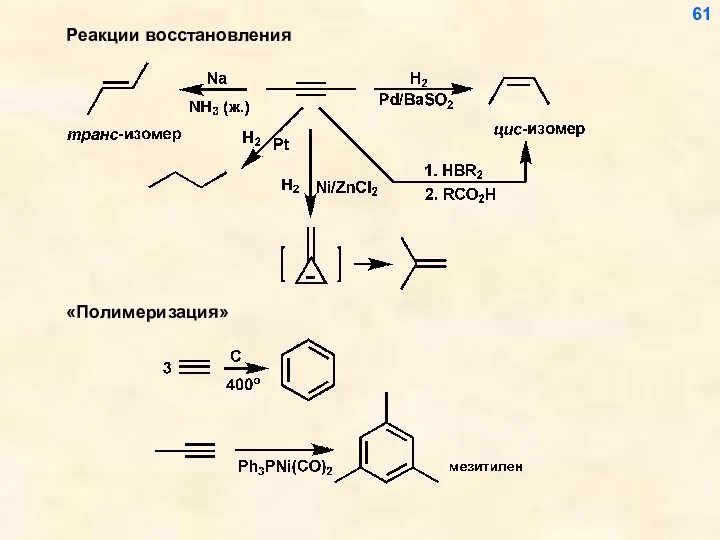
- 61. Реакции восстановления 61
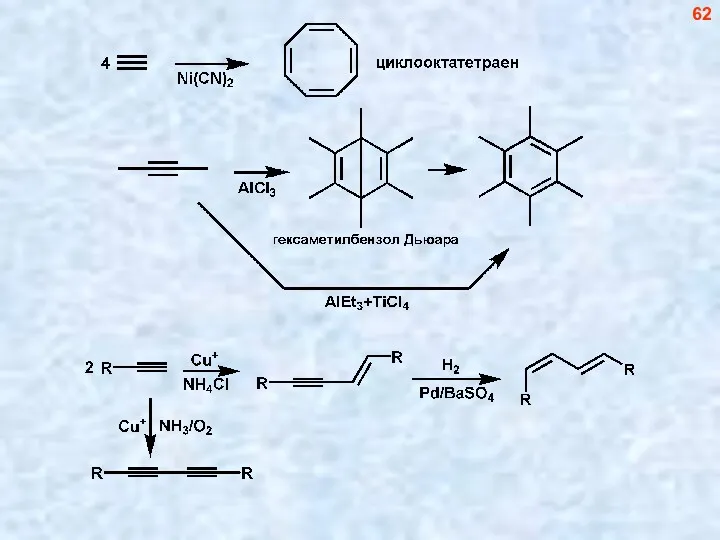
- 62. 62
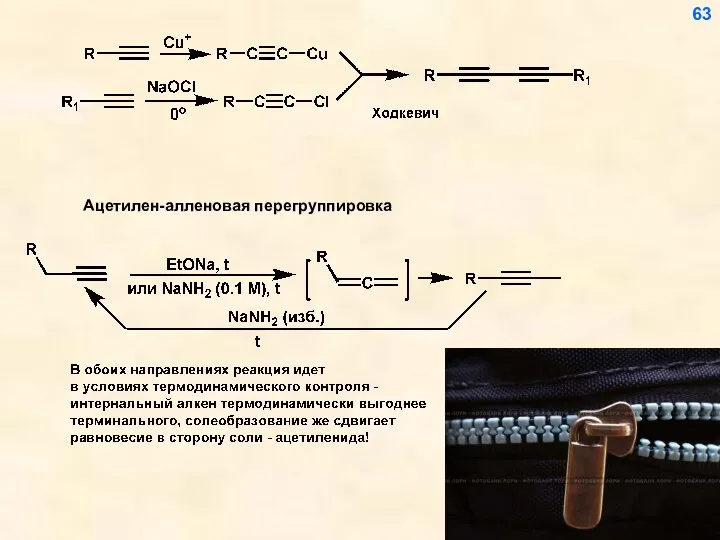
- 63. 63
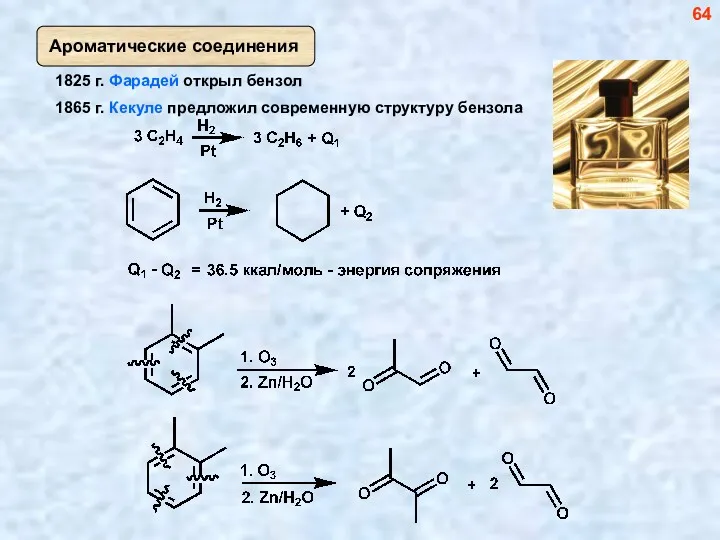
- 64. 64
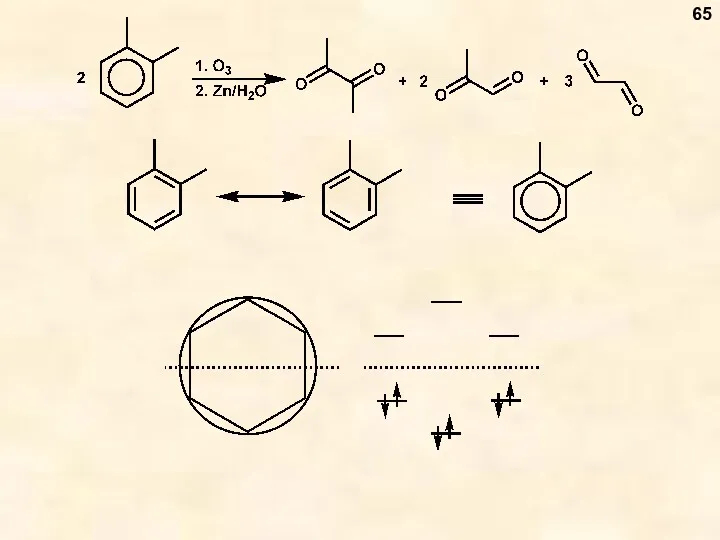
- 65. 65
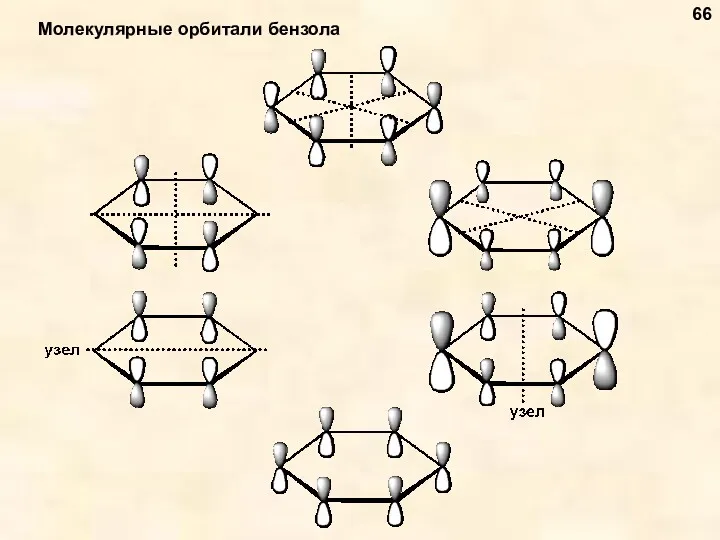
- 66. Молекулярные орбитали бензола 66
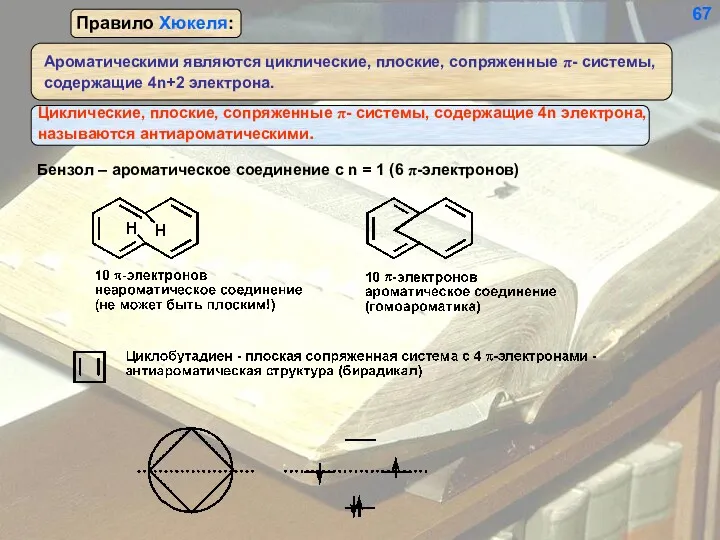
- 67. Бензол – ароматическое соединение с n = 1 (6 π-электронов) 67
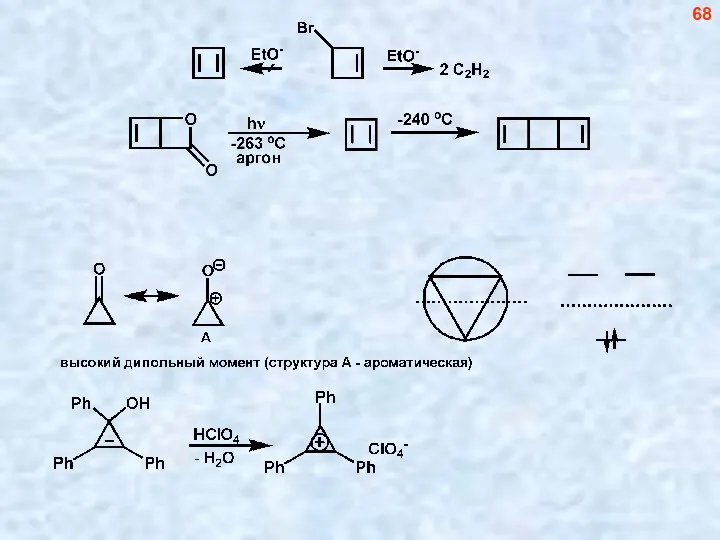
- 68. 68
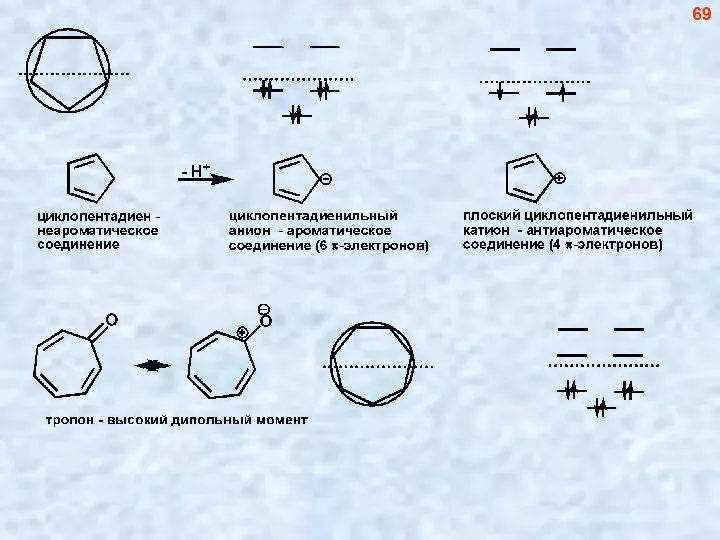
- 69. 69
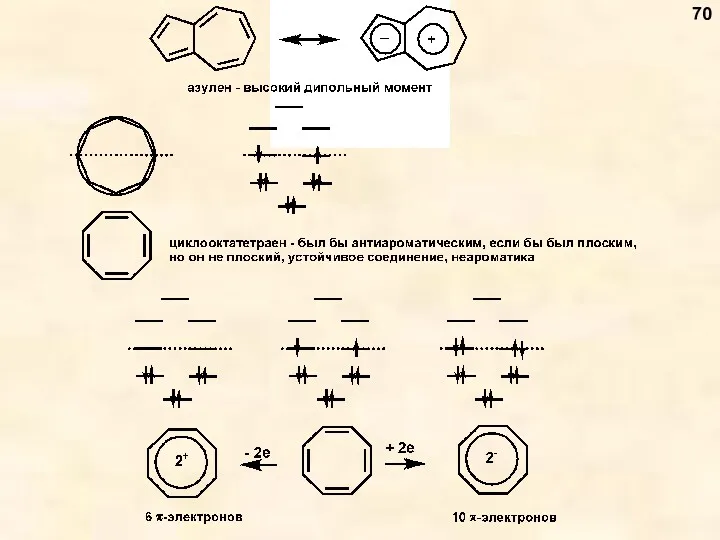
- 70. 70
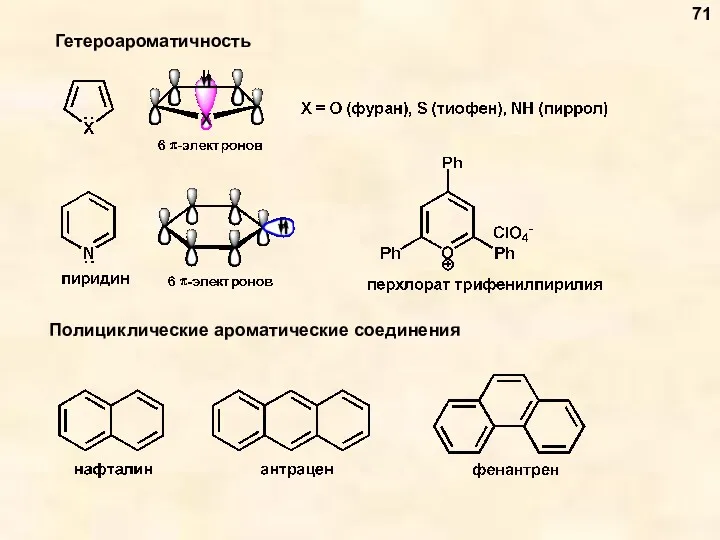
- 71. Гетероароматичность 71
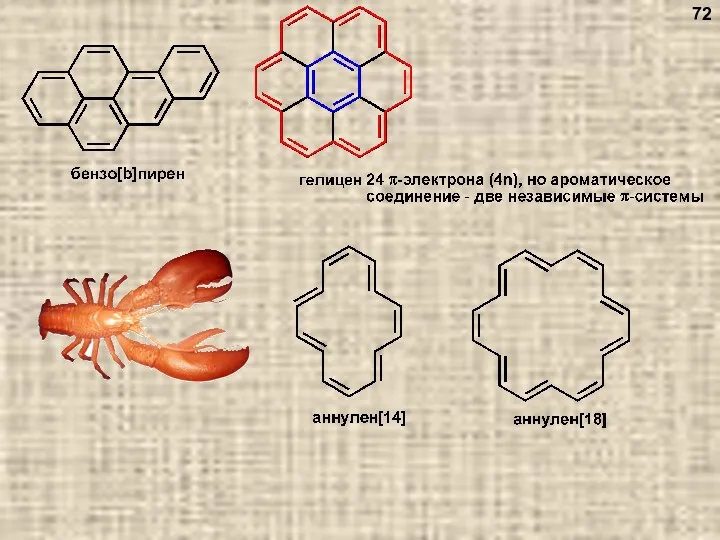
- 72. 72
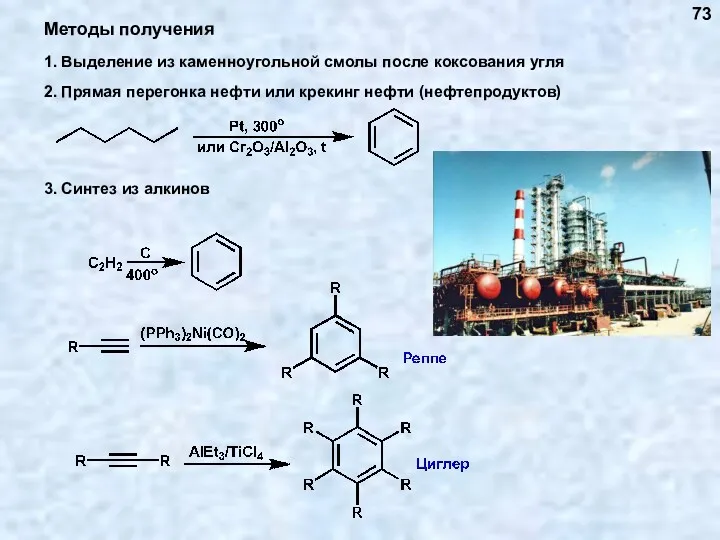
- 73. 1. Выделение из каменноугольной смолы после коксования угля 73
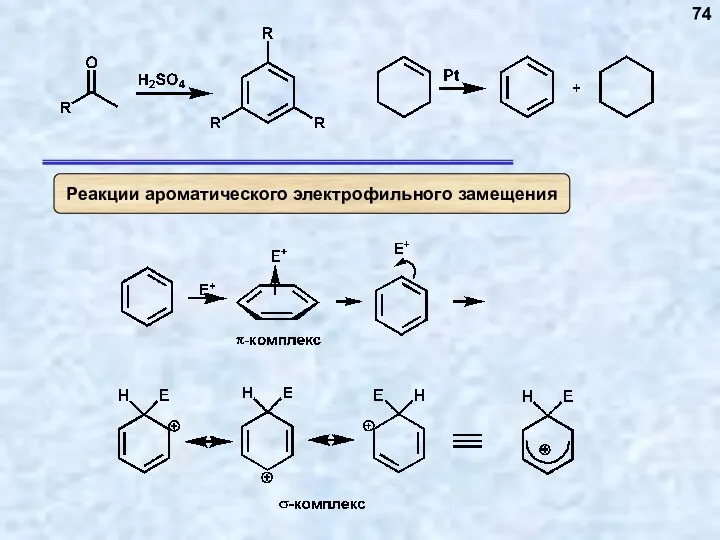
- 74. 74
- 75. 75
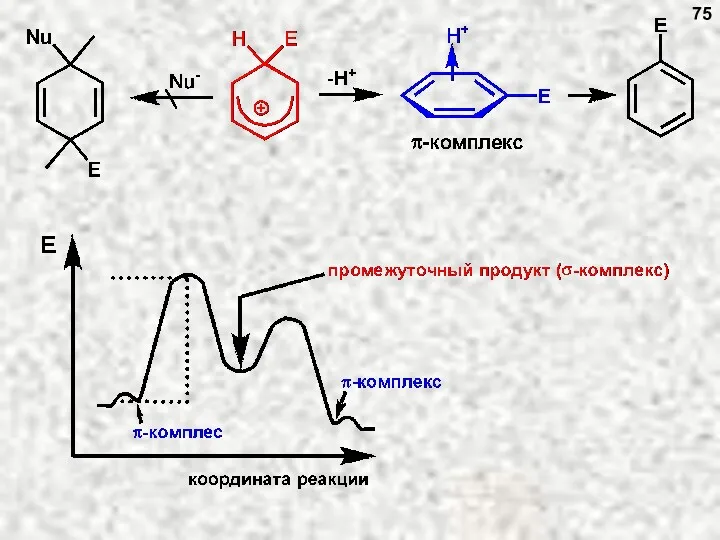
- 76. 76
- 77. 77
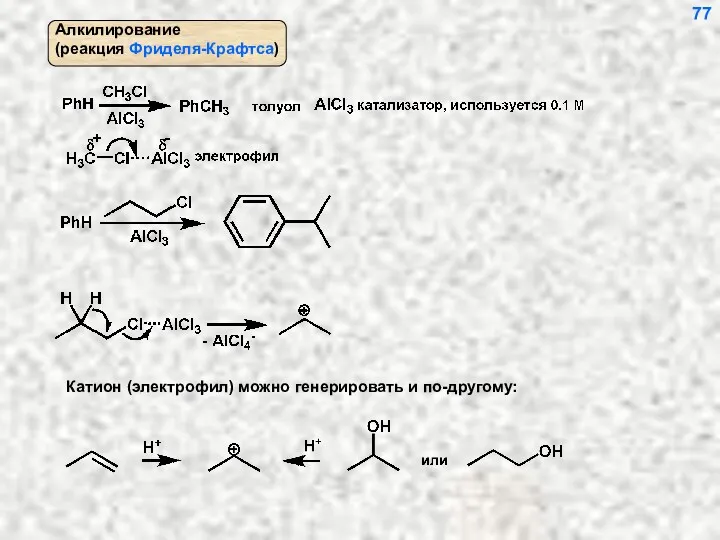
- 78. Реакция обратима 78
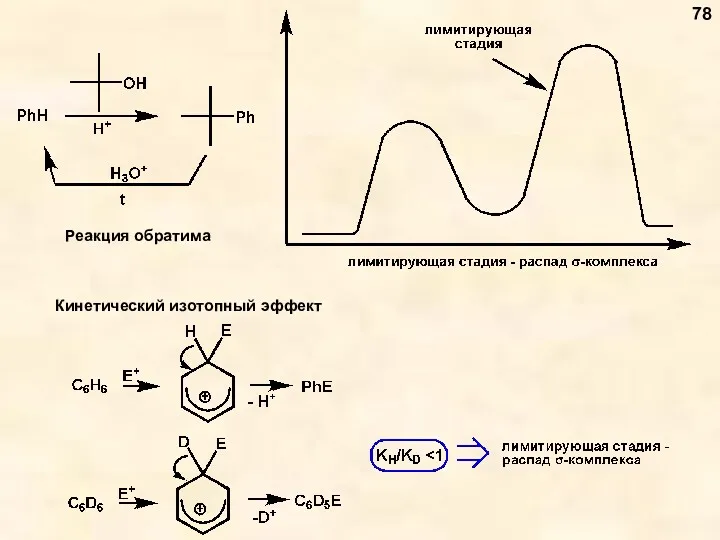
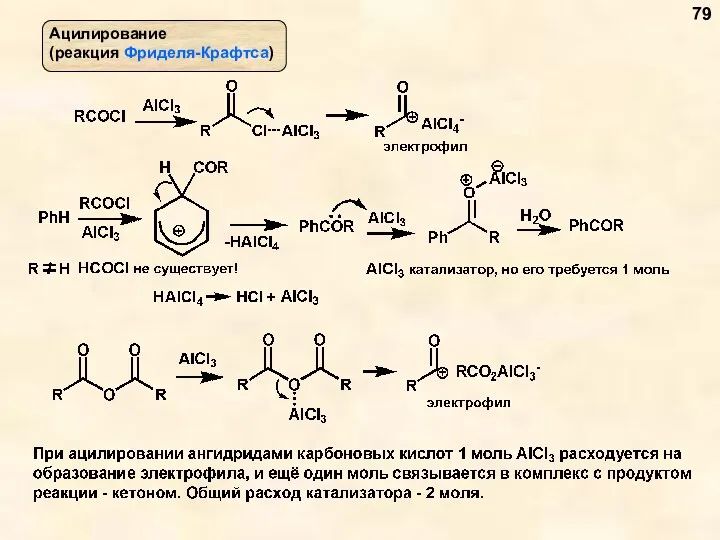
- 79. 79
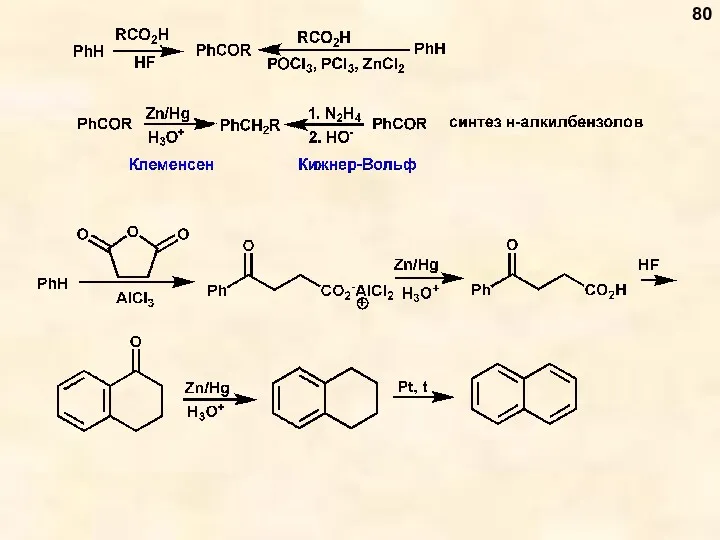
- 80. 80
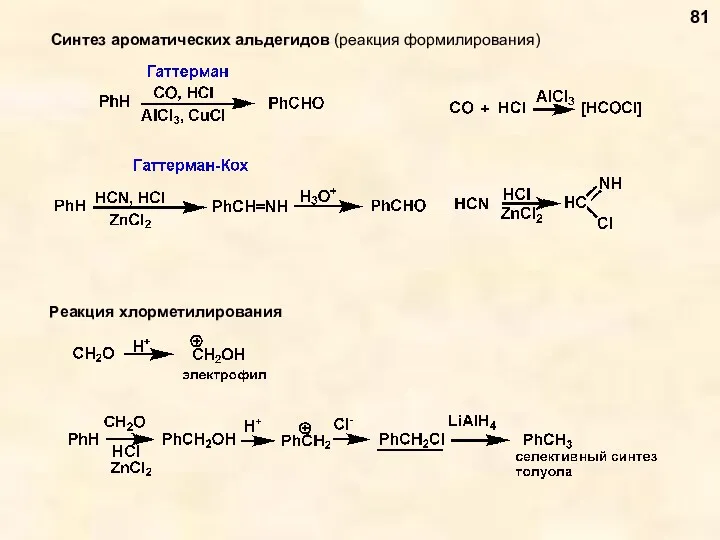
- 81. Синтез ароматических альдегидов (реакция формилирования) 81
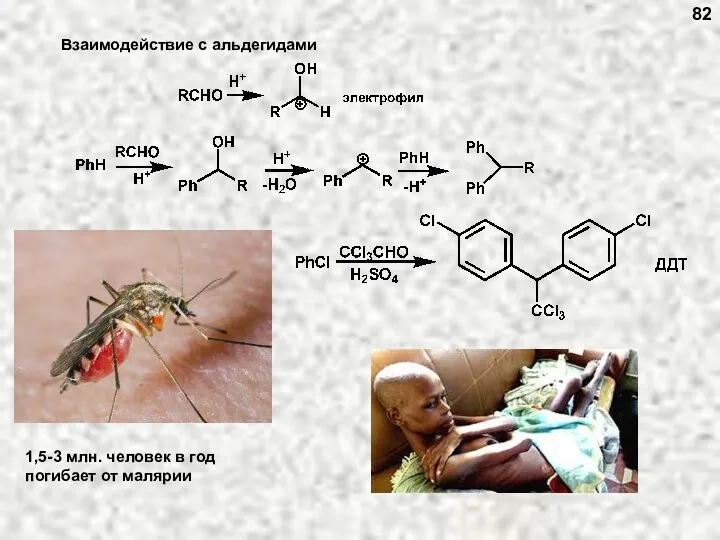
- 82. Взаимодействие с альдегидами 82
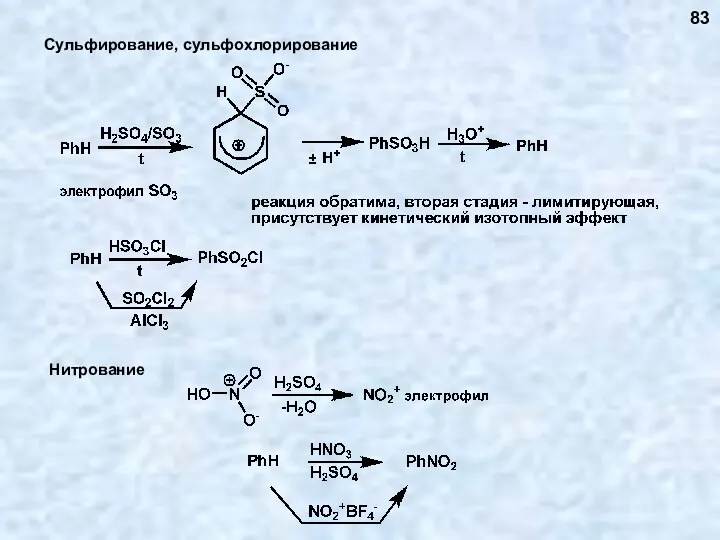
- 83. Сульфирование, сульфохлорирование 83
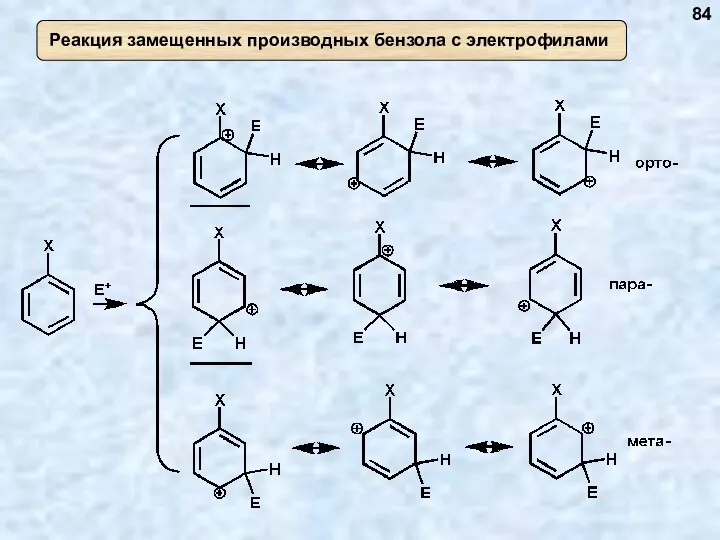
- 84. 84
- 85. 85
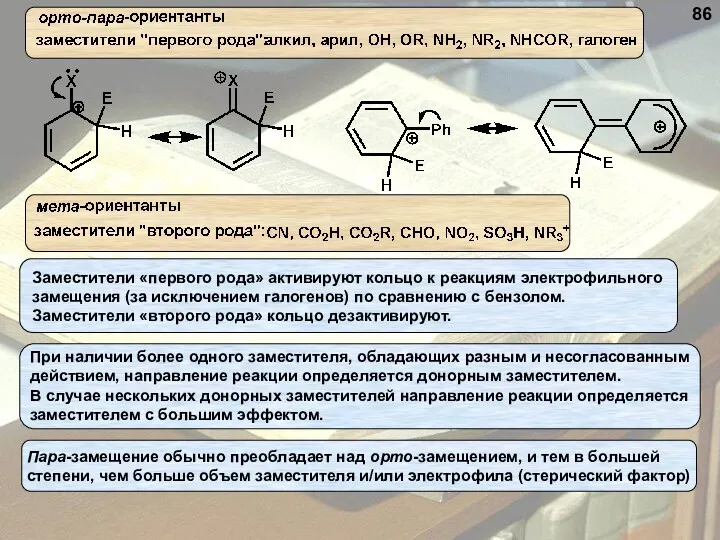
- 86. 86
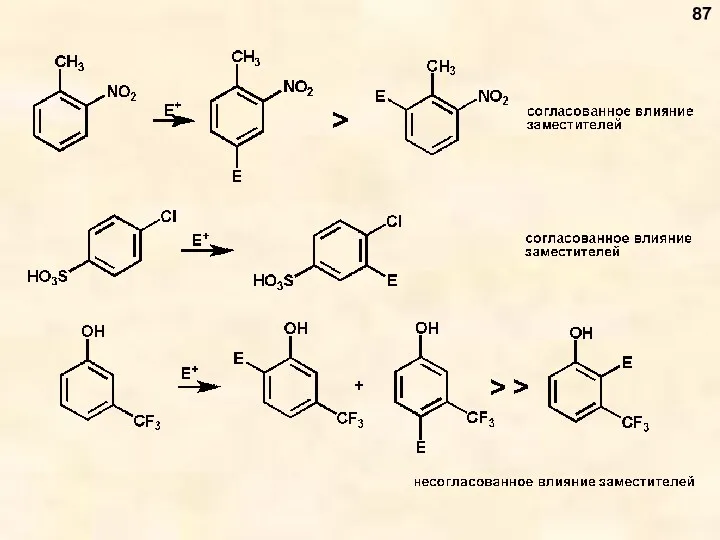
- 87. 87
- 88. 88
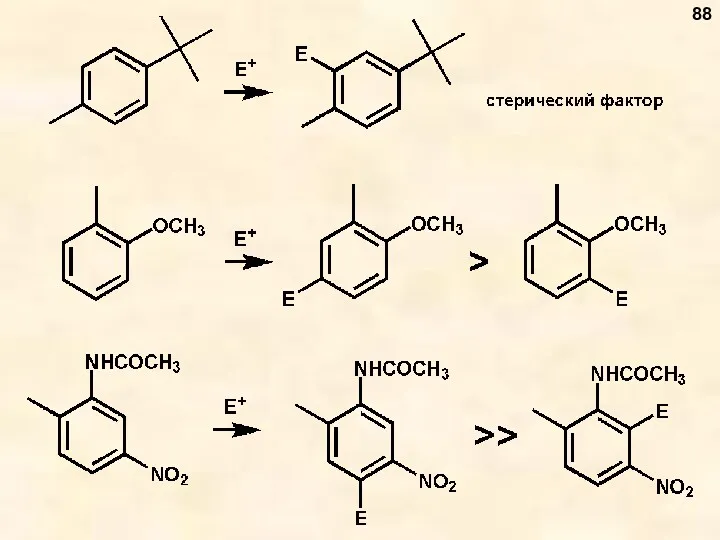
- 89. 1. Реакции Фриделя-Крафтса (алкилирование, ацилирование) 3. Реакция хлорметилирования 4. Реакции формилирования (Гаттермана и Гаттермана-Коха) 5. Кислотно-катализируемые
- 90. 90
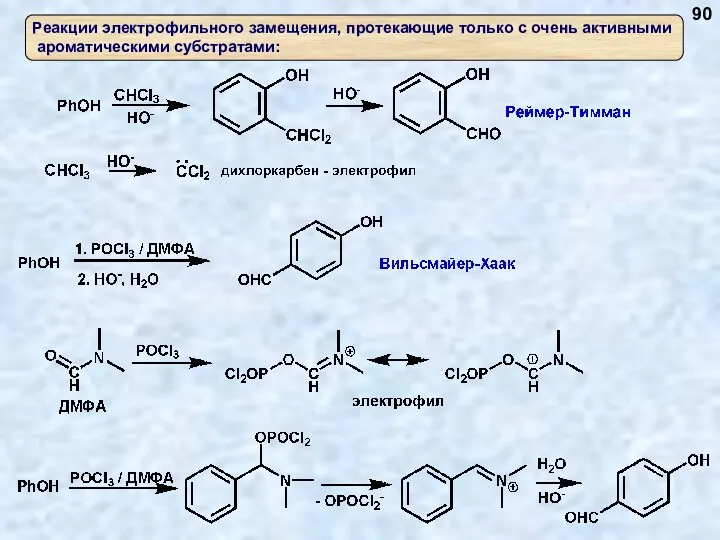
- 91. 91
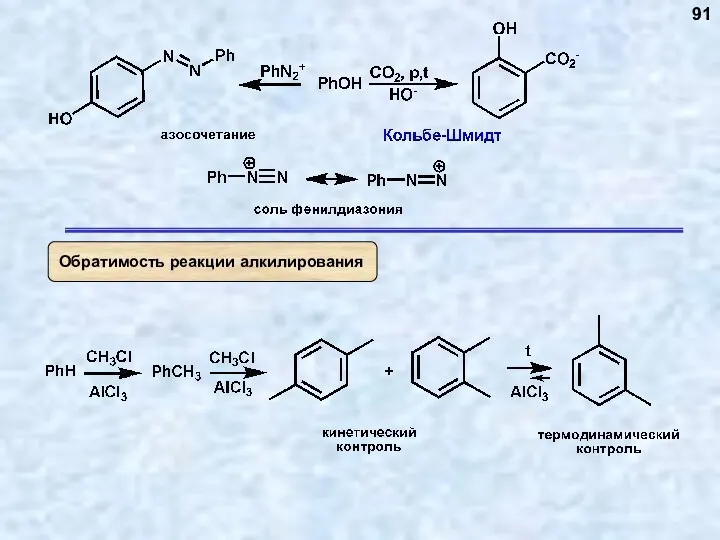
- 92. 92
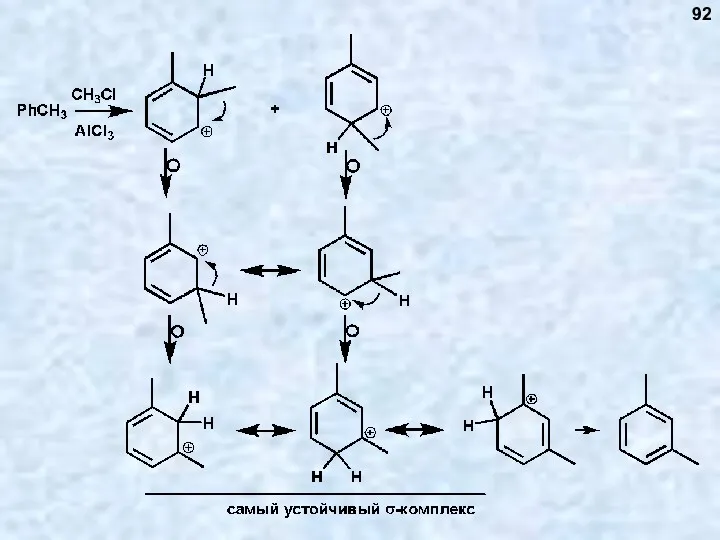
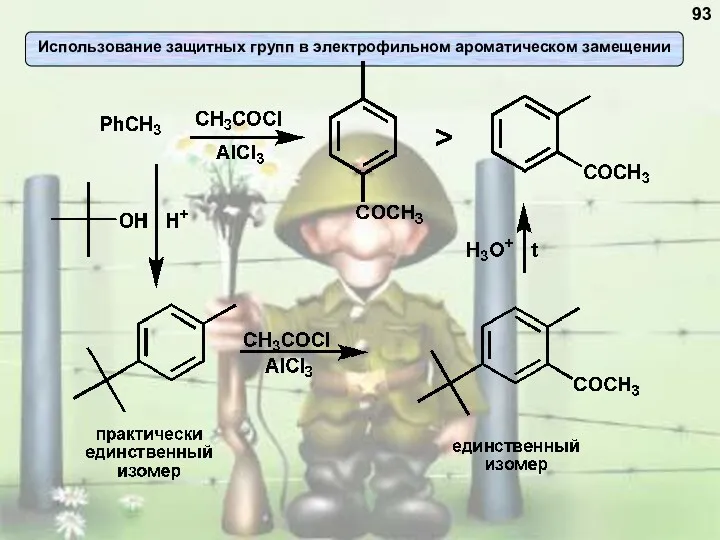
- 93. 93
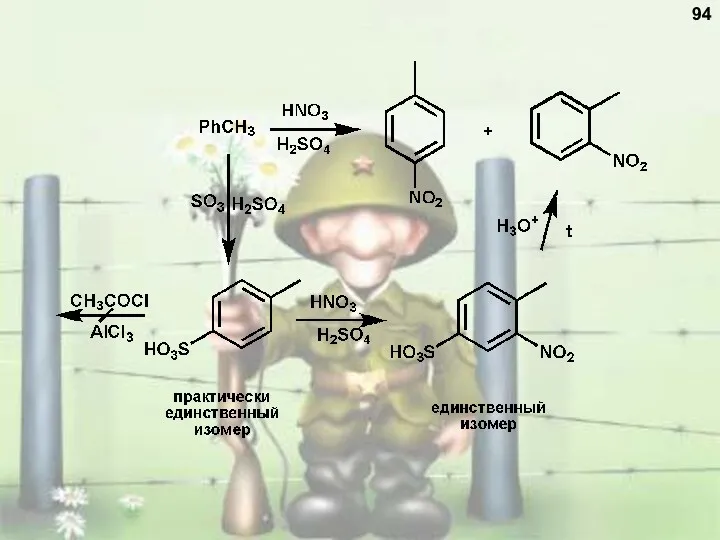
- 94. 94
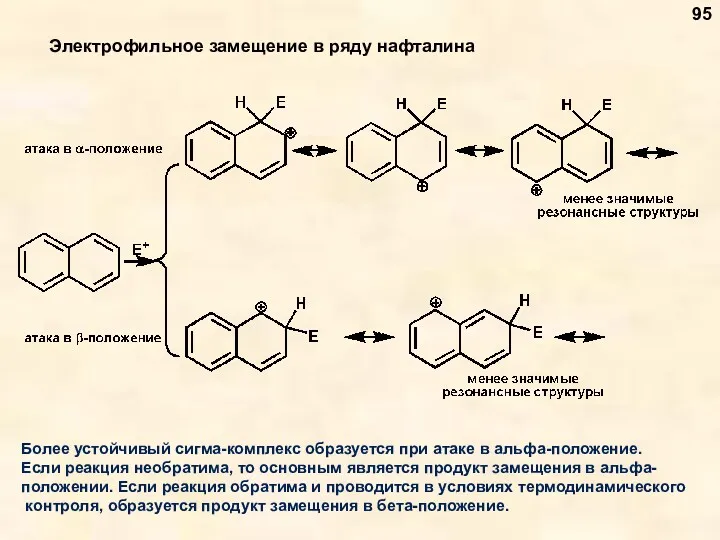
- 95. Электрофильное замещение в ряду нафталина Более устойчивый сигма-комплекс образуется при атаке в альфа-положение. Если реакция необратима,
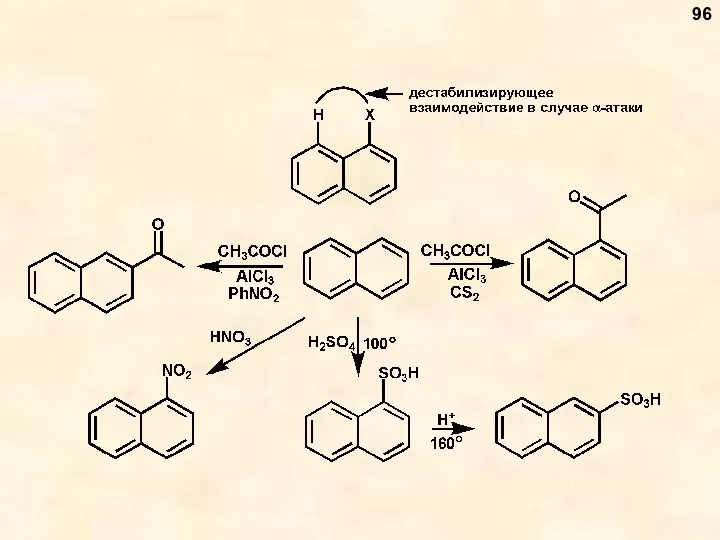
- 96. 96
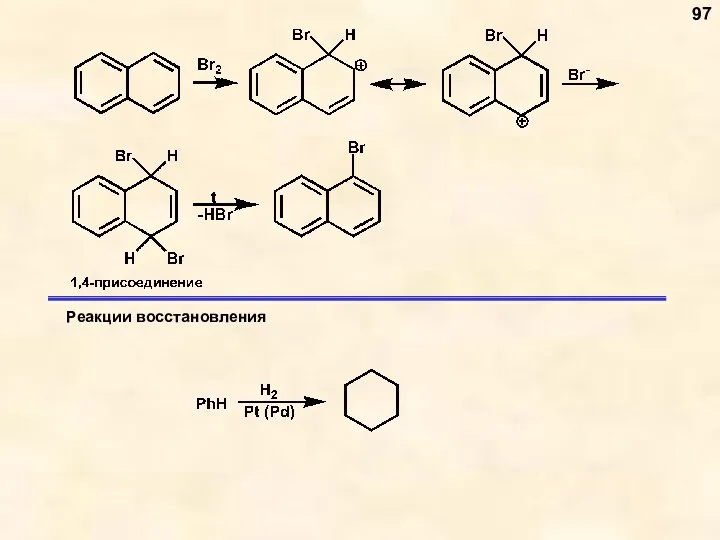
- 97. 97
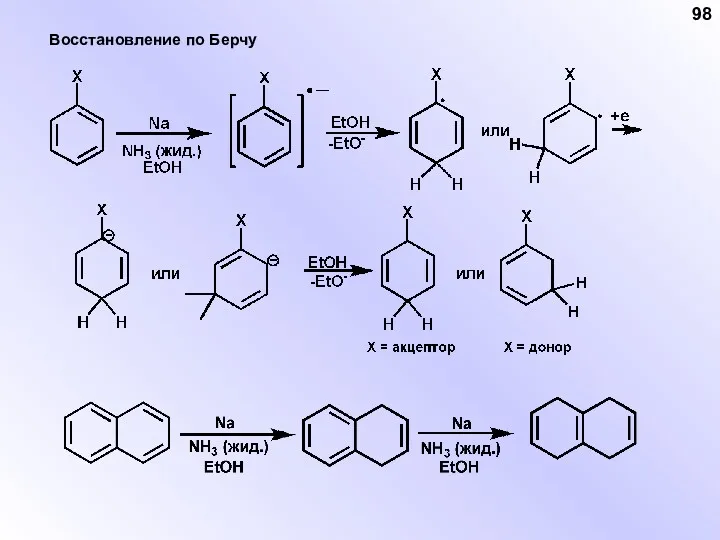
- 98. Восстановление по Берчу 98
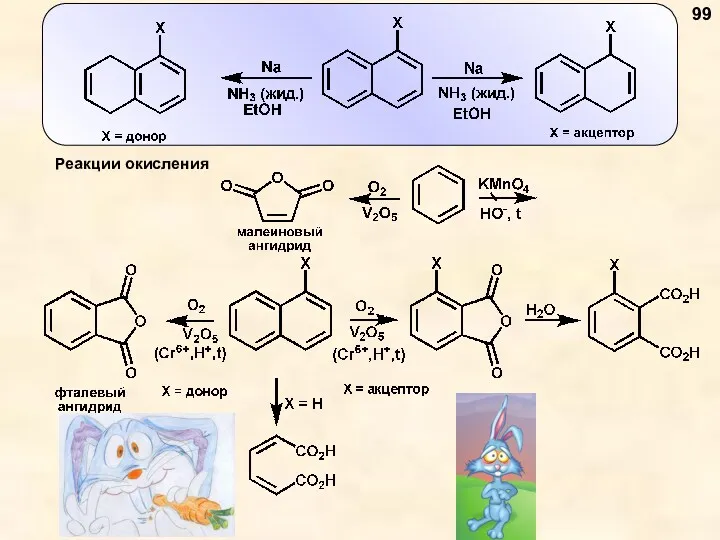
- 99. 99
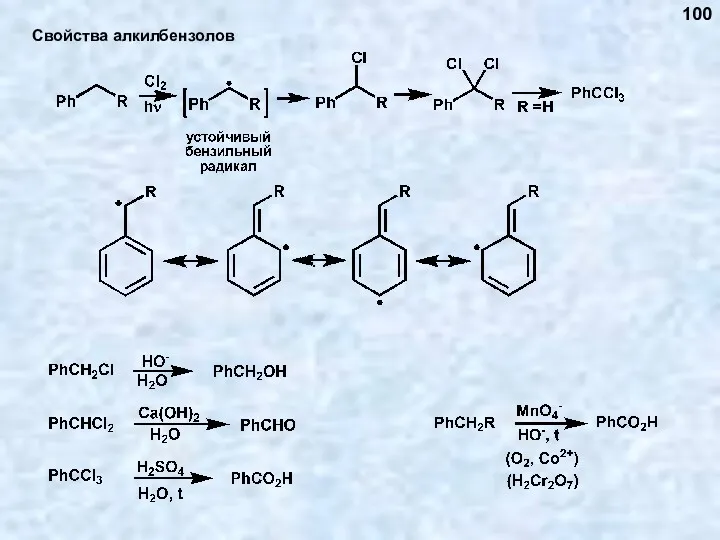
- 100. Свойства алкилбензолов 100
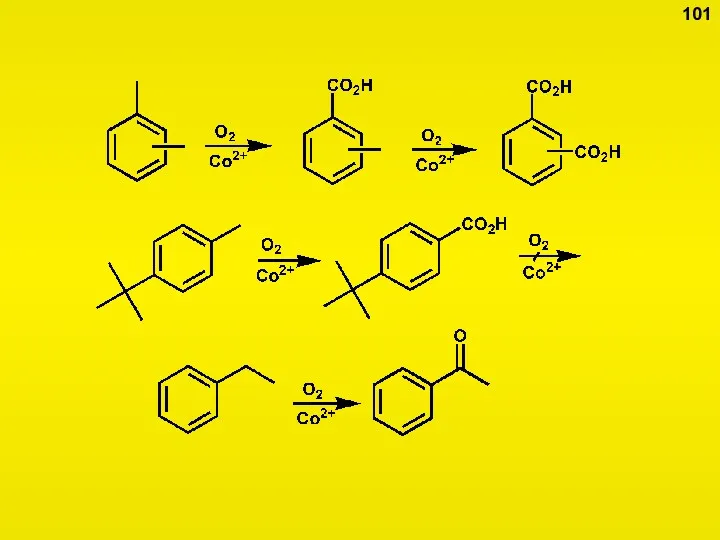
- 101. 101
- 103. Скачать презентацию



 Биосенсорные системы
Биосенсорные системы Қанықпаған майлар және соның негізіндегі БАЗ
Қанықпаған майлар және соның негізіндегі БАЗ Оксиды азота. Азотная кислота
Оксиды азота. Азотная кислота Соединения щелочных металлов
Соединения щелочных металлов ООО Ангарский Азотно-туковый завод. Основы производства аммиака
ООО Ангарский Азотно-туковый завод. Основы производства аммиака Классы неорганических веществ
Классы неорганических веществ Задачи на электролиз. 11 класс
Задачи на электролиз. 11 класс Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Тамақ өнімдерінің құрылымын және физико-химиялық қасиеттерін өзгертетін тағамдық қоспалар
Тамақ өнімдерінің құрылымын және физико-химиялық қасиеттерін өзгертетін тағамдық қоспалар Методи добування у промисловості
Методи добування у промисловості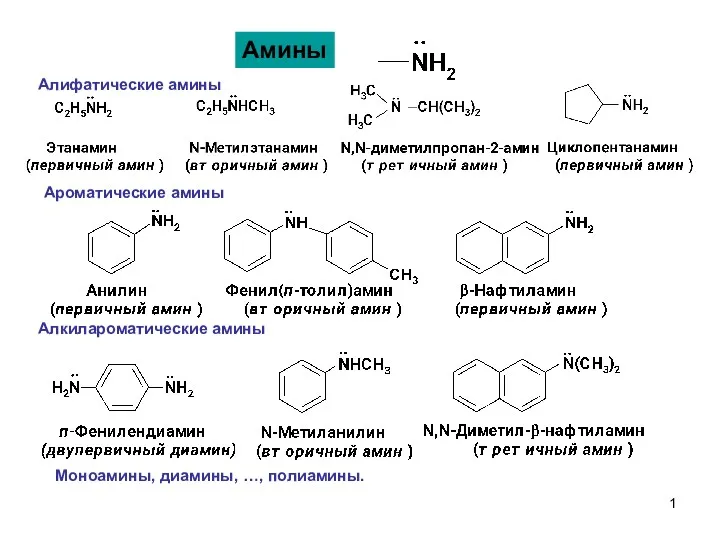 Амины-1
Амины-1 Жидкие кристаллы
Жидкие кристаллы Пластмассы
Пластмассы 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 Хімія в житті людини
Хімія в житті людини Приготовление раствора сахара и расчёт его массовой доли в растворе. Практическая работа
Приготовление раствора сахара и расчёт его массовой доли в растворе. Практическая работа Комплексті қосылыстар және олардың биологиялық маңызы
Комплексті қосылыстар және олардың биологиялық маңызы Предельные углеводороды и их производные
Предельные углеводороды и их производные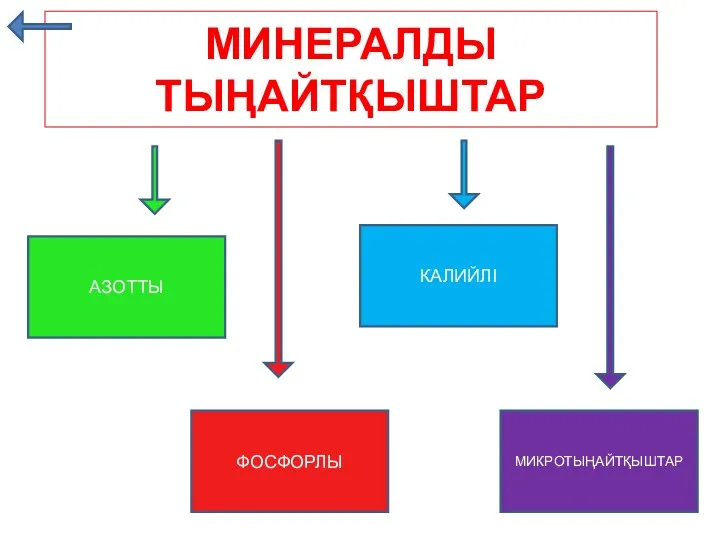 Минералды тыңайтқыштар
Минералды тыңайтқыштар Возникновение и развитие органической химии. Теория химического строения. Структурные формулы
Возникновение и развитие органической химии. Теория химического строения. Структурные формулы Др
Др Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома Sources of alkanes and cycloalkanes. Crude oil
Sources of alkanes and cycloalkanes. Crude oil Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Вода. Растворимость, растворы
Вода. Растворимость, растворы