Содержание
- 2. Оксиды азота N2O Оксид азота (I) Веселящий газ Запах сладковатый, Т кип = -88,50С, Т пл.
- 3. NO2 Оксид азота(IV) Бурый газ Диоксид азота N2O5 Оксид азота(V) Азотный ангидрид Цвет бурый, запах резкий,
- 4. Историческая справка Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4
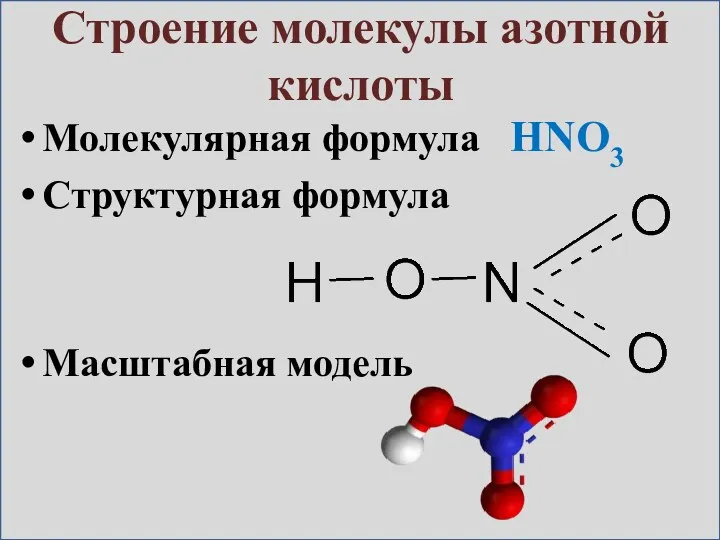
- 5. Строение молекулы азотной кислоты Молекулярная формула HNO3 Структурная формула Масштабная модель
- 6. Физические свойства Бесцветная, дымящаяся.При долгом стоянии на свету желтеет из-за частичного разложения. 4HNO3=2Н2О+ 4NO2↑+O2↑ концентрированная азотная
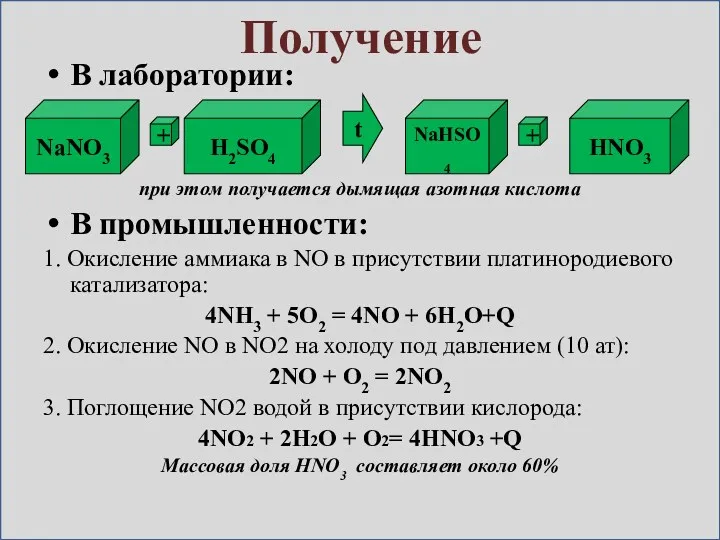
- 7. Получение В лаборатории: при этом получается дымящая азотная кислота В промышленности: 1. Окисление аммиaка в NO
- 8. Химические свойства Общие с другими кислотами; Специфические свойства.
- 9. Общие с другими кислотами: 1. Сильный электролит, хорошо диссоциируют на ионы HNO3 ↔ H+ +NO3- Изменяет
- 10. Специфические: 1.Разлагается на свету при нагревании: 4HNO3 = 2H2O + 4NO2 ↑ + O2↑ 2. Азотная
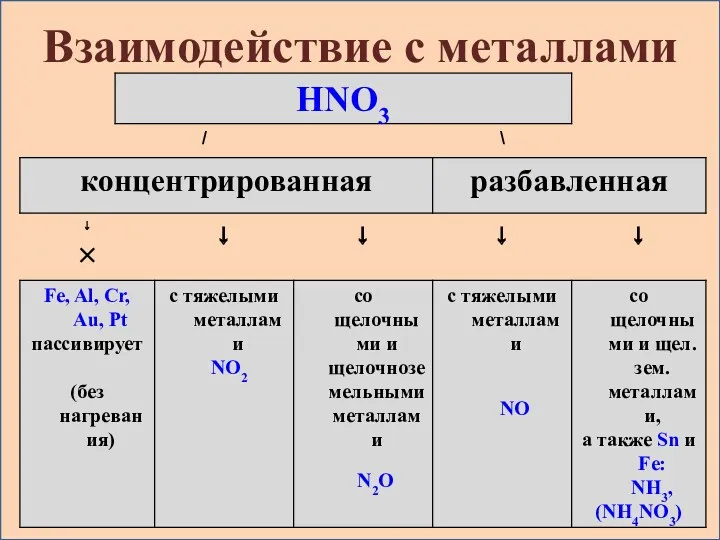
- 11. Взаимодействие с металлами
- 12. Применение производство азотных и комбинированных удобрений; взрывчатых веществ (тринитротолуола и др.); органических красителей; как окислитель ракетного
- 14. Скачать презентацию








 Железо как химический элемент
Железо как химический элемент Химические реакторы
Химические реакторы Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях
Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях Термохімічні рівняння
Термохімічні рівняння Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Фракционная перегонка нефти
Фракционная перегонка нефти Химия. D-элементтер
Химия. D-элементтер Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Застосуванння електролiзу
Застосуванння електролiзу Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Углекислый газ
Углекислый газ Изомеры и гомологи
Изомеры и гомологи Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях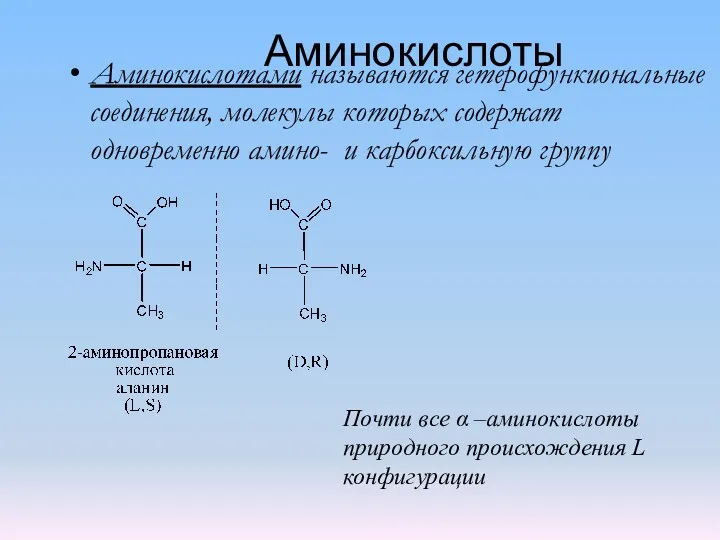 Аминокислоты 1
Аминокислоты 1 Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Мембранное материаловедение
Мембранное материаловедение Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Химические свойства металлов
Химические свойства металлов Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Амин қышқылдар
Амин қышқылдар Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Обезвреживающая функция печени
Обезвреживающая функция печени Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота