Слайд 2

Задача 1.
Водный раствор гидроксида натрия подвергли электролизу (сила тока 10 ампер,
время электролиза 1 час). Определите количество веществ, выделившихся на электродах.
Слайд 3

Задача 2.
При электролизе расплава хлорида двухвалентного металла (сила тока 10 А,
время 10 минут) на катоде выделилось 1.24 г металла. Хлорид, какого металла был взят?
Слайд 4

Задача 3.
При полном электролизе нитрата меди (II) из 2 л его
расплава (плотностью 1,05 г/мл) выделилось 6,72 л (н.у) газа. Рассчитайте процентное содержание начального раствора.
Слайд 5

Задача 4.
При электролизе 100г 5% раствора серной кислоты на катоде выделилось
56л (н.у.) газа. Рассчитайте массу анодного продукта и массовую долю кислоты в конечном растворе.
Слайд 6

Задача 5.
Расплав хлорида кальция подвергли электролизу в течении 2 часов, при
силе тока 5 А. полученный металл прореагировал с водой массой 2 кг. Какой концентрации р-р щелочи получился при этом?





 Полиэтилен
Полиэтилен Химический элемент вольфрам
Химический элемент вольфрам Термический анализ
Термический анализ Щелочноземельные металлы
Щелочноземельные металлы Качественный анализ. Таблица растворимости соединений
Качественный анализ. Таблица растворимости соединений Железо. Положение в ПСХЭ. Строение атома. 9 класс
Железо. Положение в ПСХЭ. Строение атома. 9 класс Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы
Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы Строение атома. 8 класс
Строение атома. 8 класс Гетероциклические соединения
Гетероциклические соединения Алюминий. Группы элементов
Алюминий. Группы элементов Химические свойства металлов
Химические свойства металлов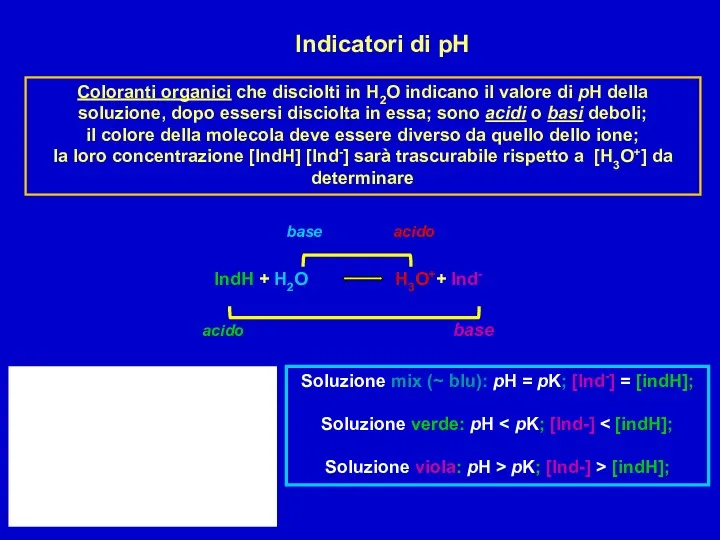 Indicatori di pH
Indicatori di pH Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Additives for Polymeric Materials
Additives for Polymeric Materials Химическая кинетика
Химическая кинетика Синтез, фото- и ионохромные свойства спиропиранов на основе гидроксихинолинового альдегида
Синтез, фото- и ионохромные свойства спиропиранов на основе гидроксихинолинового альдегида Электролиз водных растворов
Электролиз водных растворов Стехиометрия и классификация твердых веществ
Стехиометрия и классификация твердых веществ Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы)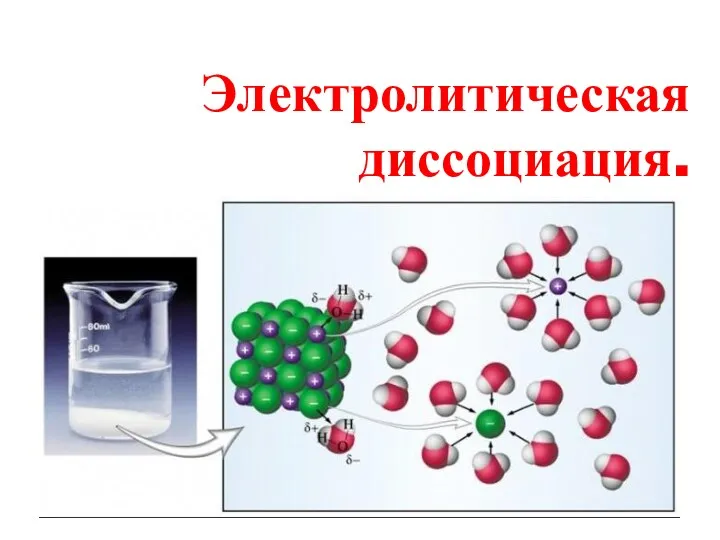 Электролитическая диссоциация
Электролитическая диссоциация Теория строения органических веществ А.М. Бутлеров
Теория строения органических веществ А.М. Бутлеров Химические методы синтеза наночастиц
Химические методы синтеза наночастиц Карбонові кислоти
Карбонові кислоти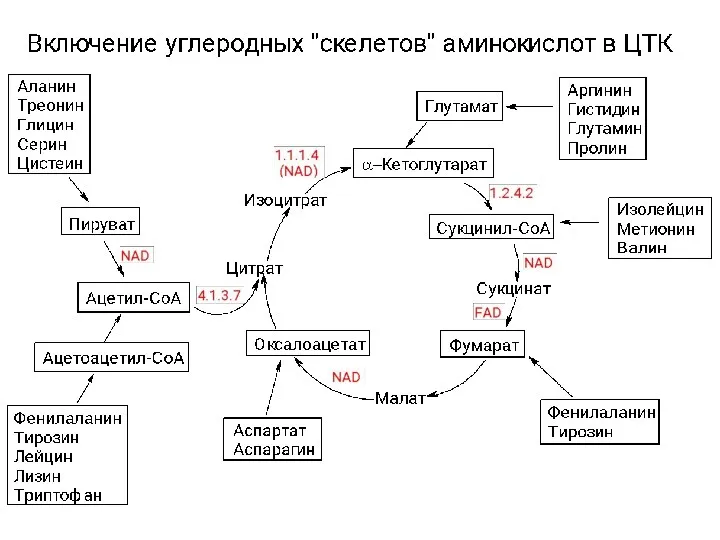 Катаболизм аминокислот
Катаболизм аминокислот Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу Углеводы. Общая формула углеводов Сn(H2O)m
Углеводы. Общая формула углеводов Сn(H2O)m Композиционные материалы
Композиционные материалы