Содержание
- 2. Гетероциклические соединения – это такие соединения, молекулы которых содержат циклы (кольца) состоящие не только из атомов
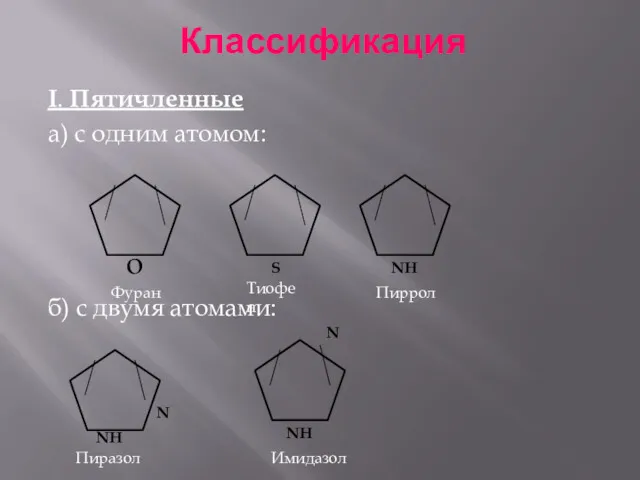
- 3. Классификация I. Пятичленные а) с одним атомом: б) с двумя атомами: Фуран Тиофен Пиррол Пиразол N
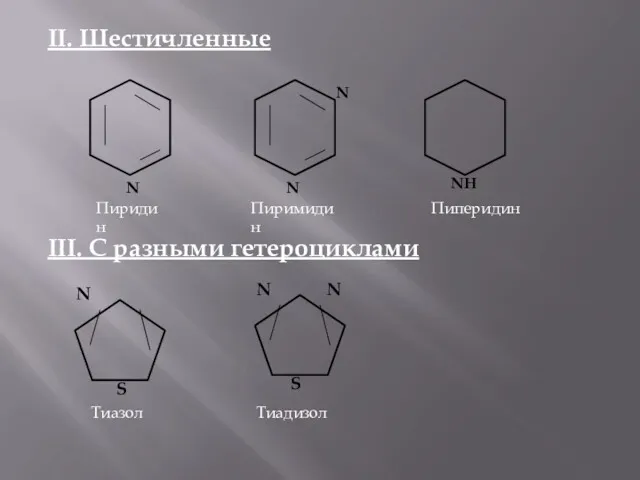
- 4. II. Шестичленные III. С разными гетероциклами N Пиридин N N Пиримидин NH Пиперидин S N Тиазол
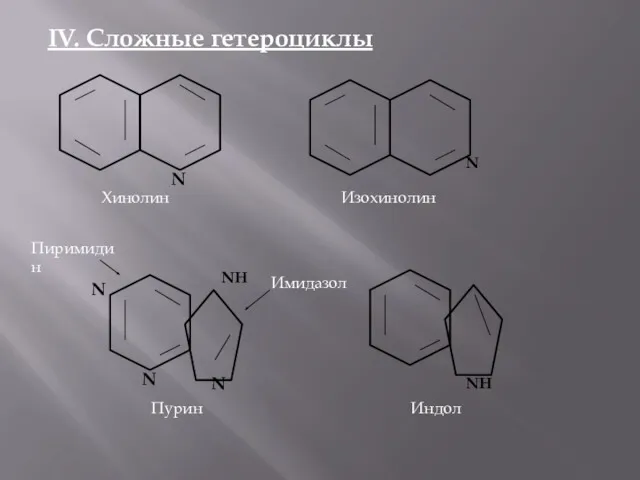
- 5. IV. Сложные гетероциклы N Хинолин N Изохинолин NH N N N Пурин Пиримидин Имидазол NH Индол
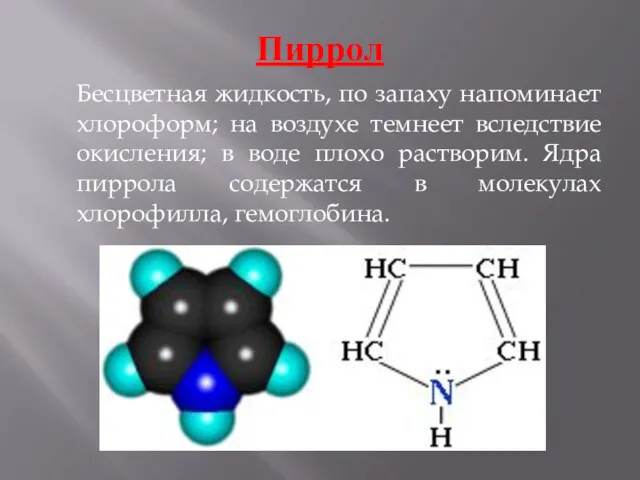
- 6. Пиррол Бесцветная жидкость, по запаху напоминает хлороформ; на воздухе темнеет вследствие окисления; в воде плохо растворим.
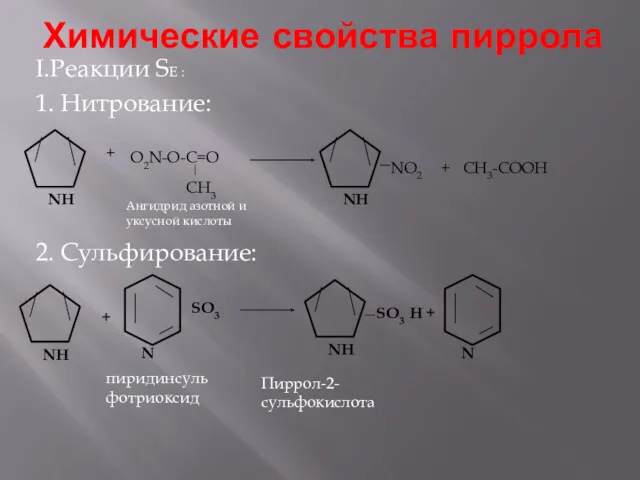
- 7. Химические свойства пиррола I.Реакции SE : 1. Нитрование: 2. Сульфирование: + пиридинсульфотриоксид + Пиррол-2-сульфокислота O2N-O-C=O CH3
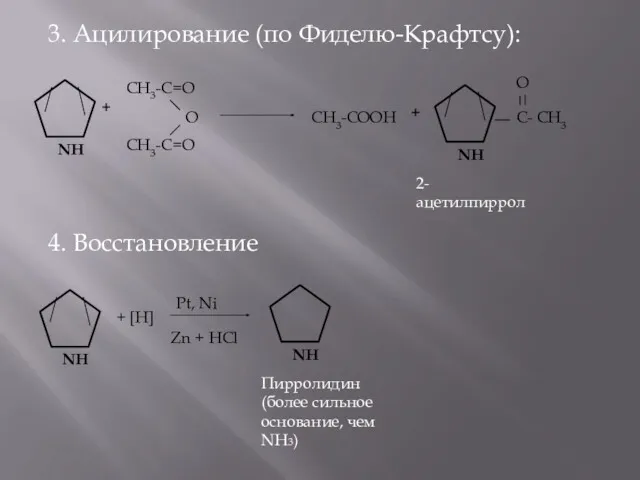
- 8. 3. Ацилирование (по Фиделю-Крафтсу): 4. Восстановление + CH3-C=O CH3-C=O О CH3-COOH + C- CH3 О +
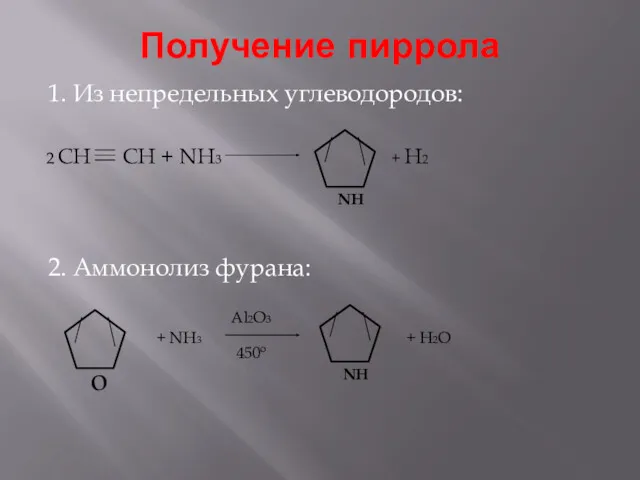
- 9. Получение пиррола 1. Из непредельных углеводородов: 2. Аммонолиз фурана: 2 CH CH + NH3 + H2
- 10. Фуран Бесцветная легкокипящая жидкость. По химическим свойствам напоминает пиррол; также кислотоустойчив. Ароматичность выражена слабее, чем у
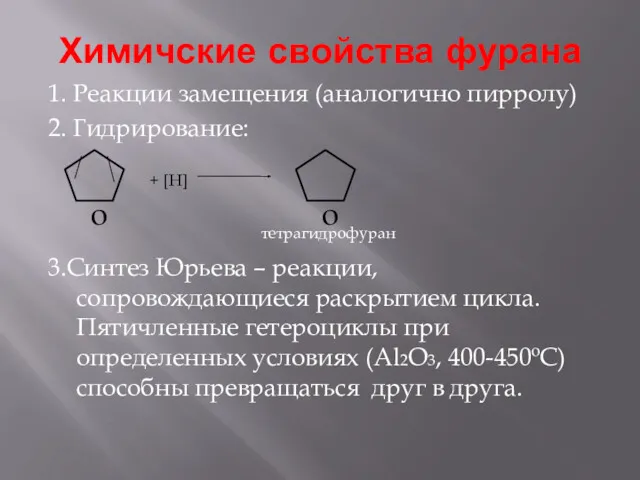
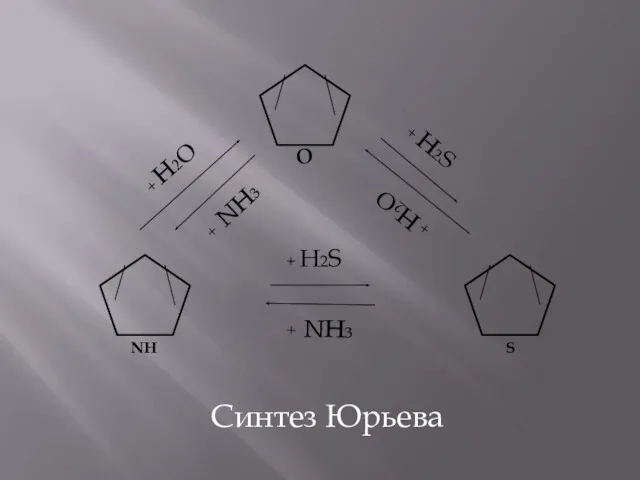
- 11. Химичские свойства фурана 1. Реакции замещения (аналогично пирролу) 2. Гидрирование: 3.Синтез Юрьева – реакции, сопровождающиеся раскрытием
- 12. Синтез Юрьева
- 13. Фурфурол Маслянистая жидкость с запахом ржаного хлеба. Получают из непищевых полисахаридов (отходы древесины, салола и т.д.)
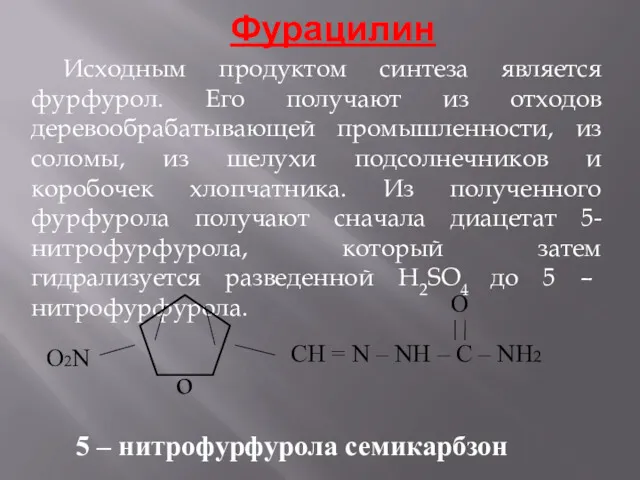
- 14. Фурацилин Исходным продуктом синтеза является фурфурол. Его получают из отходов деревообрабатывающей промышленности, из соломы, из шелухи
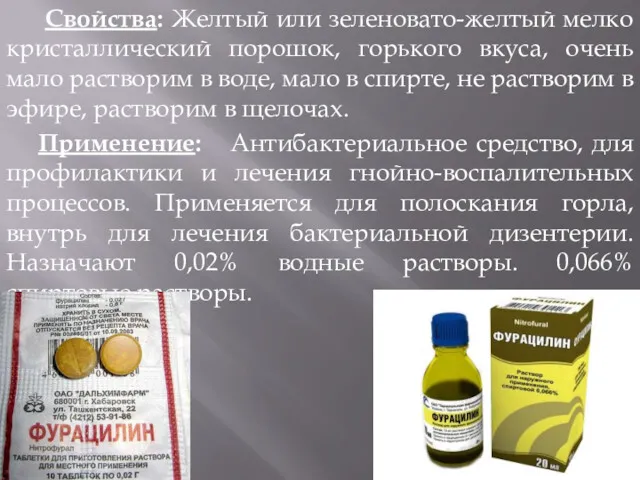
- 15. Свойства: Желтый или зеленовато-желтый мелко кристаллический порошок, горького вкуса, очень мало растворим в воде, мало в
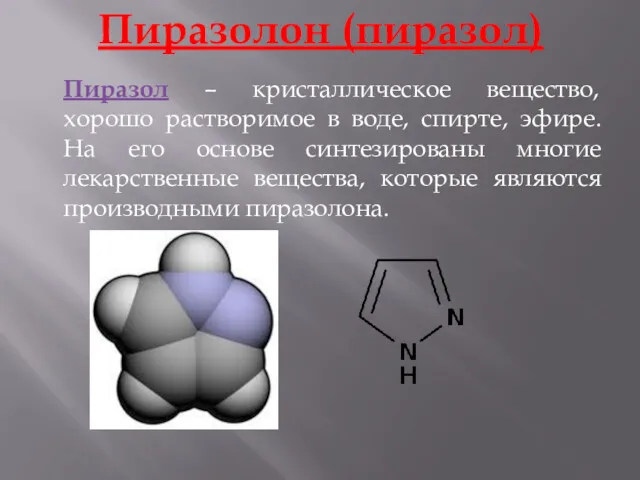
- 16. Пиразолон (пиразол) Пиразол – кристаллическое вещество, хорошо растворимое в воде, спирте, эфире. На его основе синтезированы
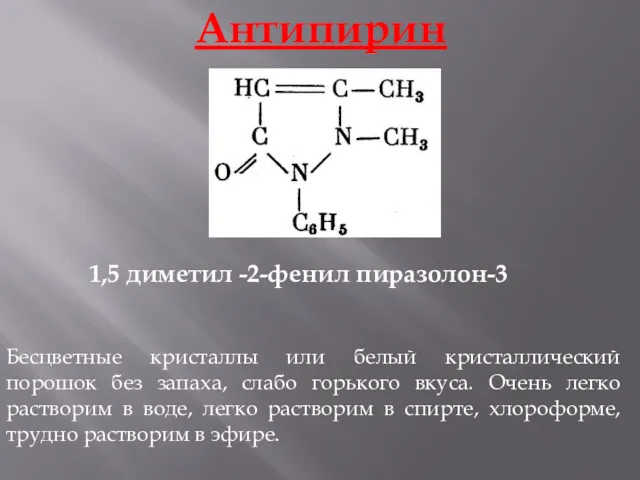
- 17. Антипирин Бесцветные кристаллы или белый кристаллический порошок без запаха, слабо горького вкуса. Очень легко растворим в
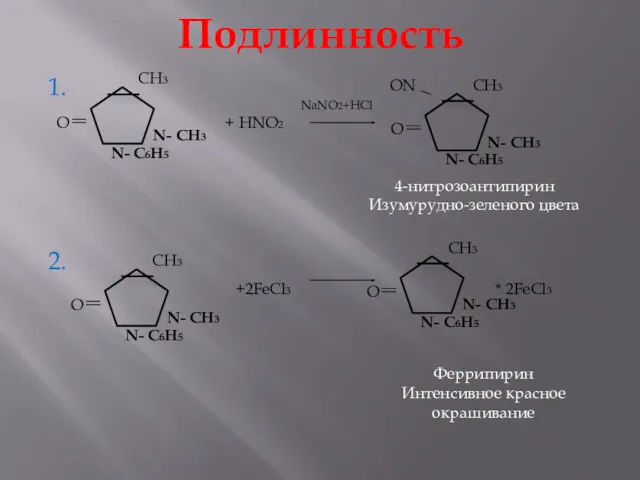
- 18. Подлинность 1. 2. + HNO2 4-нитрозоантипирин Изумурудно-зеленого цвета +2FeCl3 * 2FeCl3 Феррипирин Интенсивное красное окрашивание NaNO2+HCl
- 19. Применение антипирина Как болеутоляющее, жаропонижающее, противовоспалительное. Применяется при головной боли, невралгии, ревматизме, при простудных заболеваниях.
- 20. Анальгин * H2O 1,5-диметил, 2-фенил, 4 – метиламинопиразолон – 3 – п– метансульфонат натрия моногидрат Белый
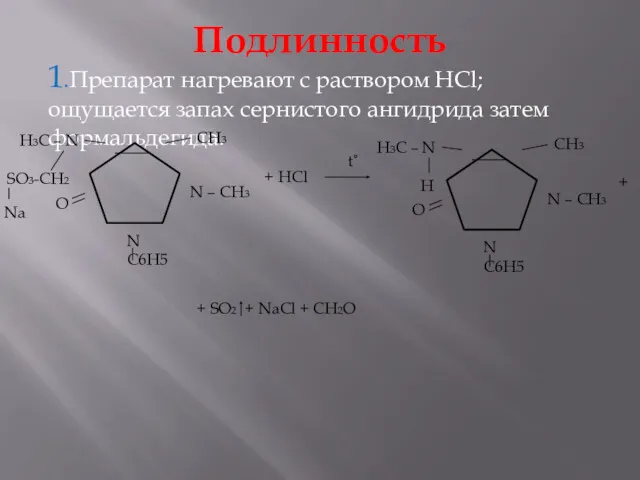
- 21. Подлинность 1.Препарат нагревают с раствором HCl; ощущается запах сернистого ангидрида затем формальдегида. + HCl + +
- 22. 2. Реакция окисления анальгина KJO3 (c KJO3 реагирует образующийся при гидролизе с соляной кислотой диоксид серы):
- 24. Скачать презентацию





 Автомобильные бензины
Автомобильные бензины Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Щелочные металлы
Щелочные металлы Химические свойства серной кислоты
Химические свойства серной кислоты Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Природный каучук
Природный каучук История открытия химических веществ
История открытия химических веществ Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Аурум
Аурум Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Алкены
Алкены Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Сероводород. Сульфиды
Сероводород. Сульфиды Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Получение и приминение этилена
Получение и приминение этилена Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Сероводород. Сульфиды
Сероводород. Сульфиды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Разнообразие неметаллов
Разнообразие неметаллов Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие