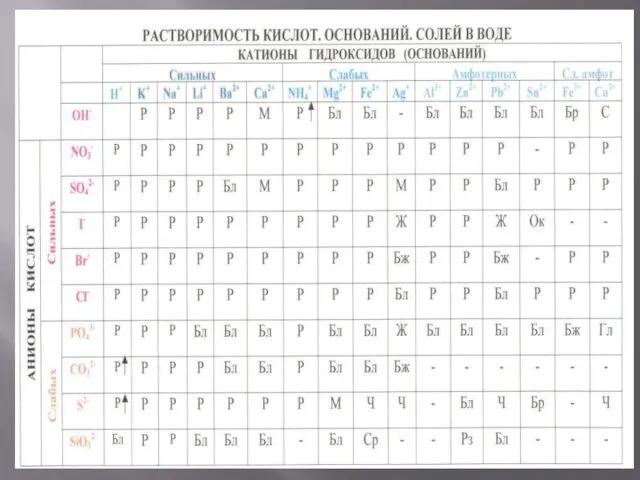
Содержание
- 3. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- 4. Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия
- 5. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
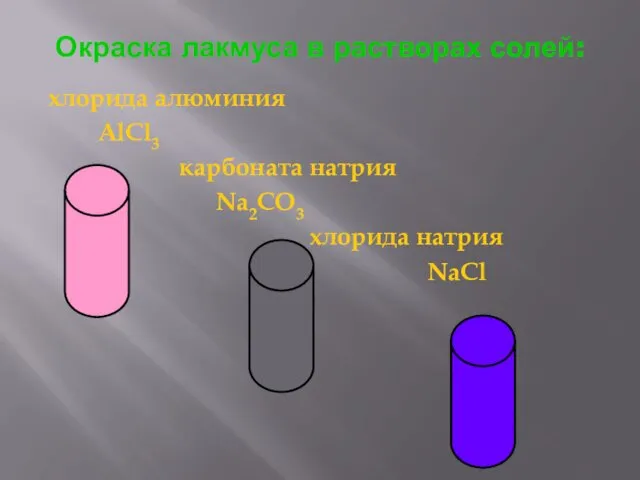
- 6. Окраска лакмуса в растворах солей: хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl
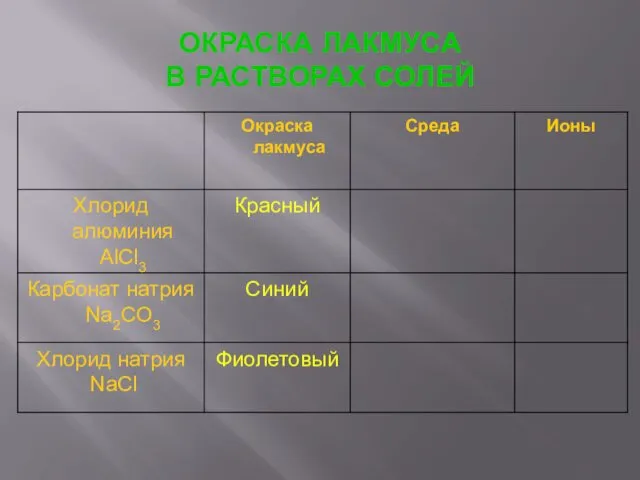
- 7. ОКРАСКА ЛАКМУСА В РАСТВОРАХ СОЛЕЙ
- 8. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
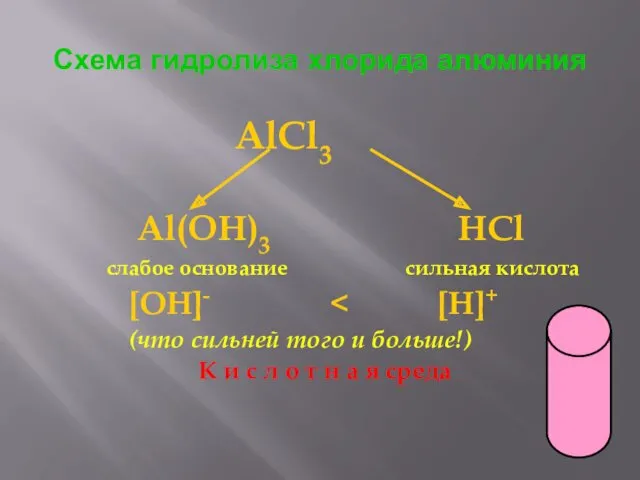
- 9. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
- 10. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
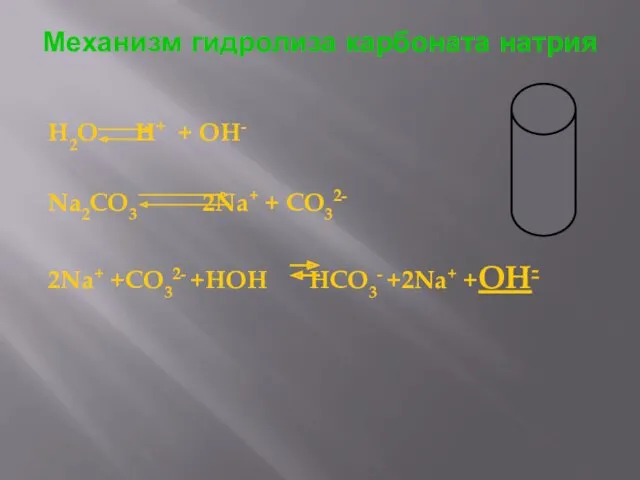
- 12. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
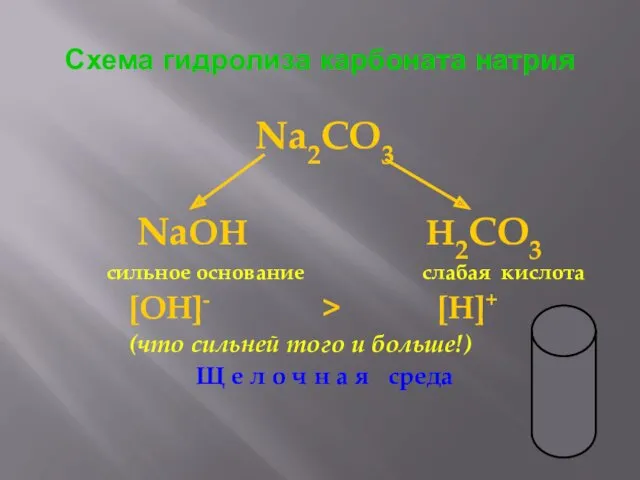
- 13. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
- 14. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 15. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
- 16. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
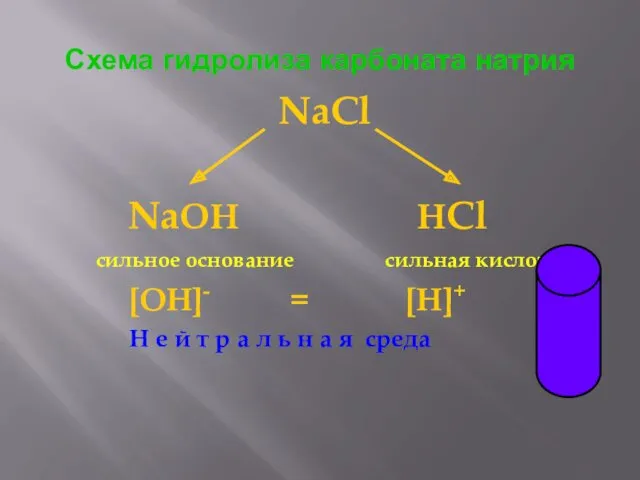
- 17. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
- 18. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
- 19. Сформулируем определение понятия «гидролиз»: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют?
- 20. ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
- 22. Самостоятельно заполните таблицу
- 23. Самостоятельно заполните таблицу
- 24. Роль гидролиза в природе Преобразование земной коры Обеспечение слабощелочной среды морской воды
- 25. Роль гидролиза в народном хозяйстве Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло,
- 26. Роль гидролиза в повседневной жизни человека Стирка Мытье посуды Умывание с мылом Процессы пищеварения
- 28. Скачать презентацию

















 Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5) Электролиз
Электролиз Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Осадительное титрование. (Лекция 27)
Осадительное титрование. (Лекция 27) Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Чистые вещества и смеси. Состав смесей. Разделение смесей
Чистые вещества и смеси. Состав смесей. Разделение смесей Типы химических реакций
Типы химических реакций Фосфорлы тыңайытқыштар
Фосфорлы тыңайытқыштар Полусинтетическое масло
Полусинтетическое масло Основания. Названия оснований
Основания. Названия оснований Растворы. Классификация
Растворы. Классификация Скорость химических реакций
Скорость химических реакций Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Заттардың формулалары және химиялық реакция теңдеулері
Заттардың формулалары және химиялық реакция теңдеулері Щелочноземельные металлы
Щелочноземельные металлы Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Углеводы. 10 класс
Углеводы. 10 класс Атомдар мен молекулалар
Атомдар мен молекулалар Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Химические свойста воды
Химические свойста воды Основания. Классификация оснований
Основания. Классификация оснований Why use plastics
Why use plastics Соединения химических элементов
Соединения химических элементов Способи очищення води
Способи очищення води