Содержание
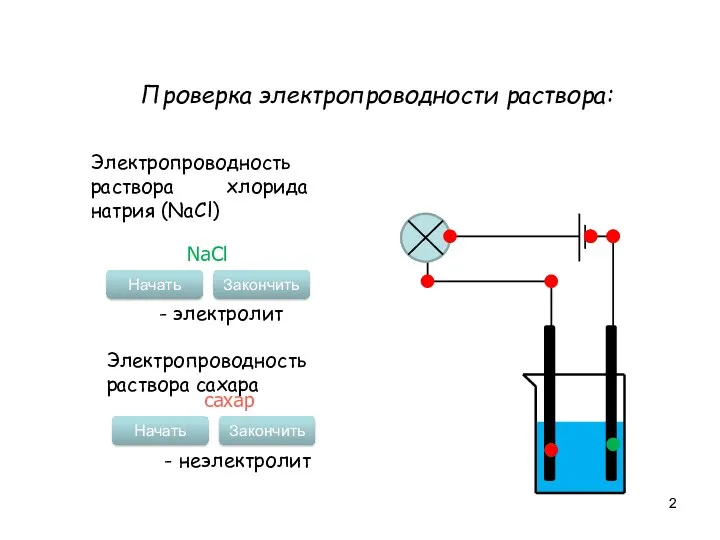
- 2. Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl) Начать Закончить NaCl - электролит Электропроводность раствора сахара
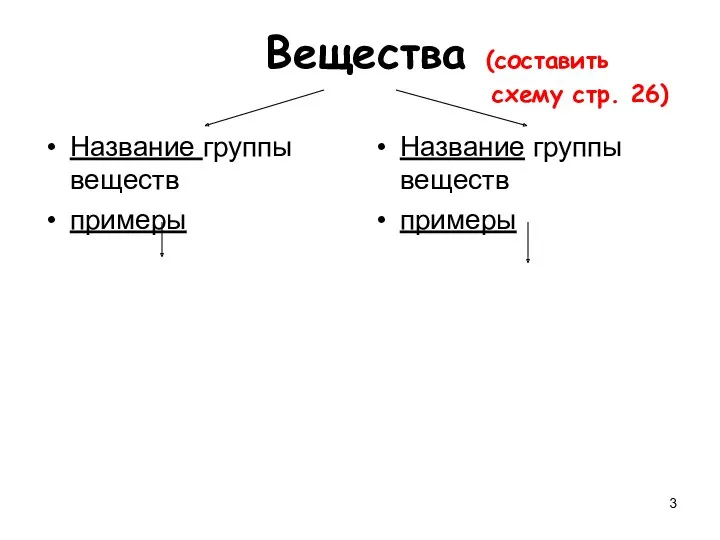
- 3. Вещества (составить схему стр. 26) Название группы веществ примеры Название группы веществ примеры
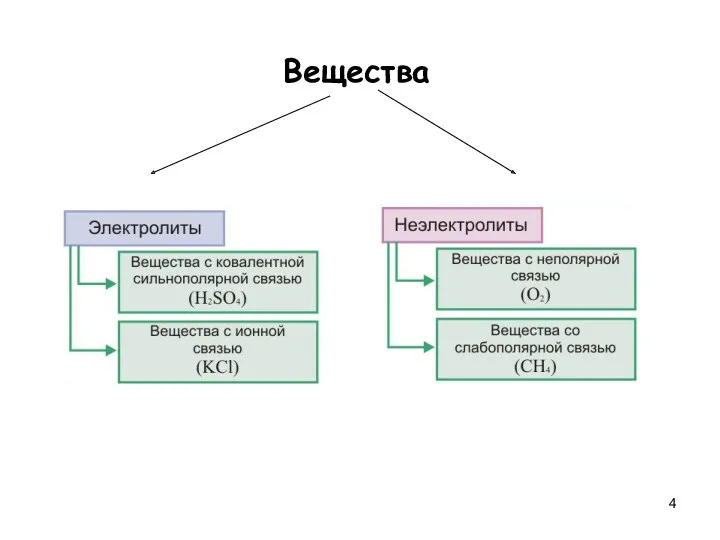
- 4. Вещества
- 5. Задание. Из предложенного списка выбери вещества, которые относятся к электролитам. 1) HCl; 6) H2SO4; 2) N2;
- 6. Электролитическая диссоциация - (написать определение - низ стр. 26, вверх стр.27) Сванте Август Аррениус 1859-1927гг. Шведский
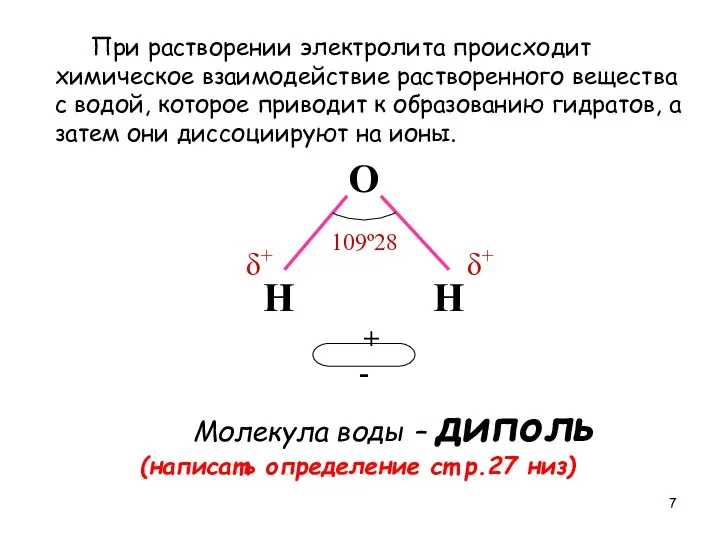
- 7. При растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а
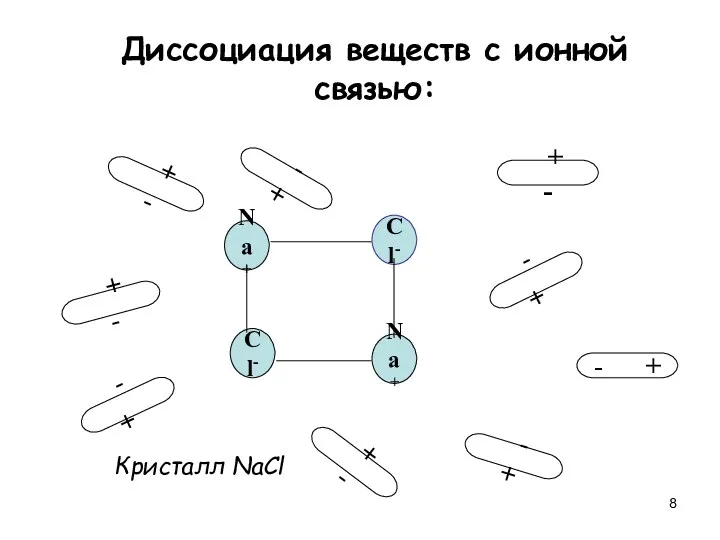
- 8. Диссоциация веществ с ионной связью: Na+ Cl- Cl- Na+ + - + - + - -
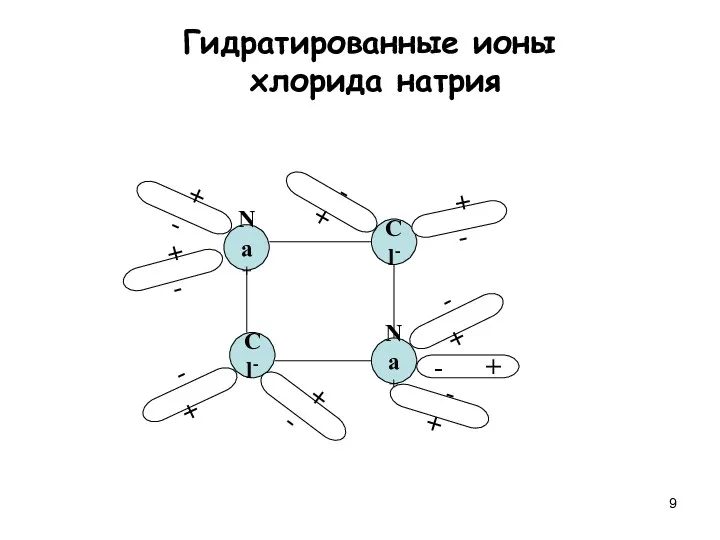
- 9. Na+ Cl- Cl- Na+ + - + - + - - + - + - +
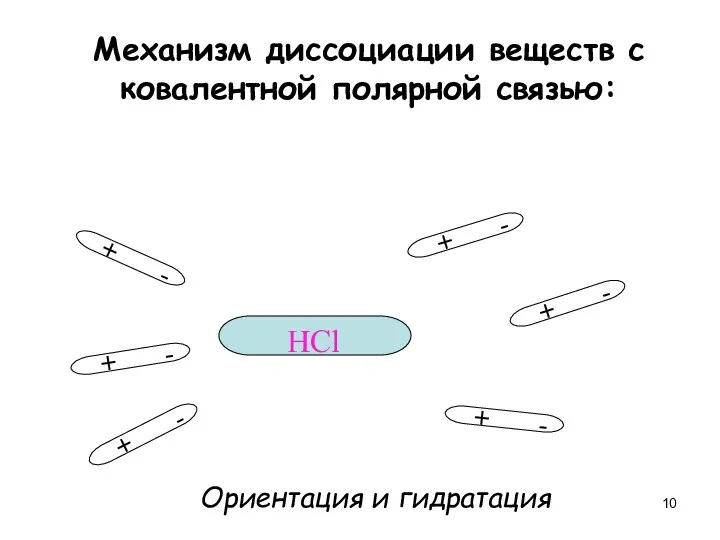
- 10. Механизм диссоциации веществ с ковалентной полярной связью: + - + - + - + - +
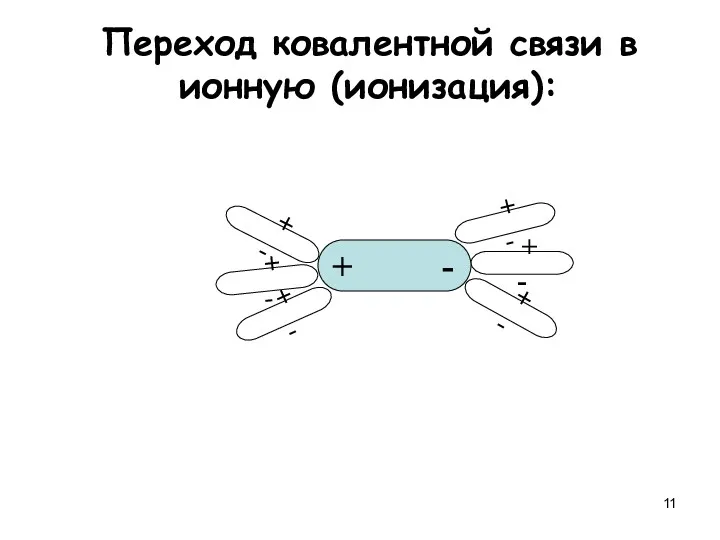
- 11. Переход ковалентной связи в ионную (ионизация): + - + - + - + - + -
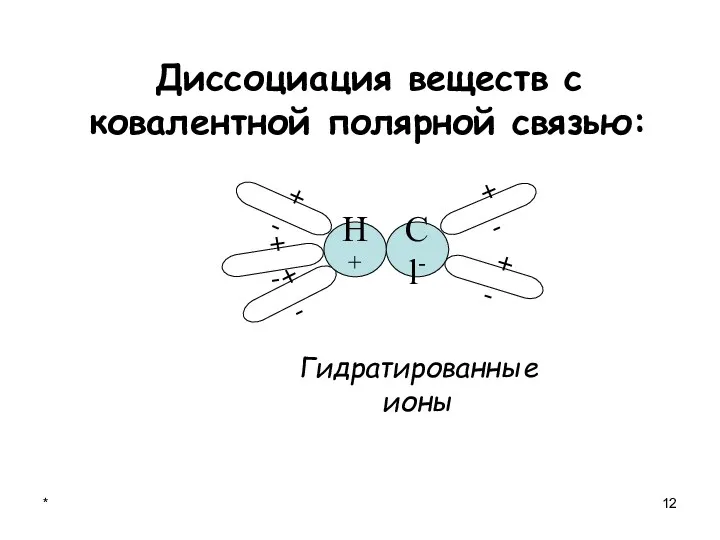
- 12. * Диссоциация веществ с ковалентной полярной связью: + - + - + - + - Гидратированные
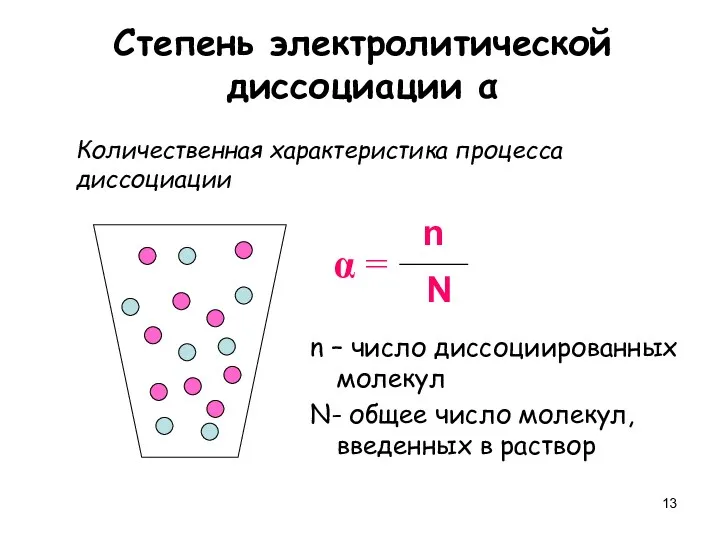
- 13. Степень электролитической диссоциации α Количественная характеристика процесса диссоциации n – число диссоциированных молекул N- общее число
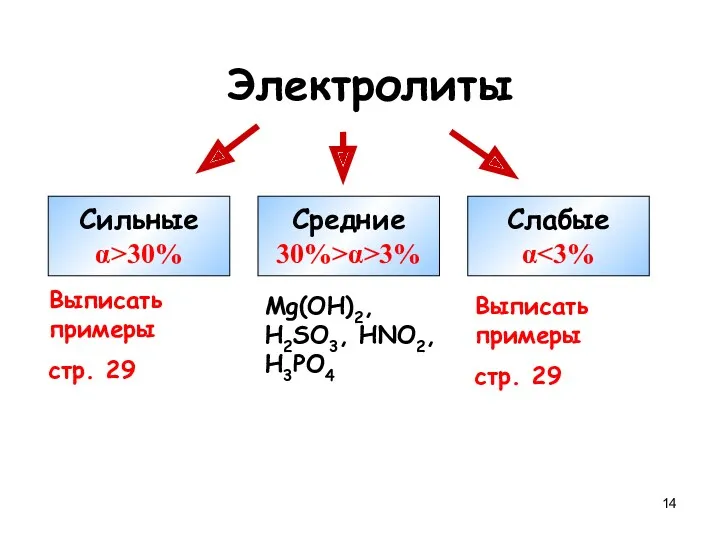
- 14. Электролиты Сильные α>30% Средние 30%>α>3% Слабые α Выписать примеры стр. 29 Mg(OH)2, H2SO3, HNO2, H3PO4 Выписать
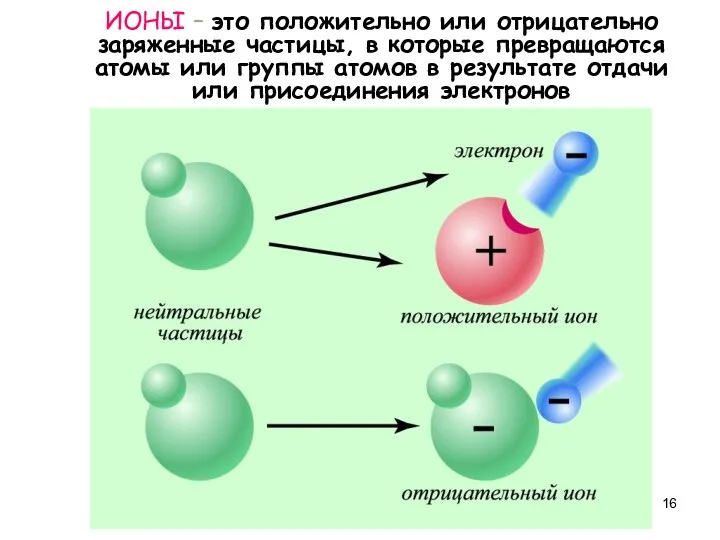
- 16. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
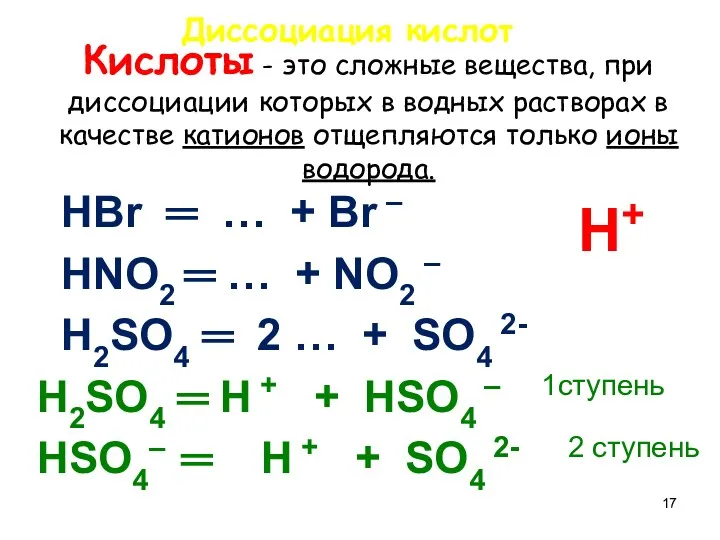
- 17. Кислоты - это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только
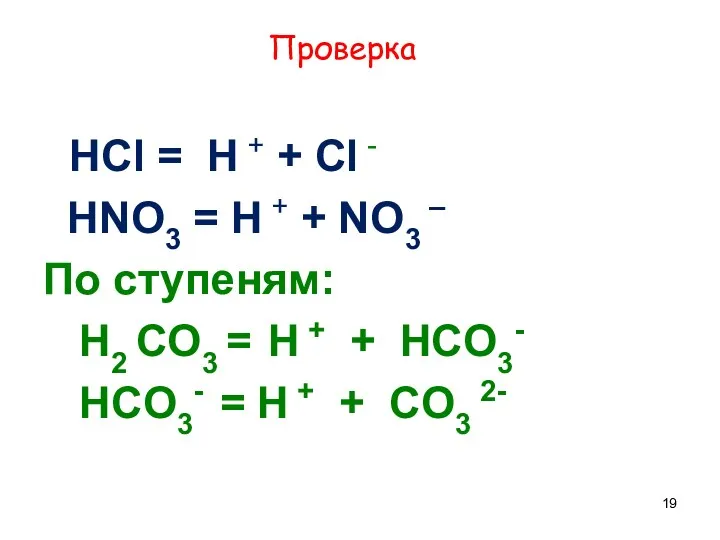
- 18. Напишите уравнения диссоциации кислот, назовите их HCl = … + … HNO3 = … + …
- 19. Проверка HCl = H + + Cl - HNO3 = H + + NO3 – По
- 20. Основания - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только
- 21. Напишите уравнения диссоциации оснований, назовите их KOH = … + … Ca(OH)2 = … + …
- 22. Проверка KOH = K + + OH – Ca(OH)2 = Ca 2+ + 2OH – LiOH
- 23. Диссоциация солей Соли -это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы
- 24. KCl = … + … Na2SO4 = … + … Fe(NO3)3 = … + … Напишите
- 25. KCl = K + + Cl - Na2SO4 = 2 Na + + SO4 2- Fe(NO3)3
- 26. * Задание. Пользуясь таблицей растворимости, определите, водные растворы каких веществ будут диссоциировать на ионы: КСl, CuO,
- 27. * Задание. Пользуясь таблицей растворимости, определите, водные растворы каких веществ будут диссоциировать на ионы: КСl, CuO,
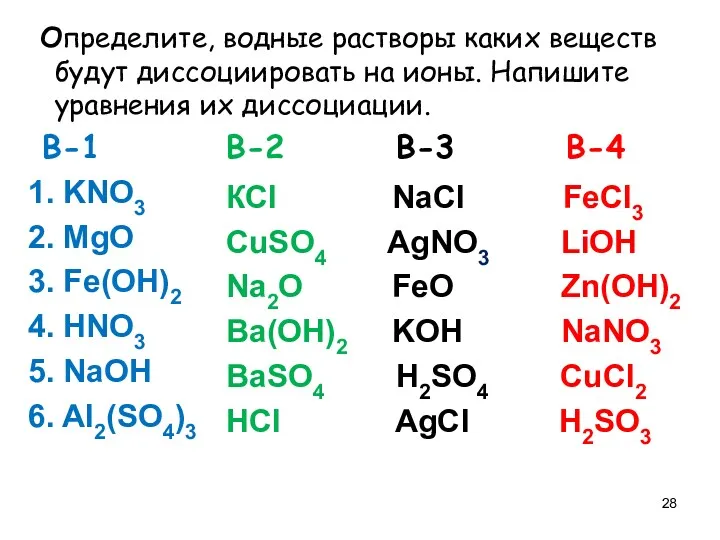
- 28. Определите, водные растворы каких веществ будут диссоциировать на ионы. Напишите уравнения их диссоциации. В-1 В-2 В-3
- 29. Характерные симптомы дефицита химических элементов в организме человека
- 30. * Что называют электролитической диссоциацией? Какие вещества называют электролитами? Какие вещества к ним относятся? Какой тип
- 31. * Задание. Пользуясь таблицей растворимости, определите, водные растворы каких веществ будут диссоциировать на ионы: КСl, CuO,
- 33. Скачать презентацию


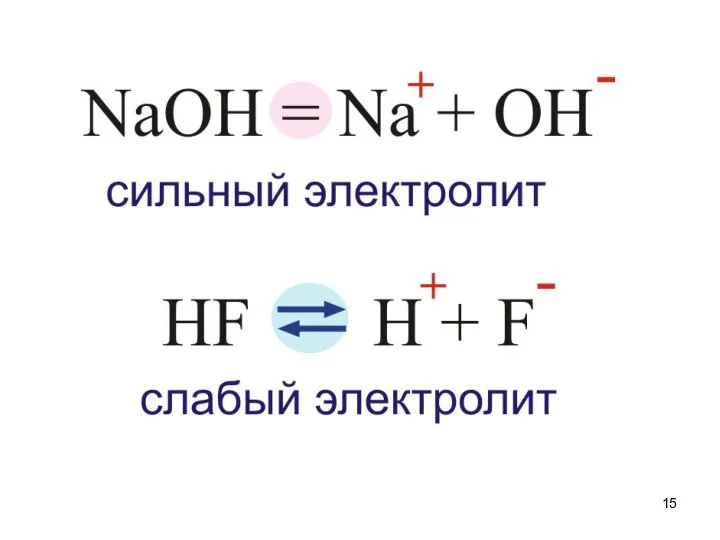












 Стратегия химической промышленности
Стратегия химической промышленности Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Геометрическая кристаллография
Геометрическая кристаллография Азотная кислота и её свойства
Азотная кислота и её свойства Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Растворение. Растворимость веществ в воде. Классификация растворов
Растворение. Растворимость веществ в воде. Классификация растворов Властивості і застосування каучуків. (Урок 15)
Властивості і застосування каучуків. (Урок 15) алкадиены
алкадиены Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации 20230419_azot
20230419_azot Строение и химические свойства кислот
Строение и химические свойства кислот Происхождение нефти
Происхождение нефти Коррозия металлов и способы ее устранения
Коррозия металлов и способы ее устранения Кафедра биохимии УГМУ в прошлом и настоящем. Локализация
Кафедра биохимии УГМУ в прошлом и настоящем. Локализация Соли. 8 класс
Соли. 8 класс Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электроотрицательность химических элементов
Электроотрицательность химических элементов Растворы. Классификация
Растворы. Классификация Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Полимерные материалы. Классификация
Полимерные материалы. Классификация Строение атома
Строение атома Виды химической связи
Виды химической связи Химические элементы
Химические элементы