Содержание
- 2. Васильева Татьяна Михайловна д.т.н. профессор департамента химии МФТИ tmvasilieva@gmail.com Лекции: среда 900 БХим Лабораторные занятия: см.
- 3. План лекционных занятий СПЕЦИАЛЬНЫЕ РАЗДЕЛЫ: Химия в современной океанологии; Химические проблемы переработки углеводородного сырья; Химические проблемы
- 4. Литература Н.С. Ахметов Общая и неорганическая химия. М.: Высш. шк., 2009 Практический курс общей химии. М.:
- 5. Строение атома Периодичность свойств элементов и их соединений Лекция 1
- 6. - Вещество можно делить лишь до тех пор, пока не будут получены его наименьшие частицы. -
- 7. Косвенные свидетельства сложности строения атомов Фотоэффект ( А.Г. Столетов, 1889 г.) Открытие рентгеновского излучения (В.К. Рентген,
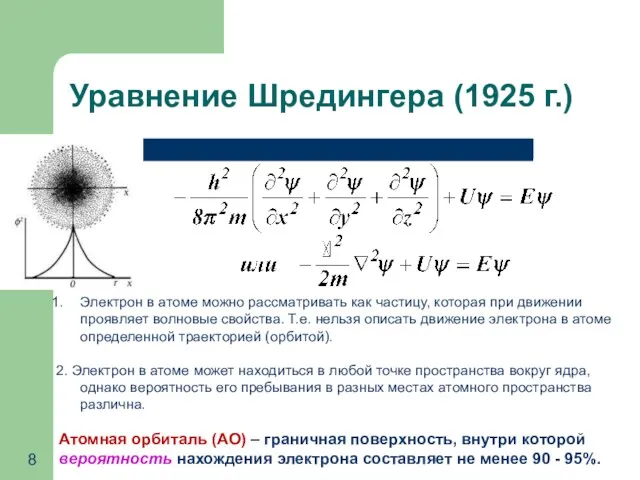
- 8. Электрон в атоме можно рассматривать как частицу, которая при движении проявляет волновые свойства. Т.е. нельзя описать
- 9. Важным следствием теории квантовой механики является то, что вся совокупность сложных движений электрона в атоме описывается
- 10. Квантовые числа: резюме С Номер периода См. слайд 11 См. слайд 11
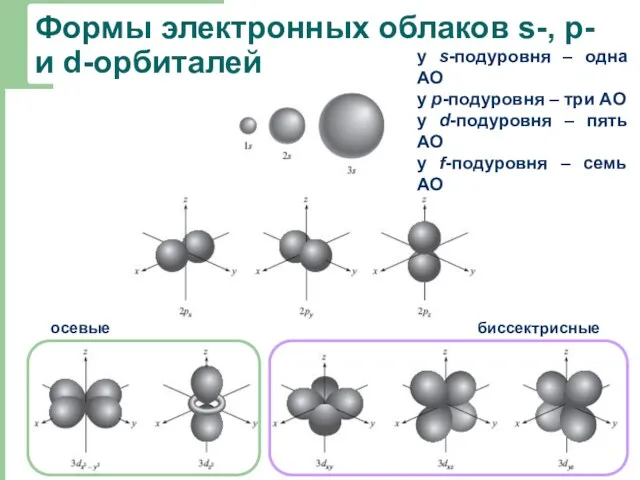
- 11. Формы электронных облаков s-, p- и d-орбиталей биссектрисные осевые у s-подуровня – одна АО у р-подуровня
- 12. Закономерности формирования электронных структур (см. также слайд 13) Принцип наименьшей энергии: электрон размещается на АО c
- 13. Наиболее устойчивые электронные конфигурации Закономерности формирования электронных структур (продолжение)
- 15. Древние химики знали только один элемент - грязь Более 100 элементов
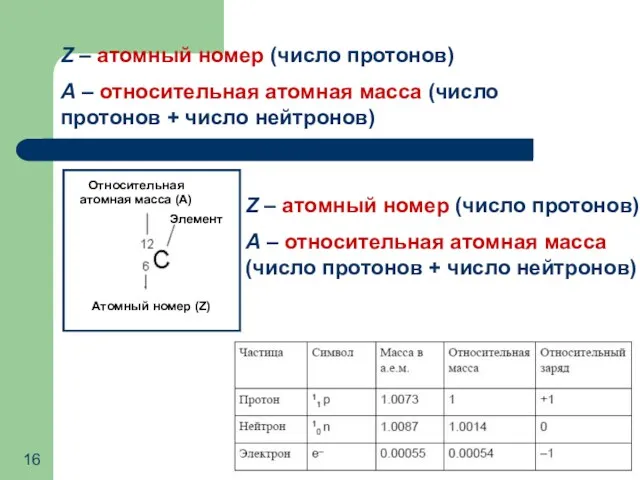
- 16. Z – атомный номер (число протонов) A – относительная атомная масса (число протонов + число нейтронов)
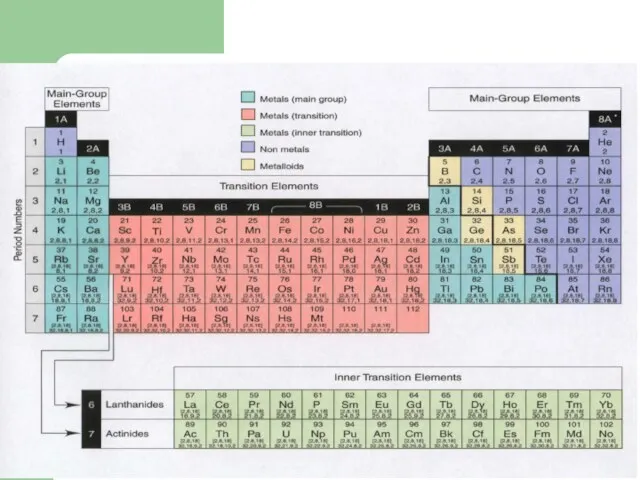
- 17. Периоды и группы
- 18. Периодичность физических свойств элементов 3-ий период Ar Cl2
- 19. Периодический закон Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости
- 20. атомные и ионные радиусы энергия ионизации сродство к электрону электроотрицательность Периодически меняющиеся свойства атомов
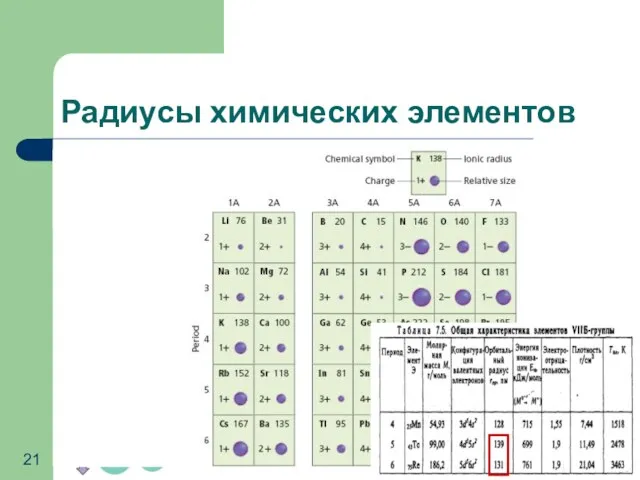
- 21. Радиусы химических элементов Радиус атома (иона) – это расстояние от ядра до максимума электронной плотности наиболее
- 22. Энергия ионизации Энергия ионизации – это энергия, необходимая для отрыва электрона от атома и превращение атома
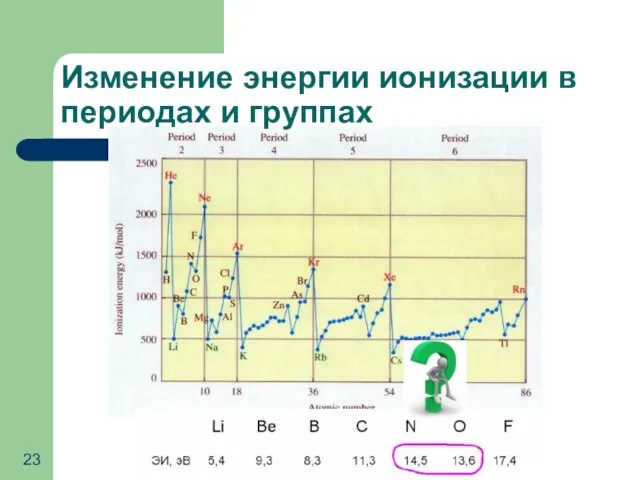
- 23. Изменение энергии ионизации в периодах и группах
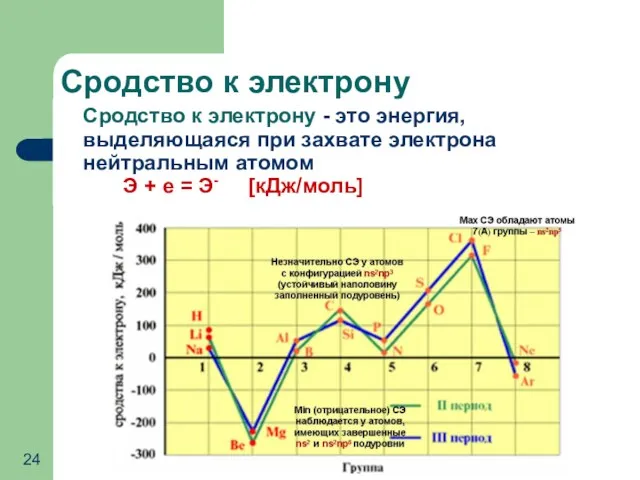
- 24. Сродство к электрону Сродство к электрону - это энергия, выделяющаяся при захвате электрона нейтральным атомом Э
- 25. Электроотрицательность Электроотрицательность - свойство атома притягивать электроны от других атомов, с которыми он образует химическую связь
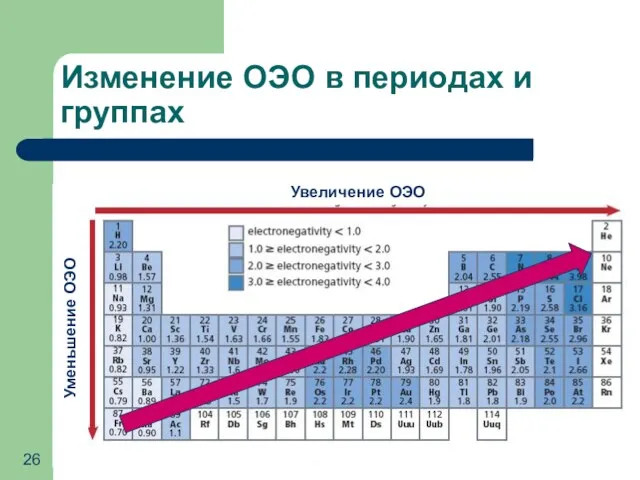
- 26. Изменение ОЭО в периодах и группах Увеличение ОЭО Уменьшение ОЭО
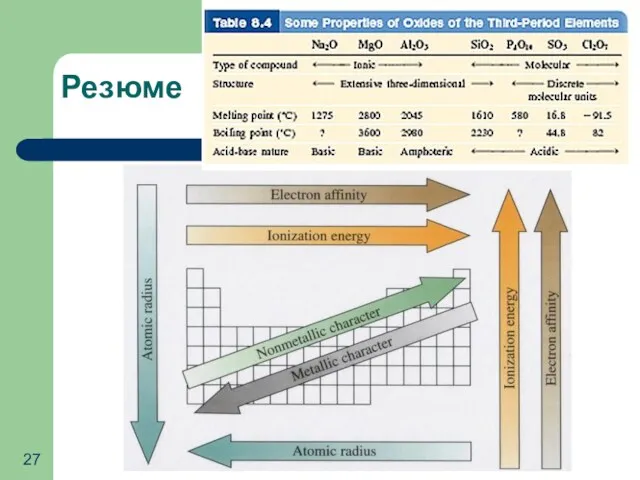
- 27. Резюме
- 28. Степень окисления Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что соединение
- 30. Скачать презентацию
















 Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Хімічні зв’язки
Хімічні зв’язки Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Реакции ионного обмена
Реакции ионного обмена Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Нефтепродукты в косметическом производстве. Биологически активные вещества
Нефтепродукты в косметическом производстве. Биологически активные вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Химическое равновесие. Необратимые и обратимые реакции
Химическое равновесие. Необратимые и обратимые реакции XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Классификация минералов. Описание физических свойств
Классификация минералов. Описание физических свойств Загрязнение почв пестицидами. Проблемы и решения
Загрязнение почв пестицидами. Проблемы и решения Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Разнообразие неметаллов
Разнообразие неметаллов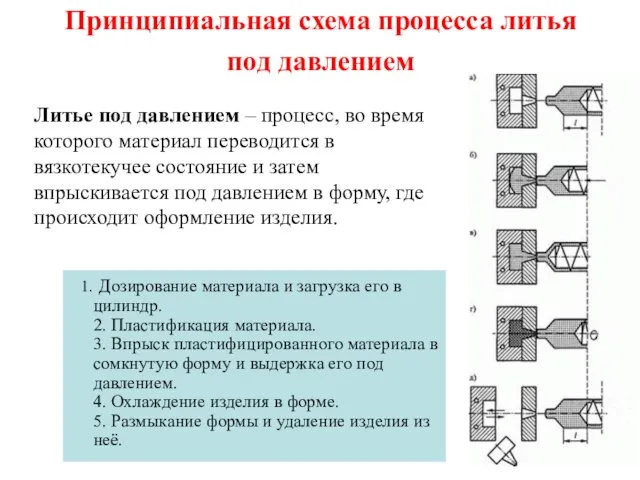 Принципиальная схема процесса литья под давлением
Принципиальная схема процесса литья под давлением Общие сведения о металлах и сплавах
Общие сведения о металлах и сплавах Поверхностные явления
Поверхностные явления Сплав золота и серебра - электрум
Сплав золота и серебра - электрум Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)
Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1) Уральские горы. Самоцветы
Уральские горы. Самоцветы Процесс электролиза
Процесс электролиза Влияние фтора на организм человека
Влияние фтора на организм человека Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ
Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ