Содержание
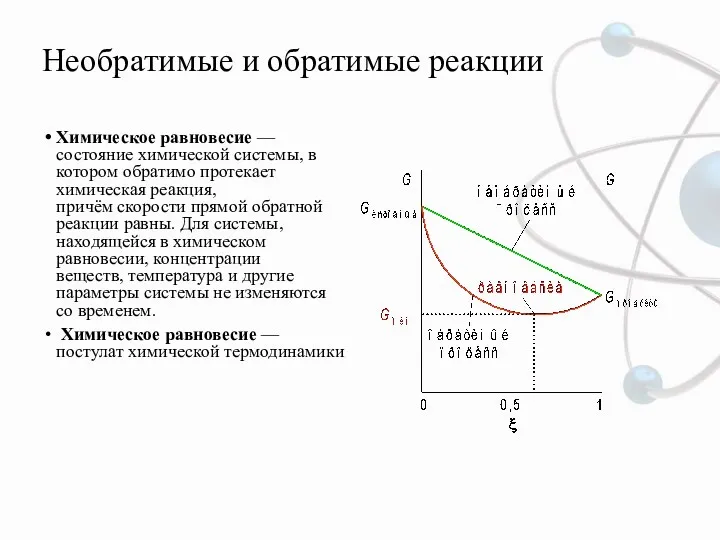
- 2. Необратимые и обратимые реакции Химическое равновесие — состояние химической системы, в котором обратимо протекает химическая реакция,
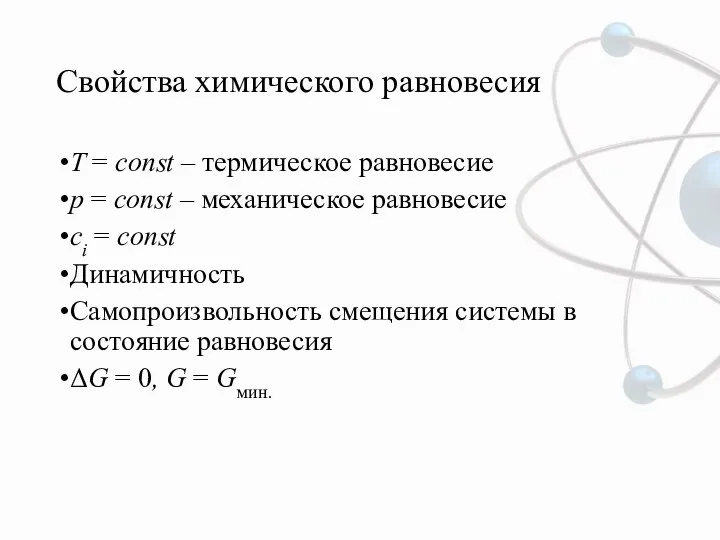
- 3. Свойства химического равновесия T = const – термическое равновесие p = const – механическое равновесие ci
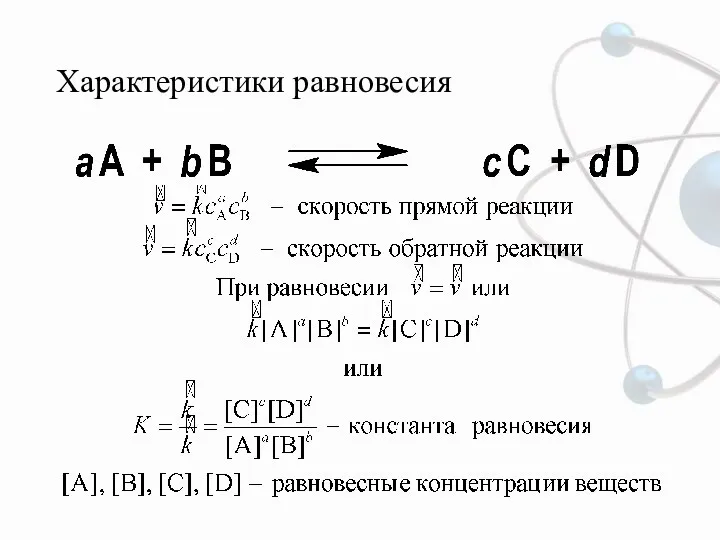
- 4. Характеристики равновесия
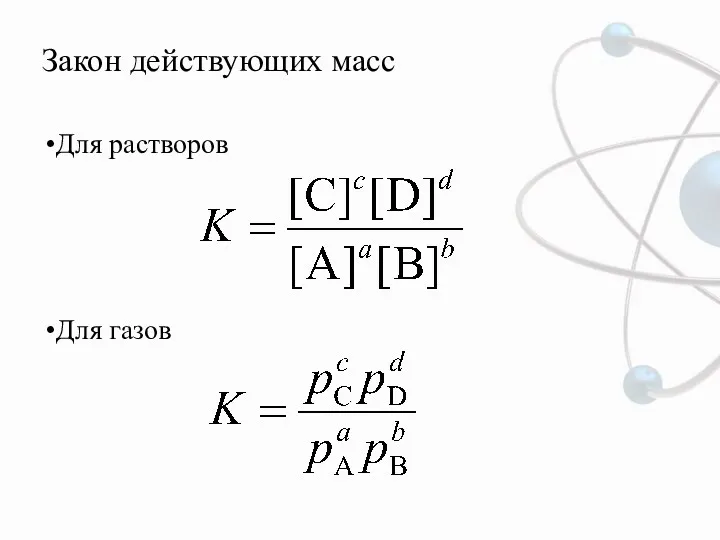
- 5. Закон действующих масс Для растворов Для газов
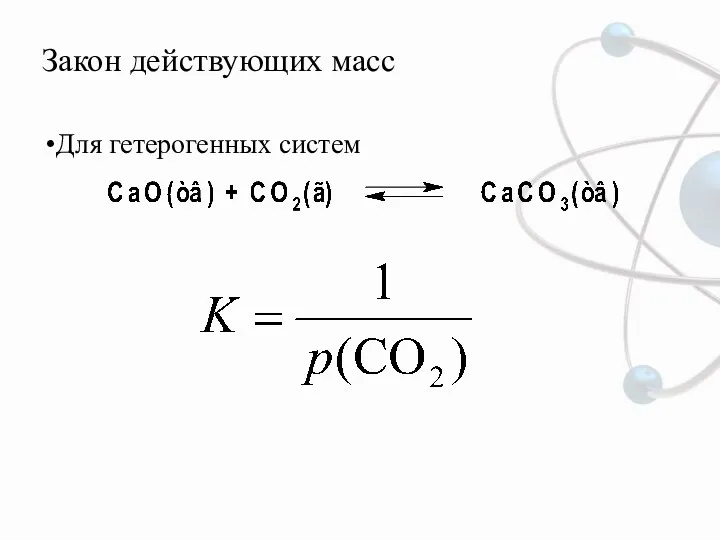
- 6. Закон действующих масс Для гетерогенных систем
- 7. Факторы, влияющие на константу и положение равновесия Принцип Ле Шателье — Брауна (1884 г.) — если
- 8. Анри Луи Ле Шателье (Henri Louis Le Chatelier) (1850 — 1936) В 1884 г. Ле Шателье
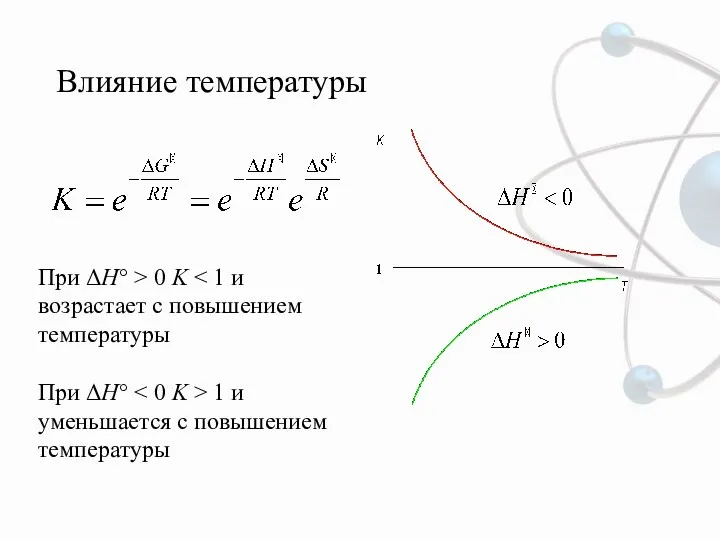
- 9. Влияние температуры При ΔH° > 0 K При ΔH° 1 и уменьшается с повышением температуры
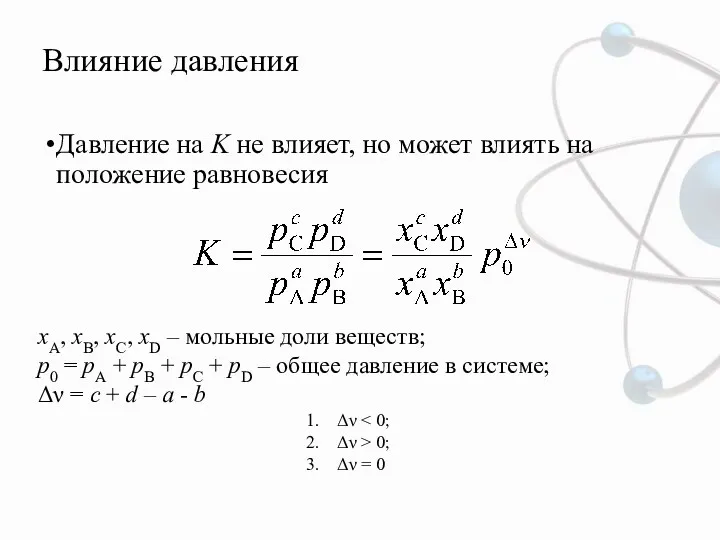
- 10. Влияние давления Давление на K не влияет, но может влиять на положение равновесия xA, xB, xC,
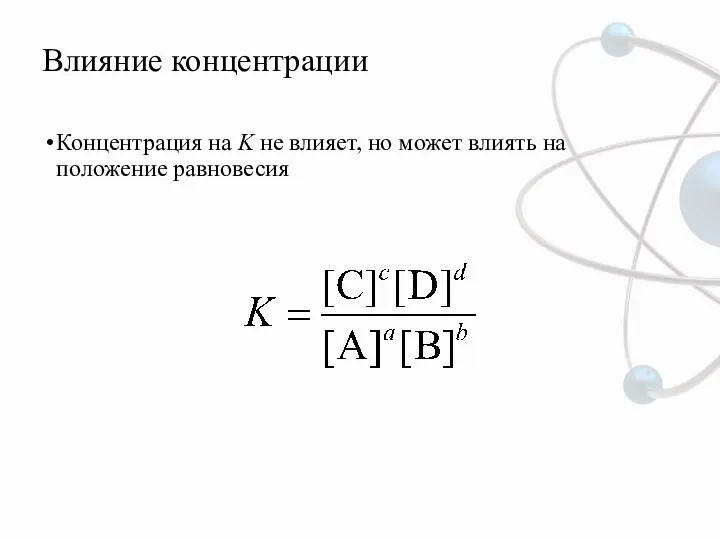
- 11. Влияние концентрации Концентрация на K не влияет, но может влиять на положение равновесия
- 13. Скачать презентацию


 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей