Содержание
- 2. Основные понятия и определения Химическая кинетика – это раздел химии, изучающий скорости и механизмы хим. р-ций
- 3. Основные понятия и определения Механизм р-ции – Лимитирующая стадия –
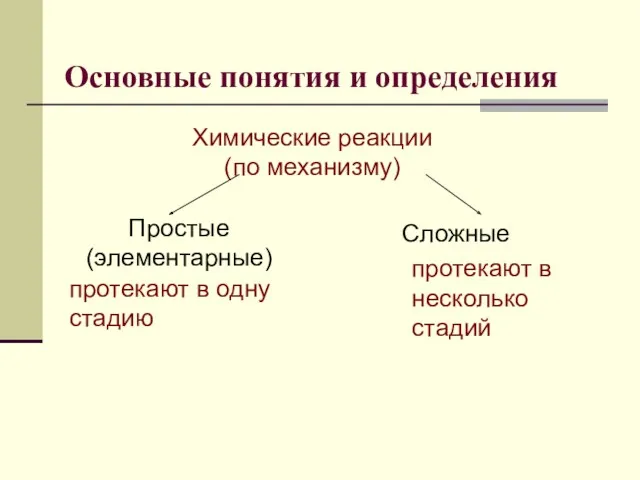
- 4. Основные понятия и определения Химические реакции (по механизму) Простые (элементарные) Сложные протекают в одну стадию протекают
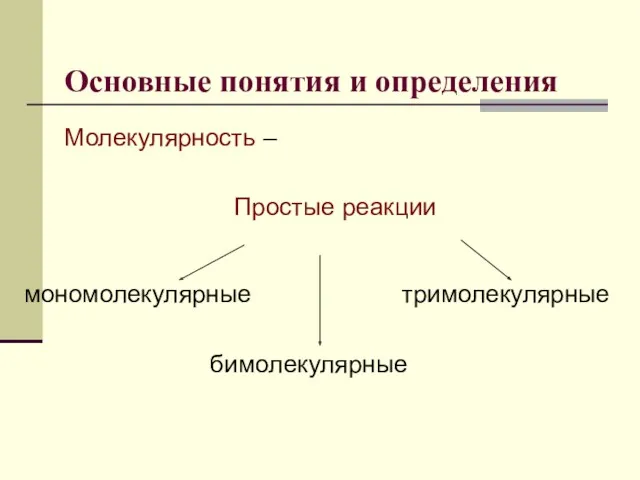
- 5. Основные понятия и определения Молекулярность – Простые реакции мономолекулярные бимолекулярные тримолекулярные
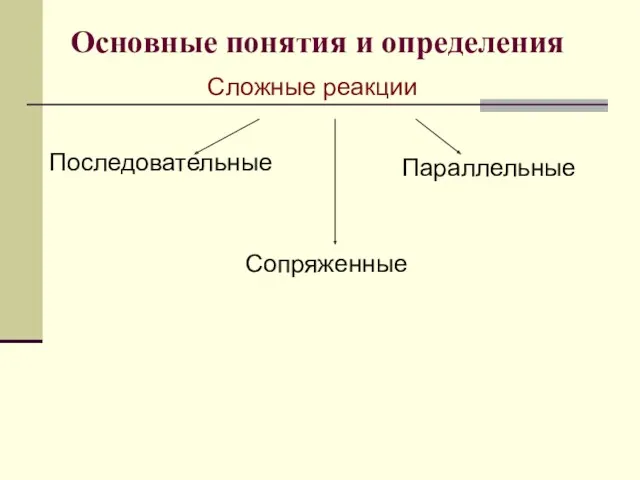
- 6. Основные понятия и определения Сложные реакции Последовательные Параллельные Сопряженные
- 7. Основные понятия и определения Цепные реакции (Н.Н. Семенов) 1 стадия: зарождение цепи 2 стадия: развитие цепи
- 8. Основные понятия и определения Элементарный акт хим. р-ции – СХР – СХР – изменение конц-ций реаг.
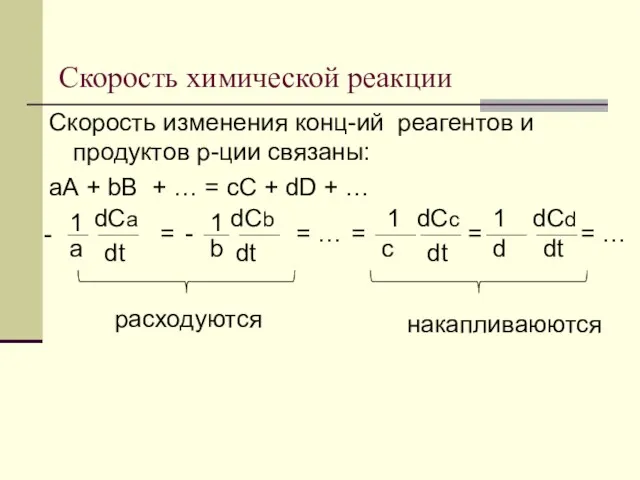
- 9. Скорость химической реакции Скорость изменения конц-ий реагентов и продуктов р-ции связаны: аА + bB + …
- 10. Факторы, влияющие на скорость химической реакции Скорость хим. р-ции зависит от: природы реагирующих в-в конц. реаг.
- 11. Зависимость СХР от концентрации реагентов 1867 г. Гульдберг и Вааге Закон действующих масс СХР прямо пропорциональна
- 12. Зависимость СХР от концентрации aA + bB = cC + dD Применим к р-ции ЗДМ и
- 13. Константа скорости химической реакции k - константа скорости хим. р-ции Физический смысл k то k =
- 14. Зависимость скорости от температуры 1884 г. Вант-Гофф Эмпирическое правило: Повышение температуры на 10о увеличиваетет скорость гомогенной
- 15. Теория активных столкновений Для протекания р-ции необходимо: столкновение молекул наличие у молекул достаточной Е благоприятная ориентация
- 16. Энергия активации Еа – это избыточная Е, кот. должны обладать молекулы, чтобы между ними произошло взаим-ие.
- 17. Энергия активации Уравнение Аррениуса (1889 г.) k = kо∙ е -Еа/RT
- 18. Расчет энергии активации Ea для многих р-ций изм-ся в пределах от 50 до 250 кДж/моль. Если
- 19. Катализ Катализ – это явление измения СХР при участии катализатора. Катализаторы – в-ва, изменяющие СХР, но
- 21. Скачать презентацию














 Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Висбрекинг (перспективный процесс ТК)
Висбрекинг (перспективный процесс ТК) Камни и Лев
Камни и Лев Алканы (предельные углеводороды)
Алканы (предельные углеводороды) Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Серная кислота. Свойства разбавленной серной кислоты, соли серной кислоты
Серная кислота. Свойства разбавленной серной кислоты, соли серной кислоты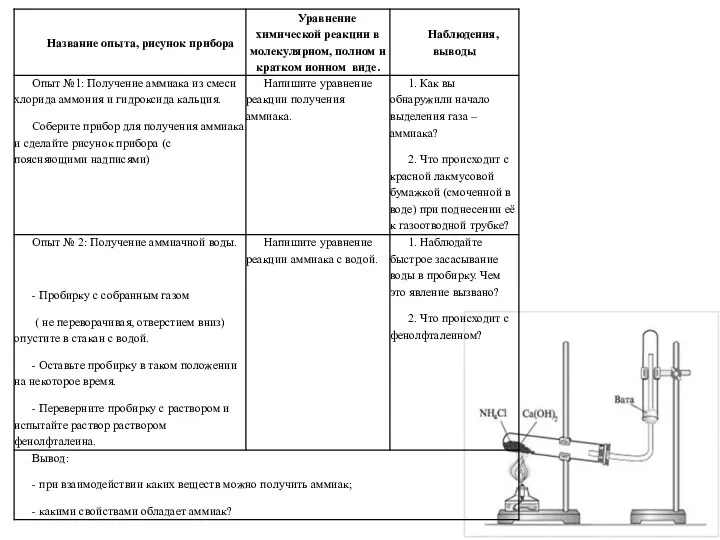 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Химический турнир
Химический турнир Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Фосфор и его соединения
Фосфор и его соединения Неорганические полимеры
Неорганические полимеры Спирты. Определение. Классификация
Спирты. Определение. Классификация Синтетический каучук и его применение
Синтетический каучук и его применение Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Электролиз
Электролиз Изучение свойств тиосульфата натрия
Изучение свойств тиосульфата натрия Кислород и озон
Кислород и озон Цветные маталлы и сплавы
Цветные маталлы и сплавы Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Распространенность химических элементов на земле и в космосе
Распространенность химических элементов на земле и в космосе Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях