Содержание
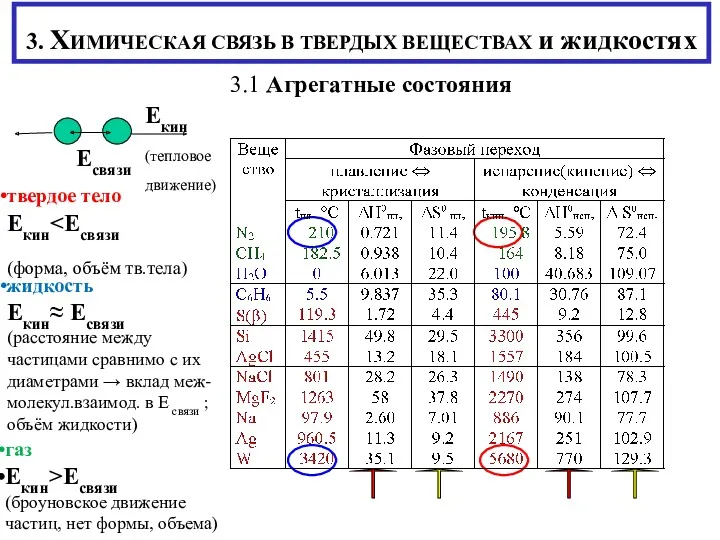
- 2. 3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях 3.1 Агрегатные состояния твердое тело Екин (форма, объём
- 3. Среднее расстояние (размеры пространства) между частицами Vν = 22.4 л V = Vν / NA 1
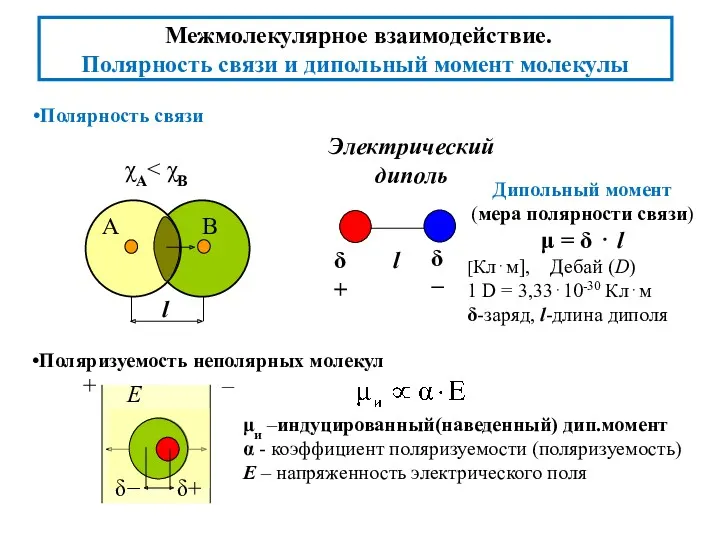
- 4. Полярность связи Дипольный момент (мера полярности связи) μ = δ ⋅ l [Кл⋅м], Дебай (D) 1
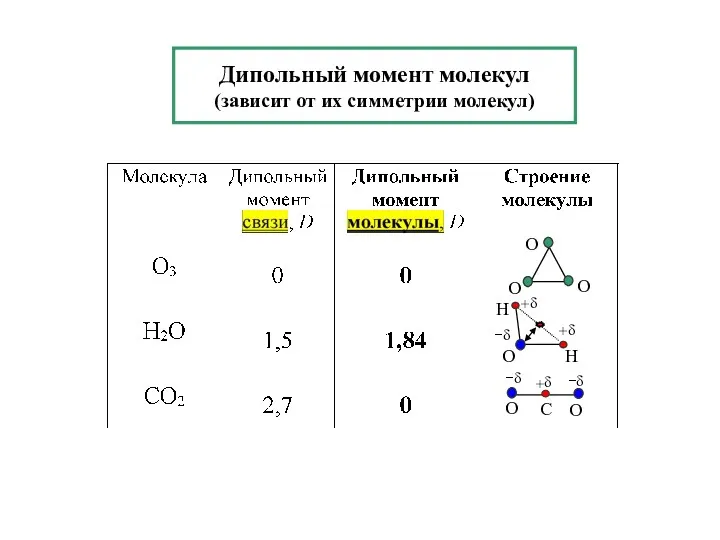
- 5. Дипольный момент молекул (зависит от их симметрии молекул)
- 6. Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)] 1. Ориентационный эффект (Кьезома) [взаимодействие(электростатическое притяжение)
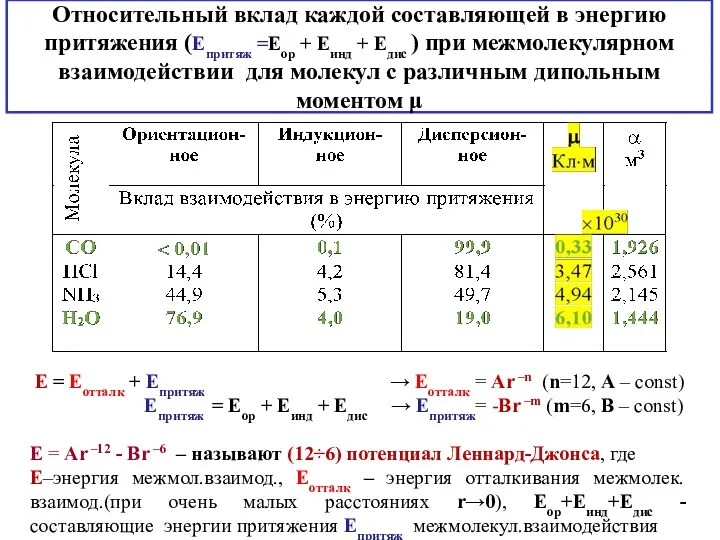
- 7. Относительный вклад каждой составляющей в энергию притяжения (Епритяж =Еор + Еинд + Едис ) при межмолекулярном
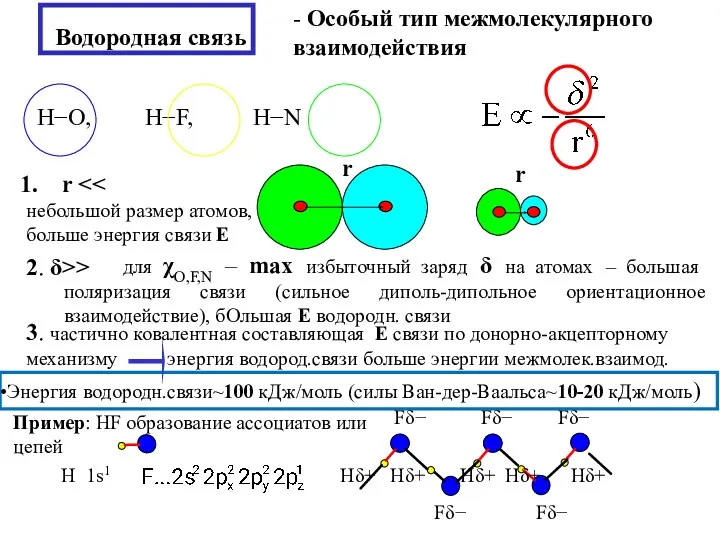
- 8. Водородная связь - Особый тип межмолекулярного взаимодействия r небольшой размер атомов, больше энергия связи Е 2.
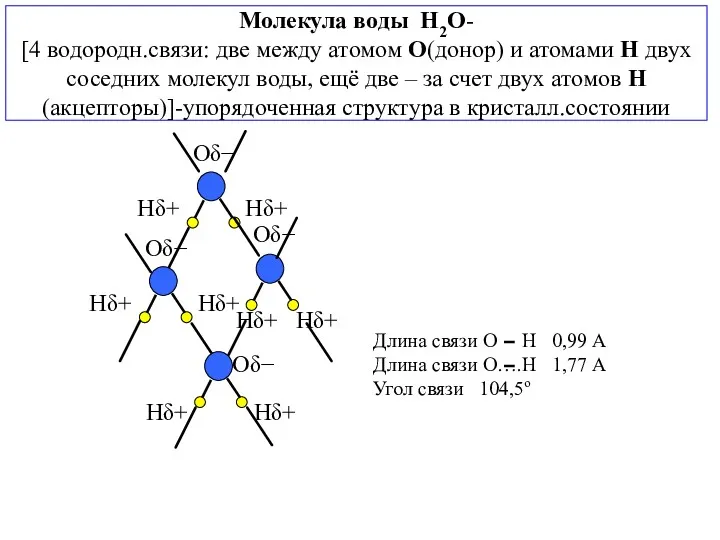
- 9. Молекула воды H2O- [4 водородн.связи: две между атомом О(донор) и атомами Н двух соседних молекул воды,
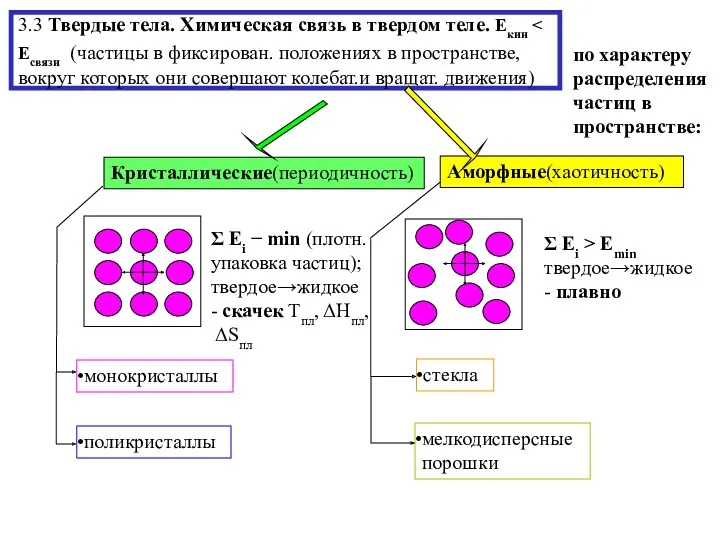
- 10. 3.3 Твердые тела. Химическая связь в твердом теле. Екин по характеру распределения частиц в пространстве:
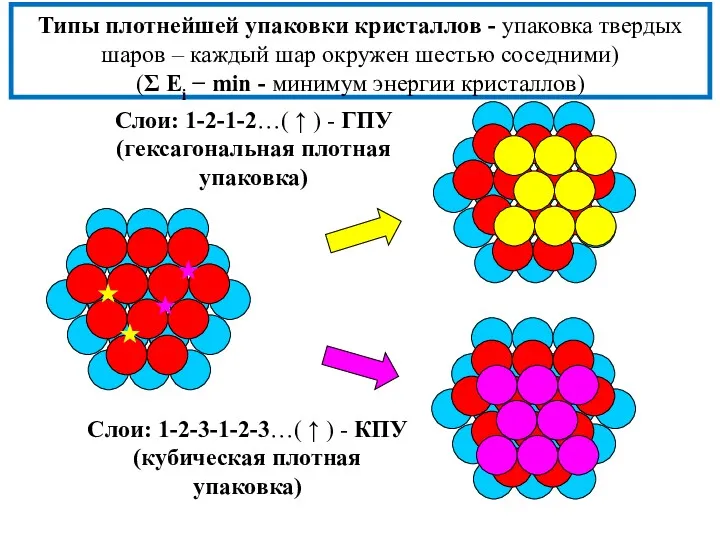
- 11. Типы плотнейшей упаковки кристаллов - упаковка твердых шаров – каждый шар окружен шестью соседними) (Σ Еi
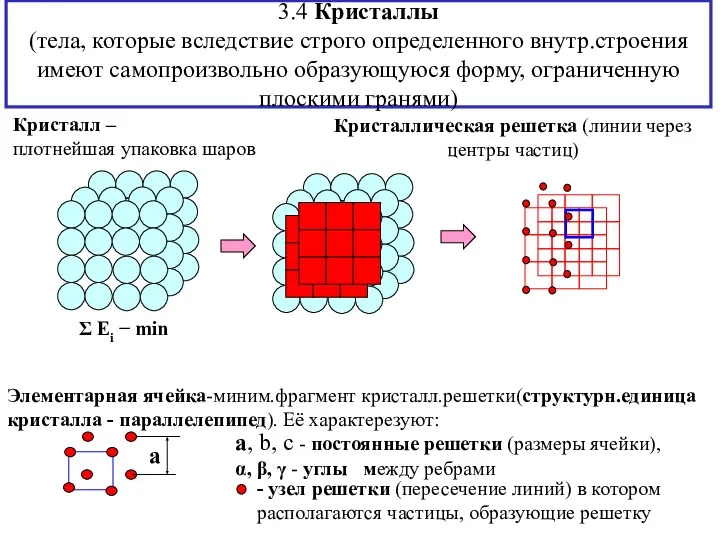
- 12. 3.4 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму, ограниченную плоскими гранями) Кристалл
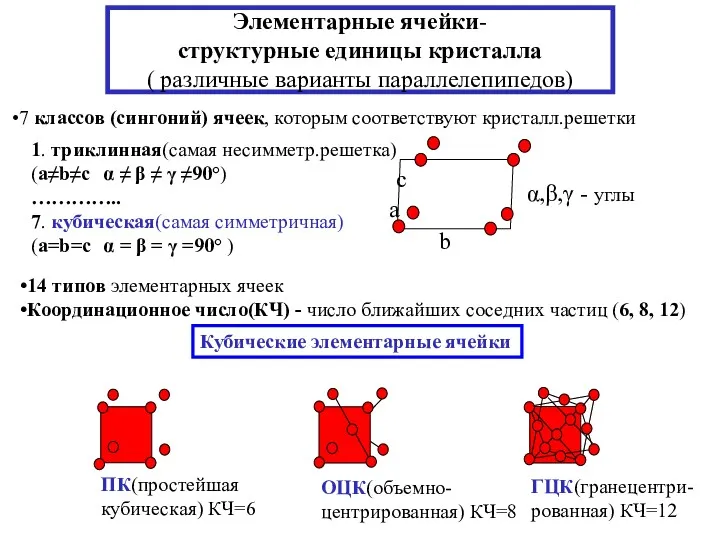
- 13. Элементарные ячейки- структурные единицы кристалла ( различные варианты параллелепипедов) 7 классов (сингоний) ячеек, которым соответствуют кристалл.решетки
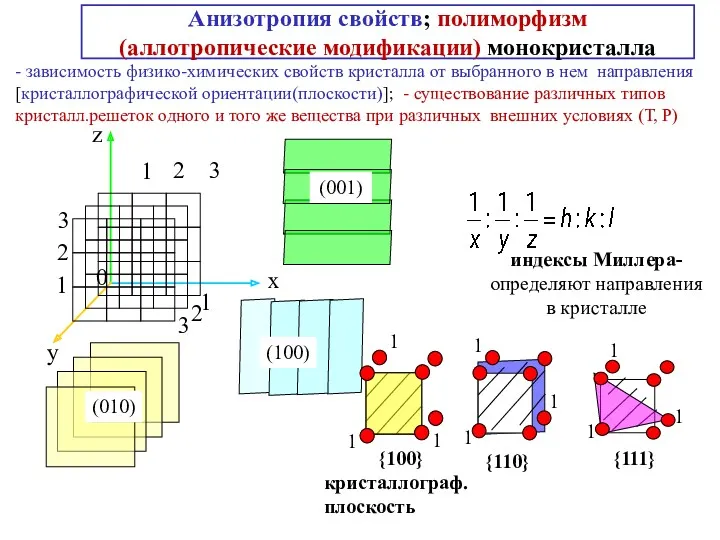
- 14. Анизотропия свойств; полиморфизм (аллотропические модификации) монокристалла - зависимость физико-химических свойств кристалла от выбранного в нем направления
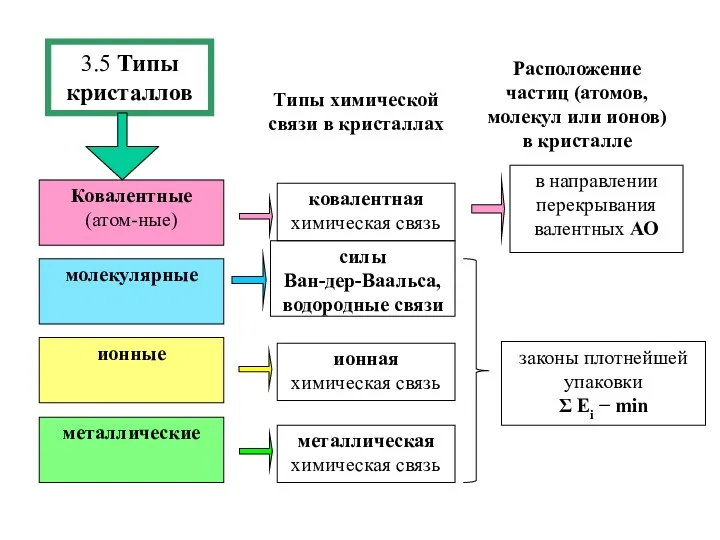
- 15. 3.5 Типы кристаллов молекулярные ионные металлические Ковалентные(атом-ные) Типы химической связи в кристаллах Расположение частиц (атомов, молекул
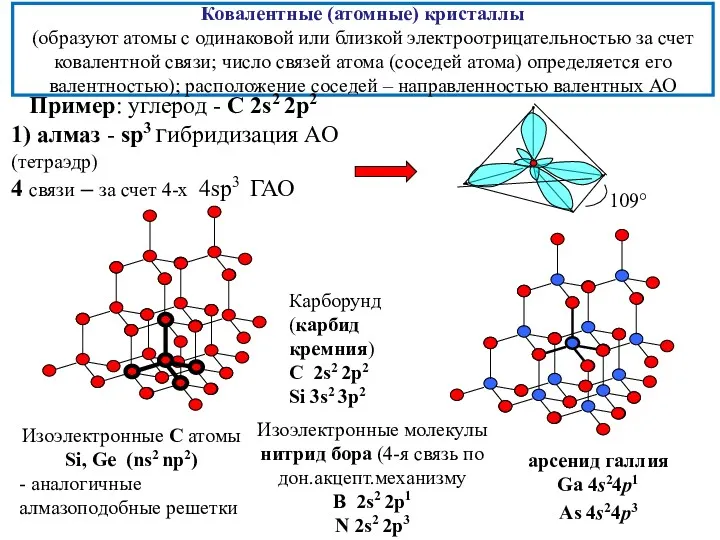
- 16. Ковалентные (атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью за счет ковалентной связи; число связей
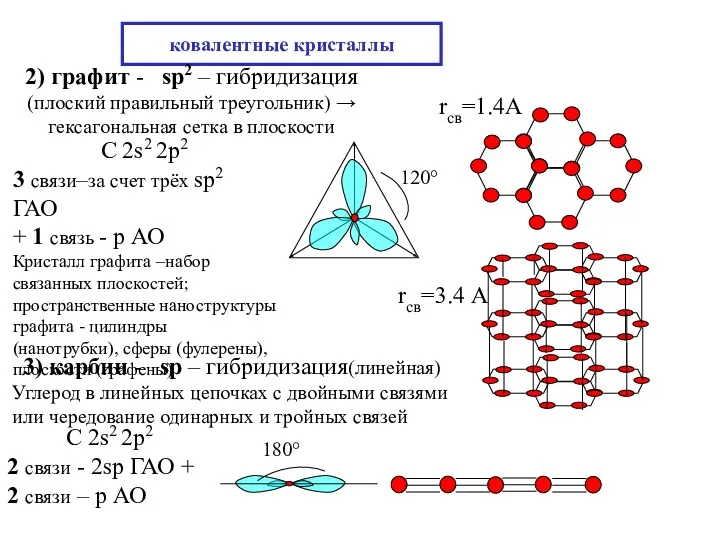
- 17. ковалентные кристаллы 2) графит - sp2 – гибридизация (плоский правильный треугольник) → гексагональная сетка в плоскости
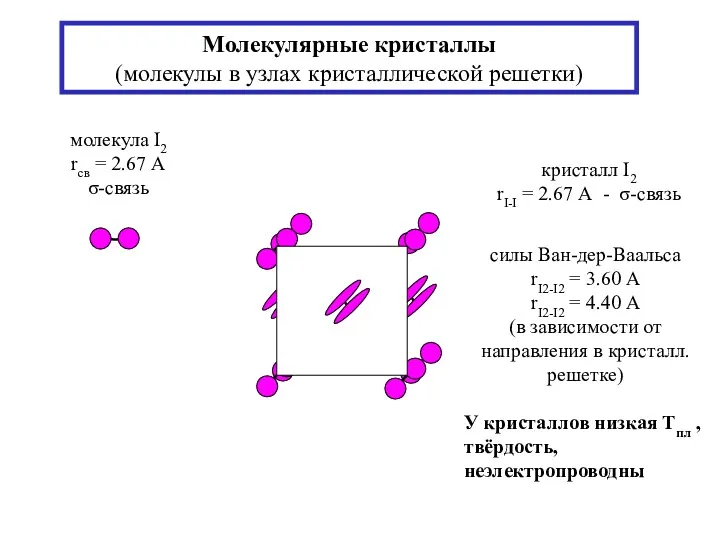
- 18. Молекулярные кристаллы (молекулы в узлах кристаллической решетки) силы Ван-дер-Ваальса rI2-I2 = 3.60 А rI2-I2 = 4.40
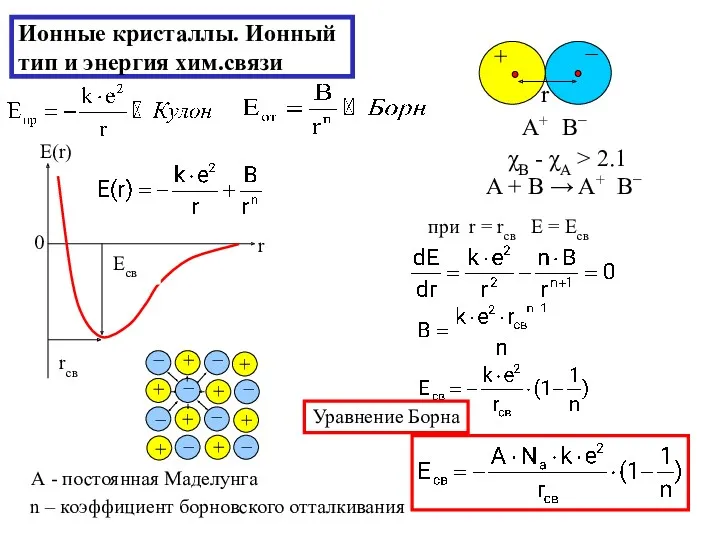
- 19. Ионные кристаллы. Ионный тип и энергия хим.связи χB - χA > 2.1 A + B →
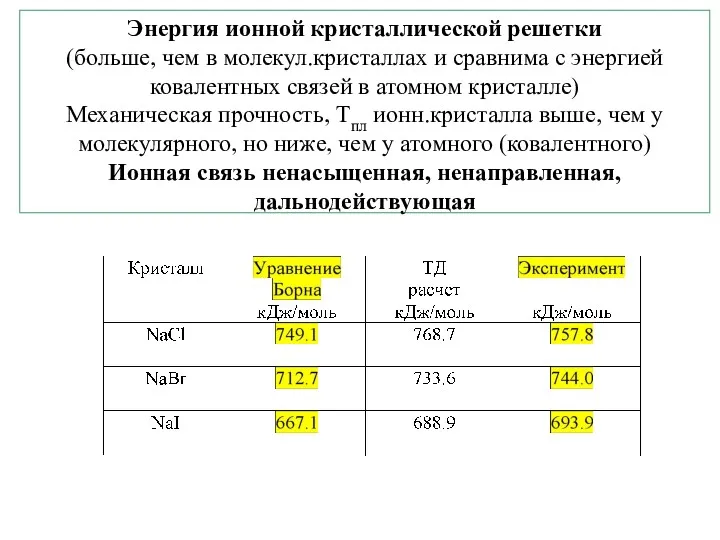
- 20. Энергия ионной кристаллической решетки (больше, чем в молекул.кристаллах и сравнима с энергией ковалентных связей в атомном
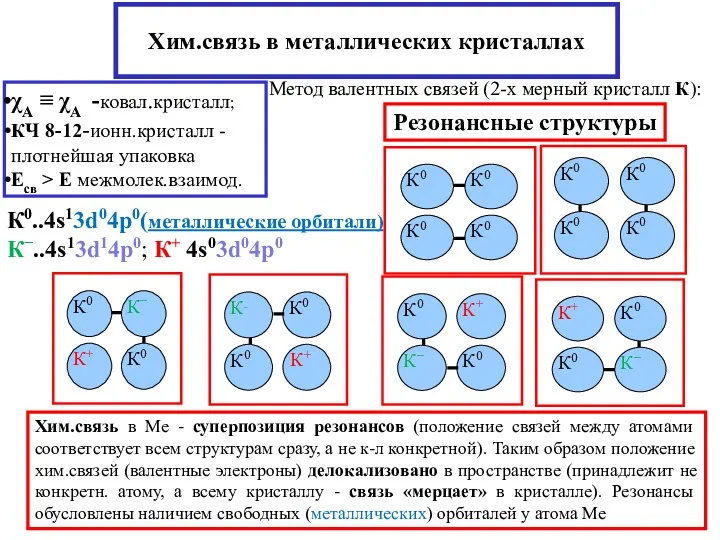
- 21. Хим.связь в металлических кристаллах χA ≡ χА -ковал.кристалл; КЧ 8-12-ионн.кристалл - плотнейшая упаковка Есв > Е
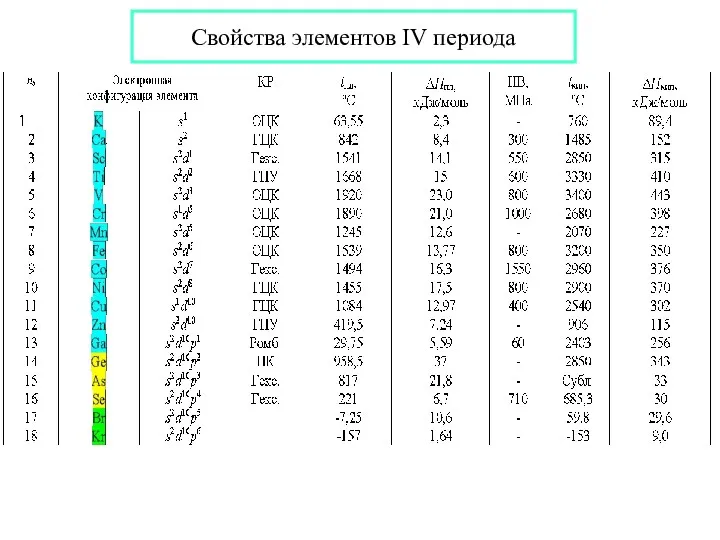
- 22. Свойства элементов IV периода
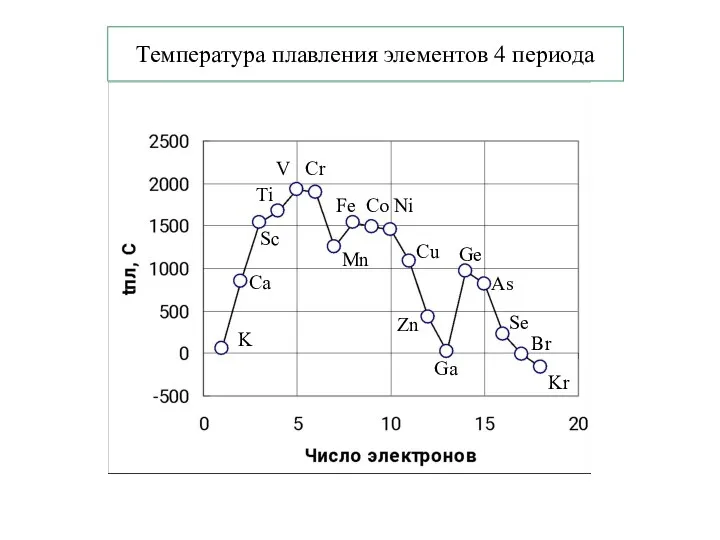
- 23. Температура плавления элементов 4 периода
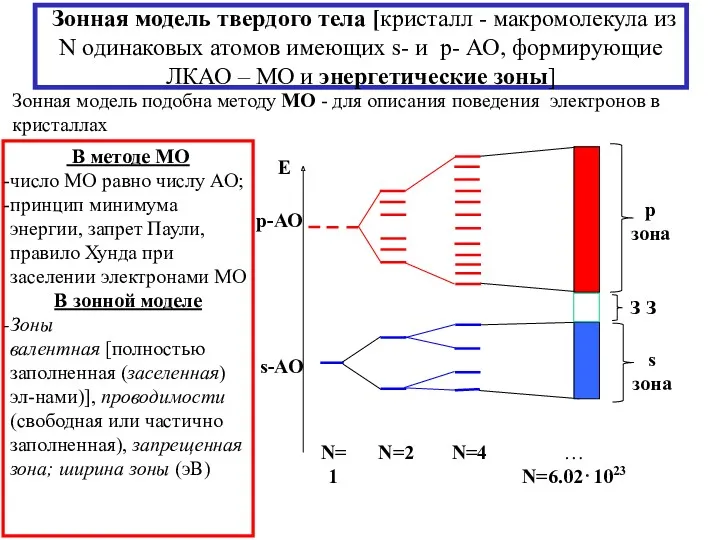
- 24. Зонная модель твердого тела [кристалл - макромолекула из N одинаковых атомов имеющих s- и p- АО,
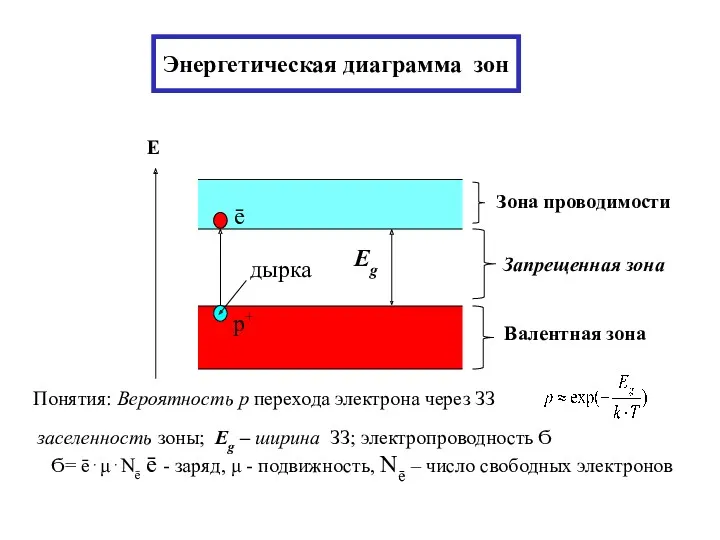
- 25. Энергетическая диаграмма зон
- 26. Металлы Nē~NА - const Eg= 0 или Eg При Т=300К, 3кТ=0,078эВ ⇒ ширина ЗЗ Eg меньше
- 27. Eg > > 3 эВ > > кТ- существенно больше энергии тепловых колебаний кристалл. решетки [не
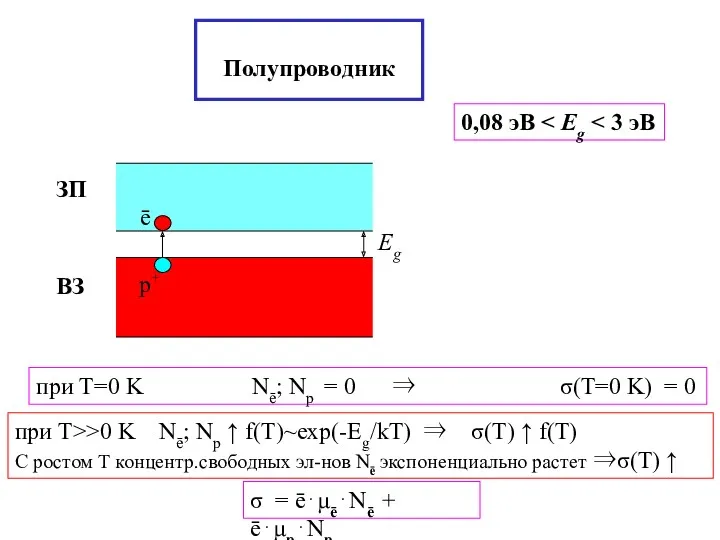
- 28. Полупроводник 0,08 эВ при T=0 K Nē; Nр = 0 ⇒ σ(T=0 K) = 0 σ
- 30. Скачать презентацию

![Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/178098/slide-5.jpg)


 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей