Слайд 20

Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы
обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 %являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыханияВ живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 %являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлорозВ живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 %являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемомОбычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобинеОбычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислородаОбычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферментеКомплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метанКомплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанолКомплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
В организм животных и человека железо поступает с пищей (наиболее богаты им печеньВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясоВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйцаВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовыеВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлебВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупыВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёклаВ организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Интересно, что некогда шпинат ошибочно был внесён в этот список (из-за опечатки в результатах анализа — был потерян «лишний» ноль после запятой).




















 Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії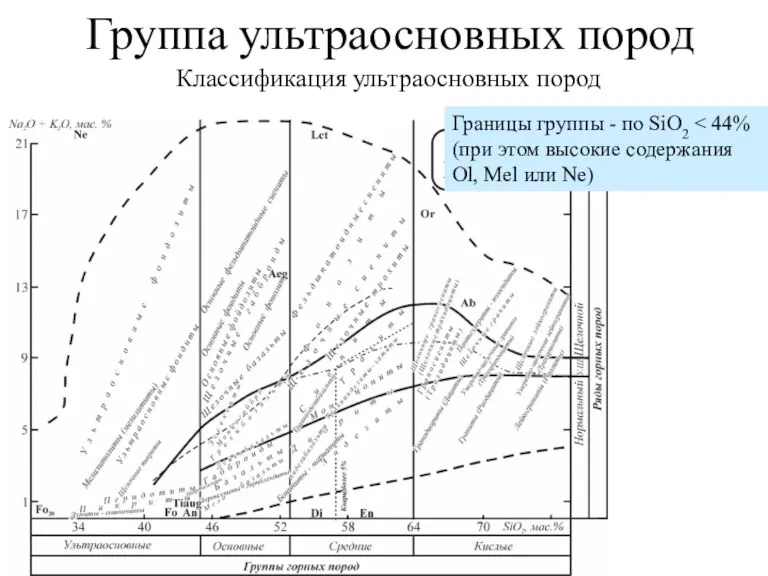 Группа ультраосновных пород
Группа ультраосновных пород Аммиак
Аммиак Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Карбонильные соединения. Альдегиды
Карбонильные соединения. Альдегиды Уральские самоцветы
Уральские самоцветы Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Гибридизация. Формы электронных облаков
Гибридизация. Формы электронных облаков Классификация химических реакций
Классификация химических реакций Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Задачи на вывод формулы органических веществ
Задачи на вывод формулы органических веществ Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях кл.химия 24.01
кл.химия 24.01 Химические свойства получение и применение солей
Химические свойства получение и применение солей Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Введение в количественный анализ
Введение в количественный анализ Хімічна кінетика
Хімічна кінетика Различные теории кислот и оснований
Различные теории кислот и оснований Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение
Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение Галогены. История открытия галогенов
Галогены. История открытия галогенов Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds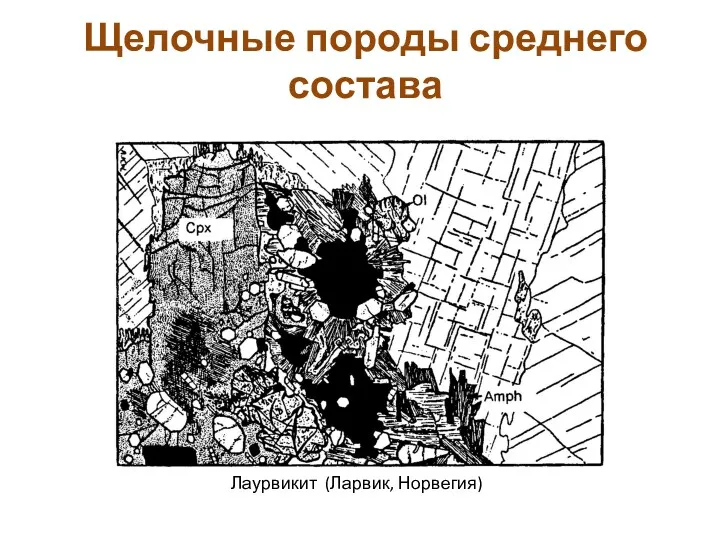 Щелочные породы среднего состава
Щелочные породы среднего состава Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Назначение установки Пенекс
Назначение установки Пенекс