Содержание
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 3. Общая характеристика галогенов Галогены – это естественная группа элементов , расположенных в главной подгруппе 7 группы.
- 4. F 1S22S22P5 S P CI 1S22S22P63S23P5 Br I …4S24P5 …5S25P5 Электронные формулы Вывод: галогены - р
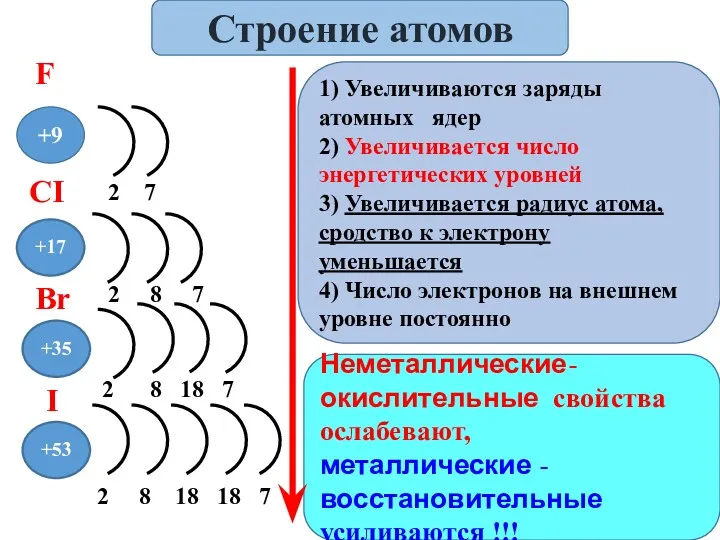
- 5. +9 +53 +35 +17 Неметаллические-окислительные свойства ослабевают, металлические -восстановительные усиливаются !!! 2 7 2 8 7
- 6. -1 +7 -1 +3 -1 +5 -1 +1 0 Определите степени окисления атомов галогенов в веществах
- 7. Молекулы галогенов состоят из двух атомов F2; Cl2; Br2; I2 Связь – ковалентная неполярная
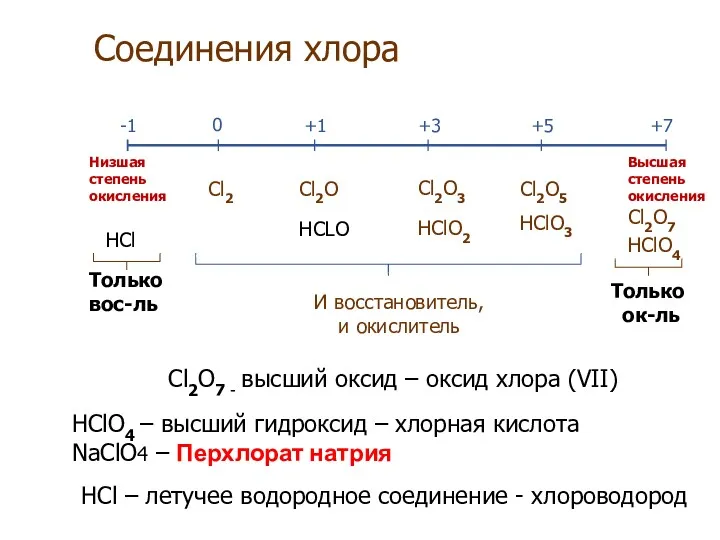
- 8. Соединения хлора -1 0 +1 +3 +5 +7 HCl Cl2 Cl2O HCLO Cl2O3 HClO2 Cl2O5 HClO3
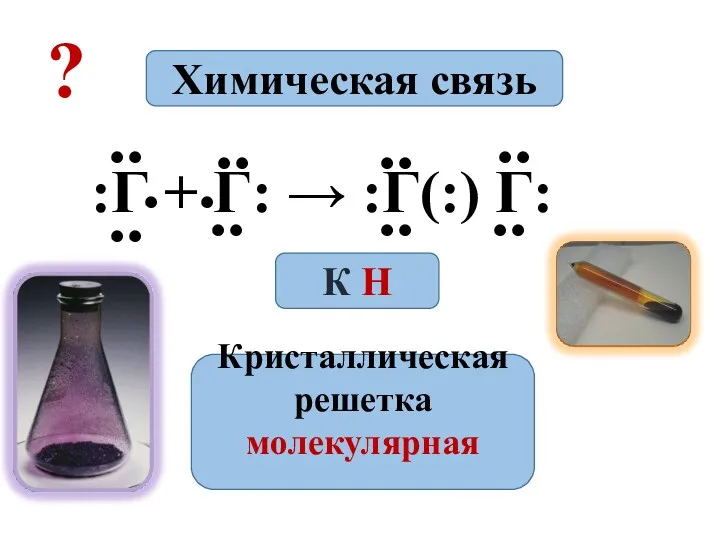
- 9. :Г + Г: → :Г(:) Г: .. .. .. .. .. .. .. .. . .
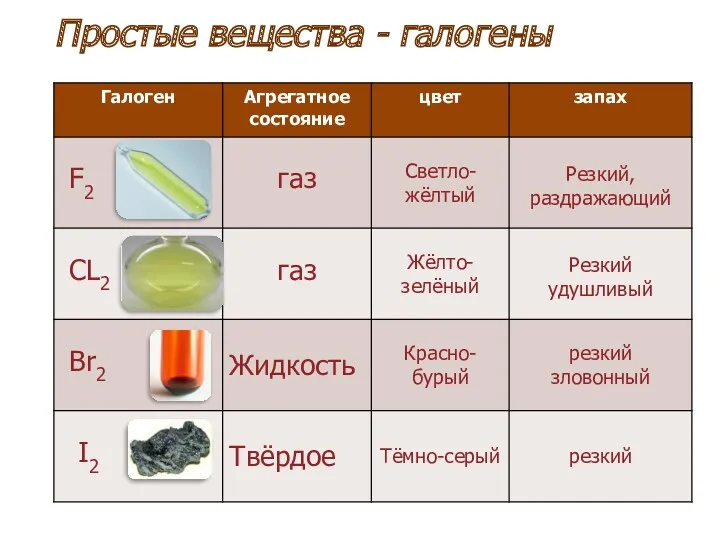
- 10. Простые вещества - галогены
- 11. 1.Взаимодействие с металлами Химические свойства галогенов 2 Na0 + CI20 = 2 NaCI +1 -1 CI20
- 12. Химические свойства Сильные окислители (+е) 1. Взаимодействуют с металлами: 2Na + Cl2 = 2NaCl Zn +
- 13. Cu0 + I20 = Cu I2 2Fe0 + 3Br 20= 2FeBr 3 +2 -1 +3 -1
- 14. 2.Взаимодействие с водородом Н20 + Г20 = 2Н Г +1 -1 Н20 + CI20 = 2Н
- 15. Химические свойства 2. Взаимодействуют с неметаллами: 2S + Cl2 → S2Cl2 Возможно также получение и других
- 16. 4.Взаимодействие с растворами солей галогенов: CI2 F2 Br2 I2 CI2 + 2NaBr = 2 NaCl +
- 17. Химические свойства Взаимодействуют со сложными веществами допишите возможные уравнения реакций а) с растворами солей Cl2 +
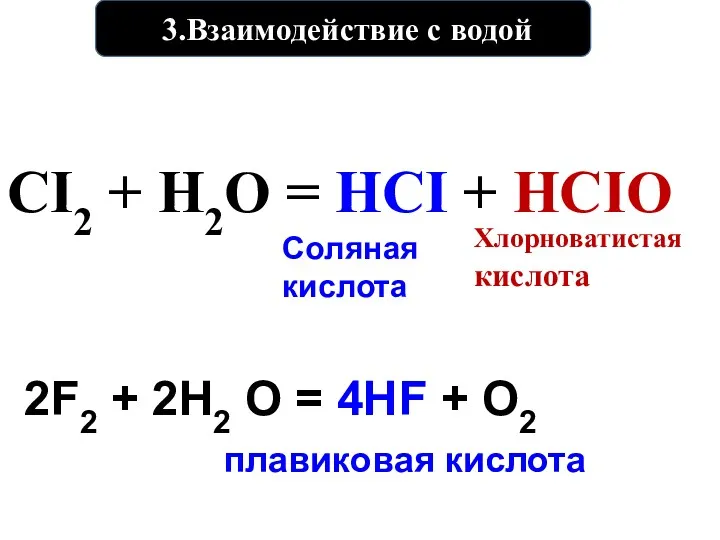
- 18. 3.Взаимодействие с водой CI2 + H2O = HCI + HCIO Хлорноватистая кислота Соляная кислота 2F2 +
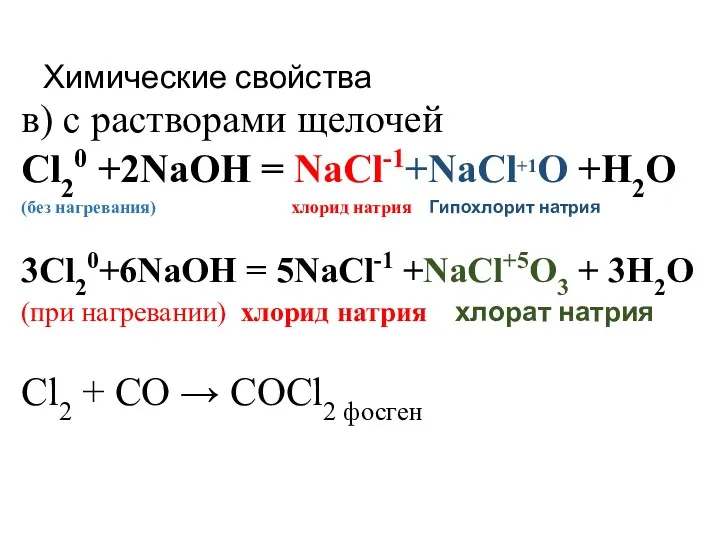
- 19. Химические свойства в) с растворами щелочей Cl20 +2NaOH = NaCl-1+NaCl+1O +H2O (без нагревания) хлорид натрия Гипохлорит
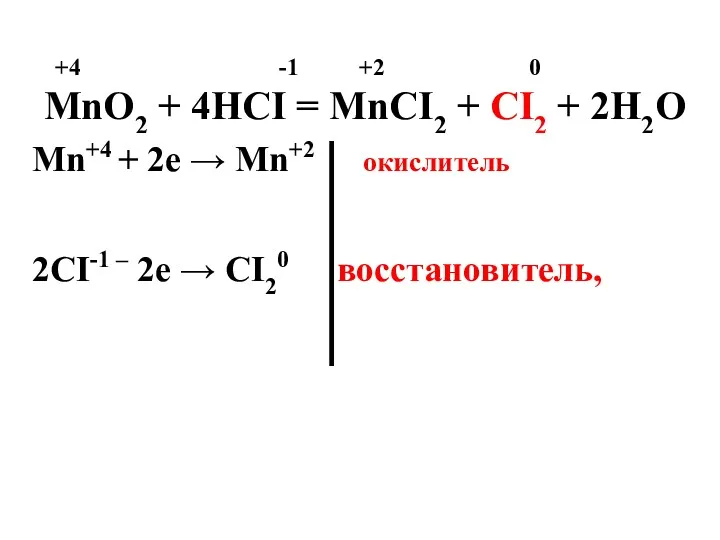
- 20. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
- 21. Применение галогенов
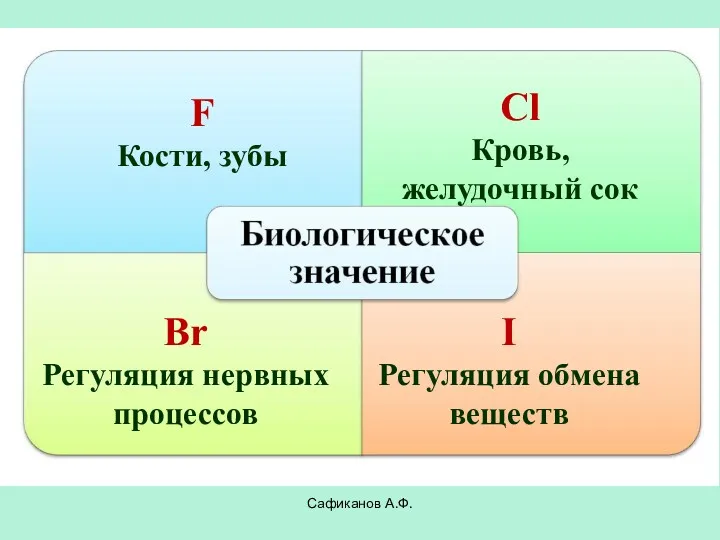
- 22. Сафиканов А.Ф. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена
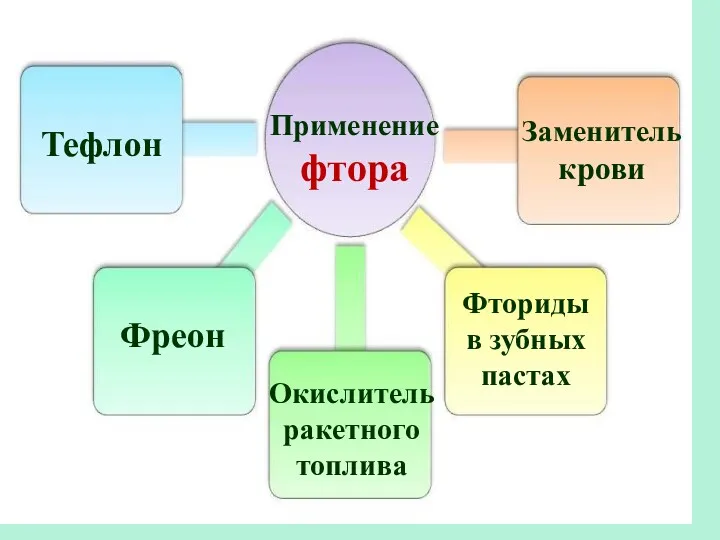
- 23. Сафиканов А.Ф. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
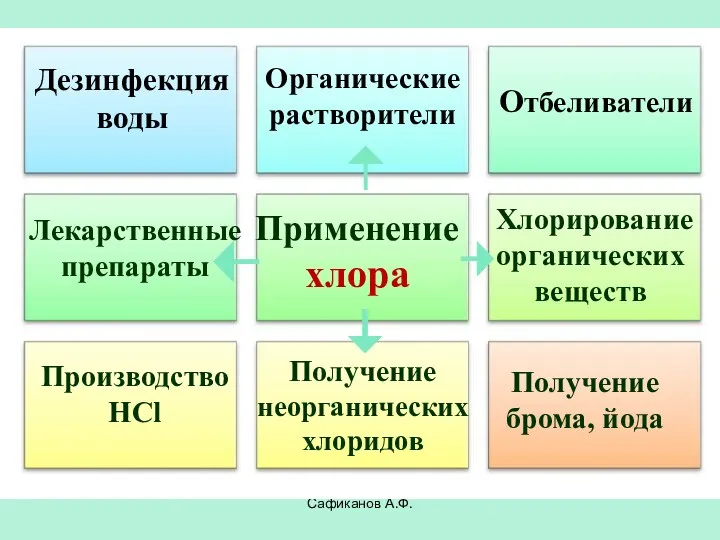
- 24. Сафиканов А.Ф. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты
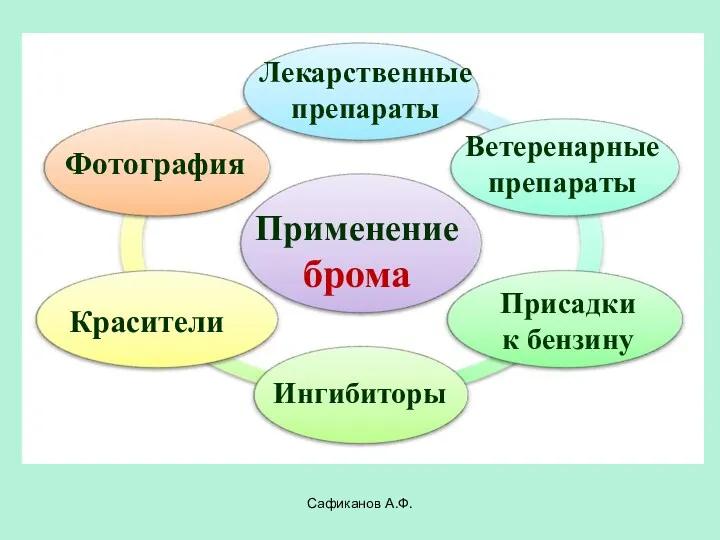
- 25. Сафиканов А.Ф. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
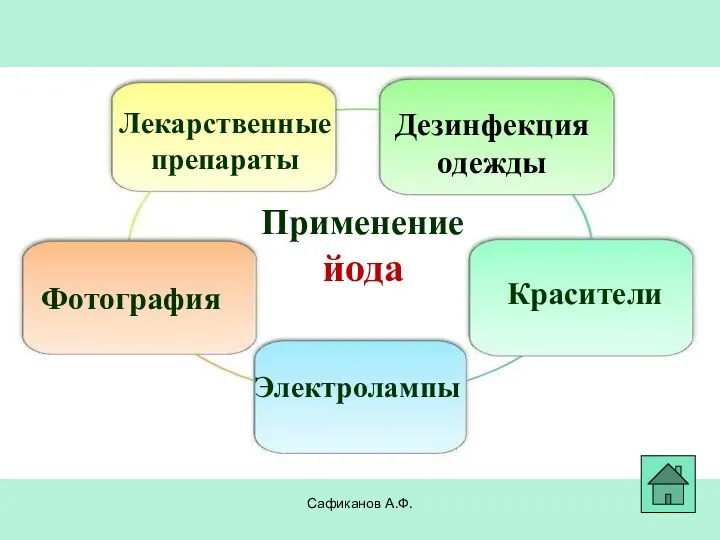
- 26. Сафиканов А.Ф. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
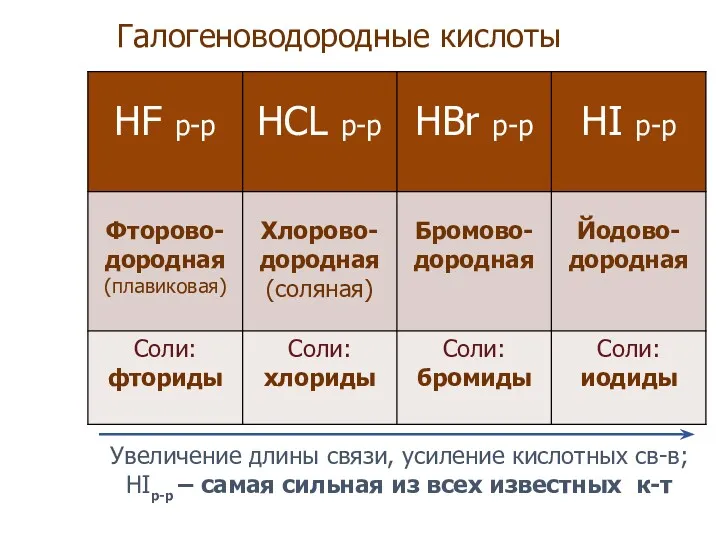
- 27. Галогеноводородные кислоты Увеличение длины связи, усиление кислотных св-в; HIр-р – самая сильная из всех известных к-т
- 28. Дезинфицирующие реагенты на основе хлора Применение галогенов
- 29. Соляная кислота
- 30. Соляная кислота (HCl) Классификация Соляная кислота по: наличию кислорода: основности: растворимости в воде: летучести: степени электролитической
- 31. Физические свойства хлороводорода Хлороводород – это газ с резким запахом, без цвета, очень хорошо растворим в
- 32. Физические свойства соляной кислоты Соляная кислота – бесцветная дымящаяся на воздухе жидкость (в продажу поступает 36%-ный
- 33. Химические свойства соляной кислоты 1. Действие соляной кислоты на индикаторы 2. Взаимодействие с металлами 3. Взаимодействие
- 34. Соляная кислота необратимо диссоциирует в водном растворе. Составьте уравнение диссоциации соляной кислоты. HCl = H+ +
- 35. 1.Кислоты взаимодействуют с щелочами( а также с нерастворимыми основаниями, если получающая соль растворима в воде) с
- 36. Взаимодействие соляной кислоты с основными оксидами Составьте уравнения реакций соляной кислоты с оксидом кальция и оксидом
- 37. Взаимодействие соляной кислоты с солями Составьте уравнения реакций соляной кислоты c карбонатом натрия натрия. Рассмотрите с
- 38. В) образуется кислота в осадке 2HСl + Na2SiO3 → H2SiO3↓+ 2NaСl соляная кислота + силикат Na
- 39. Соляная кислота реагирует с металлами до водорода с вытеснением водорода 6HCl +2Al= 2AlCl3 + 3H2 Т.П.Сараева
- 40. МnO2 + 4HCI = MnCI2 + CI2 + 2H2O +4 -1 +2 0 Mn+4 + 2e
- 41. Применение соляной кислоты 1. Получение солей 4. При паянии 3. Приготовление лекарств 2. Производство пластмасс и
- 43. Скачать презентацию







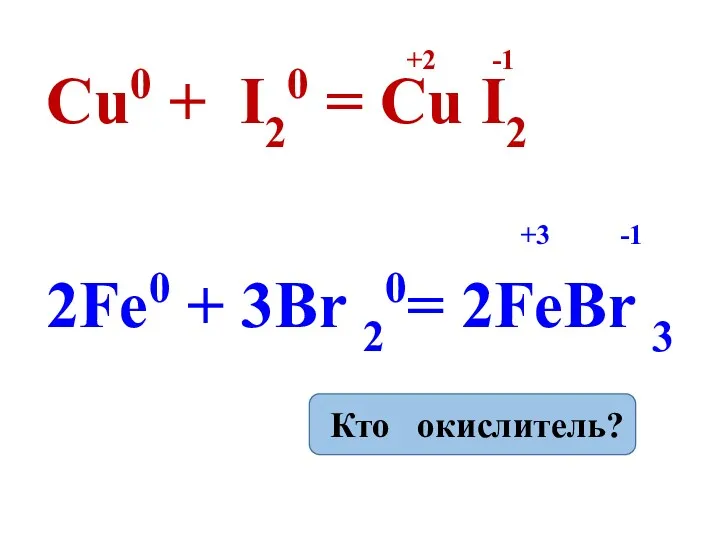


















 Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Подготовка к ОГЭ по химии
Подготовка к ОГЭ по химии Қышқылдар мен сілтілер тепе-теңдігі
Қышқылдар мен сілтілер тепе-теңдігі Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5
Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5 Гетероциклды қосылыстар. Алкалоидтар
Гетероциклды қосылыстар. Алкалоидтар Предмет и содержание фармацевтической и косметологической химии
Предмет и содержание фармацевтической и косметологической химии Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Получение обогащенного изопарафинами компонента бензина на цеолитсодержащих катализаторах
Получение обогащенного изопарафинами компонента бензина на цеолитсодержащих катализаторах Материаловедение. Кристаллизация. Диаграмма фазового состояния железо – углерод. Превращения в сталях
Материаловедение. Кристаллизация. Диаграмма фазового состояния железо – углерод. Превращения в сталях Оксид меди
Оксид меди Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Вещества и материалы. Классификация веществ. Реакции нейтрализации
Вещества и материалы. Классификация веществ. Реакции нейтрализации Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Неорганическая химия
Неорганическая химия Теория электролитической диссоциации
Теория электролитической диссоциации Полимеры. Мономер
Полимеры. Мономер Неметаллы: общая характеристика
Неметаллы: общая характеристика Нитраты в овощах и фруктах
Нитраты в овощах и фруктах Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Химический элемент и формы его существования
Химический элемент и формы его существования Распознавание химических соединений
Распознавание химических соединений D-элементы: хром, молибден, вольфрам
D-элементы: хром, молибден, вольфрам Аммиак
Аммиак Гидролиз солей
Гидролиз солей