Содержание
- 2. Закон сохранения массы В ходе химической реакции как общая масса веществ, так и масса отдельных элементов
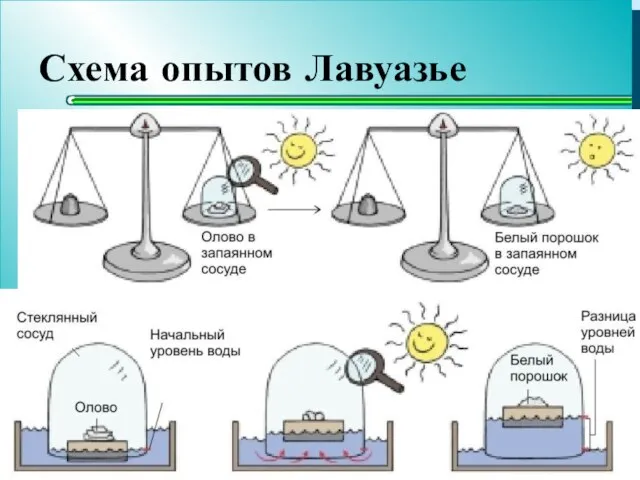
- 3. Схема опытов Лавуазье
- 4. Закон сохранения массы Закон сохранения массы означает, что в ходе реакции масса не изменяется. Значит сумма
- 5. Закон постоянства состава Соотношения между массами элементов, входящих в состав данного соединения постоянны и не зависят
- 6. Дальтониды и бертоллиды Вещества постоянного состава называют дальтонидами. Вещества переменного состава называют бертоллидами. После того, как
- 7. Закон кратных соотношений Если два элемента образуют друг с другом несколько соединений, то массы одного из
- 8. Закон постоянства состава и закон кратных соотношений m (CO2) m (O) m(C) m(O)/m(c) 123 г 89,4
- 9. Атомная теория Дальтона Вся материя состоит из мельчайших частиц, называемых атомами, которые являются наименьшими частицами элементов,
- 10. Атомные единицы массы На основании закона кратных соотношений Дальтон определил атомные массы известных к тому времени
- 11. Изотопы Изотопы – это различающиеся по массе атомы одного элемента. Большинство элементов представляют собой смесь нескольких
- 13. Средняя атомная масса Средняя атомная масса химического элемента равна среднему арифметическому относительных масс изотопов с учетом
- 14. Молекулярная масса Молекулярной массой вещества называют отношение его массы к 1/12 массы атома углерода. Поскольку масса
- 15. Моль Моль – количество вещества, которое содержит такое же число структурных единиц (молекул, атомов, ионов, электронов
- 16. Расчет молярной массы Пример: рассчитать молярную массу CO2. Решение: Mr (CO2) = Ar (C) + 2
- 17. Использование молярной массы Молярная масса (M) устанавливает связь между количеством вещества (n) и его массой (m).
- 18. Массовая доля элемента Массовую долю элемента в соединении можно рассчитать как произведение атомной массы элемента на
- 19. Молекулярная и эмпирическая формулы вещества Молекулярная формула соединения определяет истинное количество атомов различных элементов в молекуле
- 20. Определение формулы вещества Задача: Определить эмпирическую и молекулярную формулы вещества, содержащего 94,06% O и 5,93% H,
- 21. Определение формулы вещества (продолжение) 4. Определяем молярную массу, соответствующую эмпирической формуле: M (OH) = 1,01 +
- 22. Закон эквивалентных отношений Весовые количества двух или нескольких веществ, которые порознь вступают в химические реакции с
- 24. Скачать презентацию



















 Учение о растворах
Учение о растворах Значення води і водних розчинів у природі та житті людини. Кислотні дощі
Значення води і водних розчинів у природі та житті людини. Кислотні дощі Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау
Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау Классификация органических соединений
Классификация органических соединений Водород. Н2
Водород. Н2 Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Транспортное обеспечение внесения удобрений
Транспортное обеспечение внесения удобрений Амины
Амины Гидролиз неорганических соединений
Гидролиз неорганических соединений Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) 150 лет теории строения органических соединений
150 лет теории строения органических соединений Переохлажденные жидкости и их применение. Процесс кристаллизации
Переохлажденные жидкости и их применение. Процесс кристаллизации Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Свойства растворов электролитов
Свойства растворов электролитов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обмен нуклеопротеинов
Обмен нуклеопротеинов Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Липиды. Классификация липидов
Липиды. Классификация липидов Пищевые добавки
Пищевые добавки Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Современные химические технологии
Современные химические технологии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Enantioselective Total Synthesis
Enantioselective Total Synthesis Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Аспирин: польза или вред?
Аспирин: польза или вред? Галогены. 9 класс
Галогены. 9 класс