Содержание
- 2. Коррозия - это самопроизвольный процесс разрушения металлов и сплавов в результате окислительно-восстановитель-ного (химического, электрохимического и биологического)
- 3. Коррозия протекает с уменьшением энергии Гиббса: Меn+ + nе- → Мео (ΔG > O) металлургия Мео
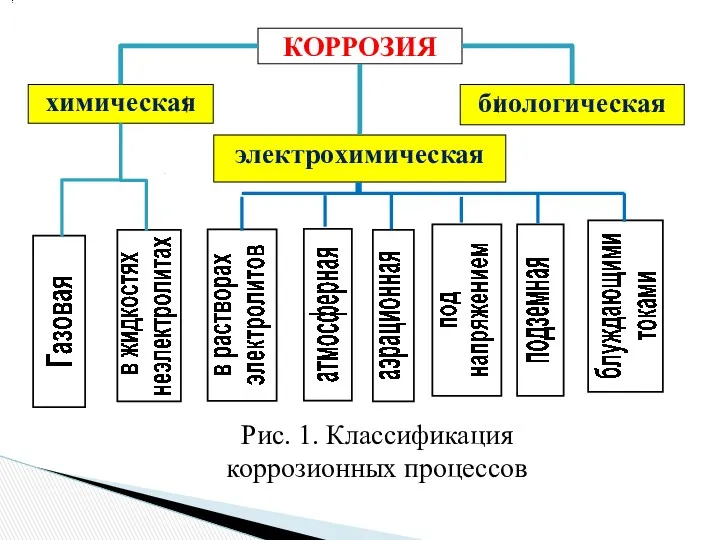
- 4. КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ Коррозионные процессы чрезвычайно многообразны и их классификация проводится по разным признакам. По механизму
- 5. КОРРОЗИЯ химическая электрохимическая биологическая Рис. 1. Классификация коррозионных процессов
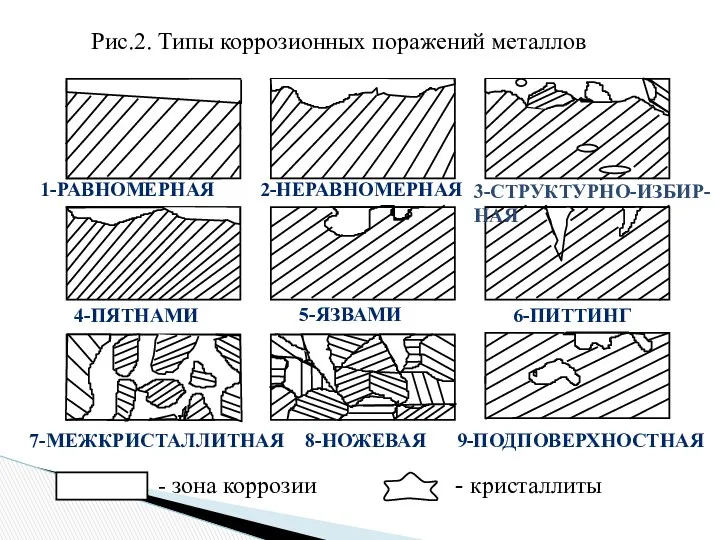
- 6. - зона коррозии - кристаллиты 1- равномерная 2 - селективная 3 - точечная (питинг) 5-межкристаллитная 6-транскристаллитная
- 8. ХИМИЧЕСКАЯ КОРРОЗИЯ Химическая коррозия - это самопроизвольное разрушение металлов под действием окислителей-неэлектролитов, обычно газов и органических
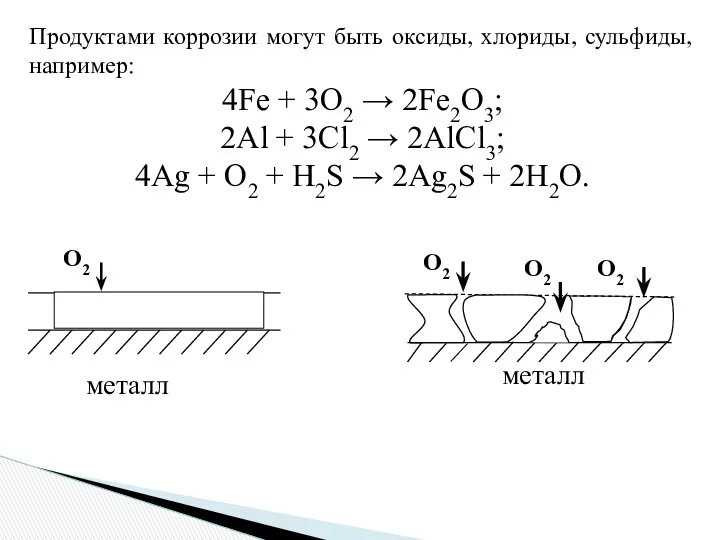
- 9. Продуктами коррозии могут быть оксиды, хлориды, сульфиды, например: 4Fe + 3O2 → 2Fe2O3; 2Al + 3Cl2
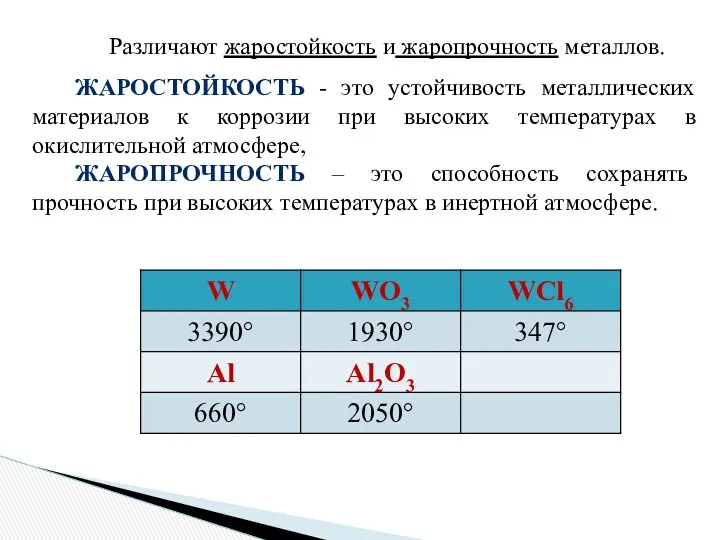
- 10. Различают жаростойкость и жаропрочность металлов. ЖАРОСТОЙКОСТЬ - это устойчивость металлических материалов к коррозии при высоких температурах
- 11. КОРРОЗИЯ В ЖИДКОСТЯХ - НЕЭЛЕКТРОЛИТАХ. К неэлектролитам (непроводящим электрический ток) относятся жидкости органического происхождения - спирт,
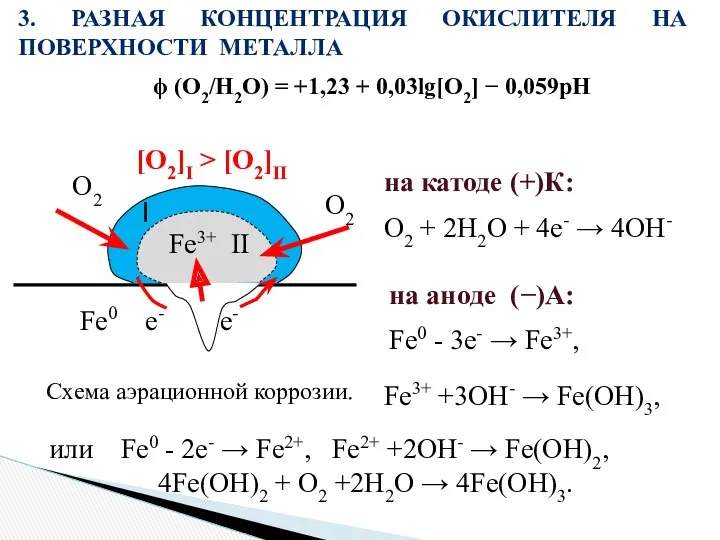
- 12. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Эл.хим.коррозия возникает при соприкосновении металла с электропроводящей средой (водой, водными растворами солей, кислот, щелочей;
- 13. В общем случае причиной образования короткозамкнутых микрогальванических элементов может служить не только наличие примесей в металле,
- 14. ΔG = - RTlnC C→0 ΔG → ∞ Чистых металлов не бывает. А следовательно. В среде
- 15. ВОДОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ сопровождается восстановлением на катодных участках водорода. в кислой среде: (-)А: Me – ne- =Men+
- 16. при водородной деполяризации электрохимической коррозии могут подвергаться металлы с электродным потенциалом более отрицательным, чем у водородного
- 17. МЕХАНИЗМЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ При электрохимической коррозии металлов выделяют четыре механизма, вызывающих образование и работу короткозамкнутых микрогальванических
- 18. К(+)[Cu] 2Н+ + 2e- → Н2 (-)А Fe0- 2e-→Fe2+ 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
- 19. или Fe0 - 2e- → Fe2+, Fe2+ +2OH- → Fe(OH)2, 4Fe(OH)2 + O2 +2H2O → 4Fe(OH)3.
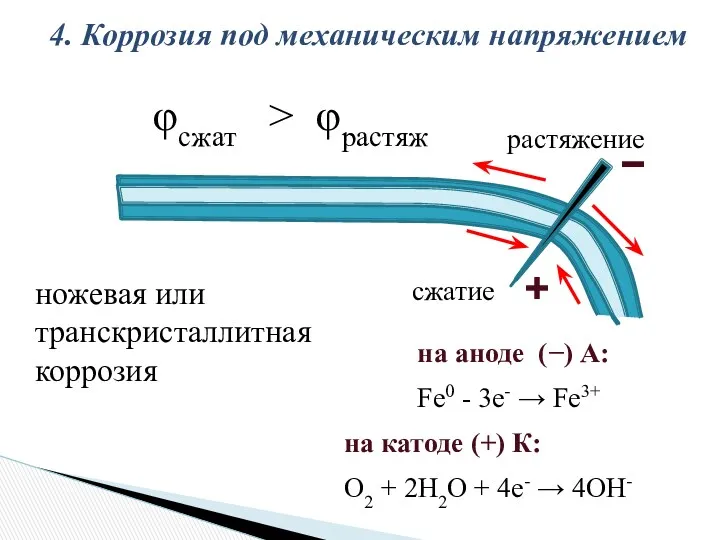
- 20. 4. КОРРОЗИЯ ПОД МЕХАНИЧЕСКИМ НАПРЯЖЕНИЕМ Статические напряжения могут понижать термодинамическую устойчивость металла, разрушать защитные пленки. При
- 21. растяжение сжатие 4. Коррозия под механическим напряжением ножевая или транскристаллитная коррозия φсжат > φрастяж на аноде
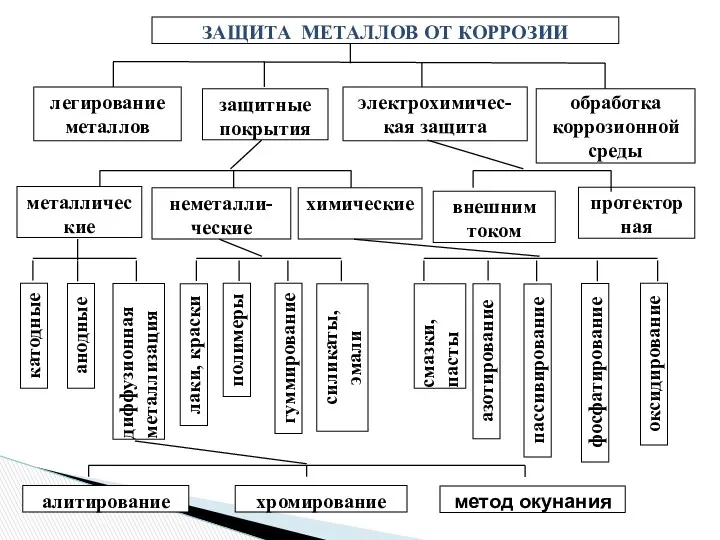
- 22. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ легирование металлов защитные покрытия электрохимичес-кая защита обработка коррозионной среды металлические неметалли-ческие химические
- 23. Катодное покрытие - это покрытие более активного металла менее активным. Пример: железо, покрытое оловом (луженое железо).
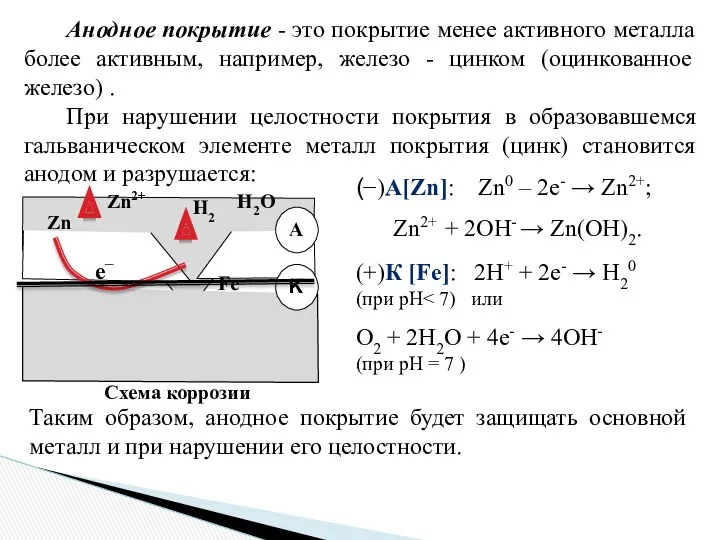
- 24. Анодное покрытие - это покрытие менее активного металла более активным, например, железо - цинком (оцинкованное железо)
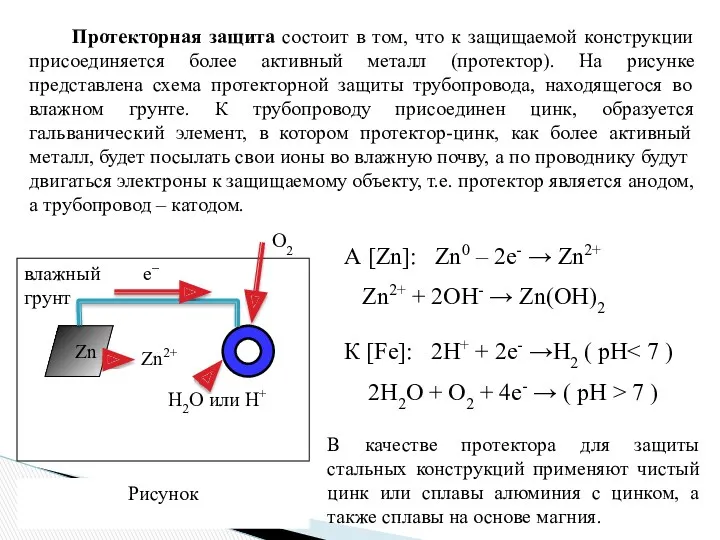
- 25. Протекторная защита состоит в том, что к защищаемой конструкции присоединяется более активный металл (протектор). На рисунке
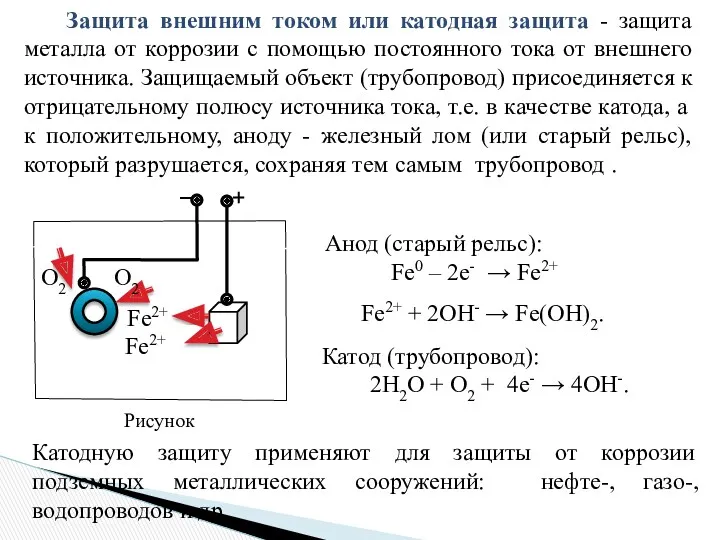
- 26. Защита внешним током или катодная защита - защита металла от коррозии с помощью постоянного тока от
- 28. Электролиз. Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или
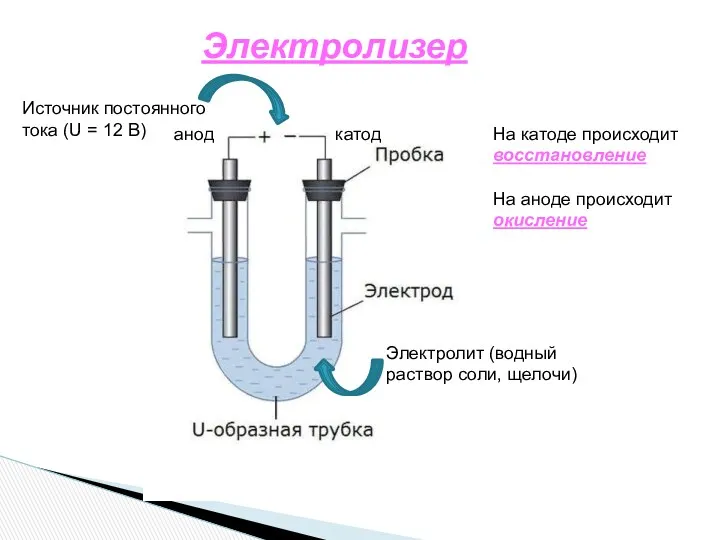
- 29. Электролизер Электролит (водный раствор соли, щелочи) Источник постоянного тока (U = 12 B) катод анод На
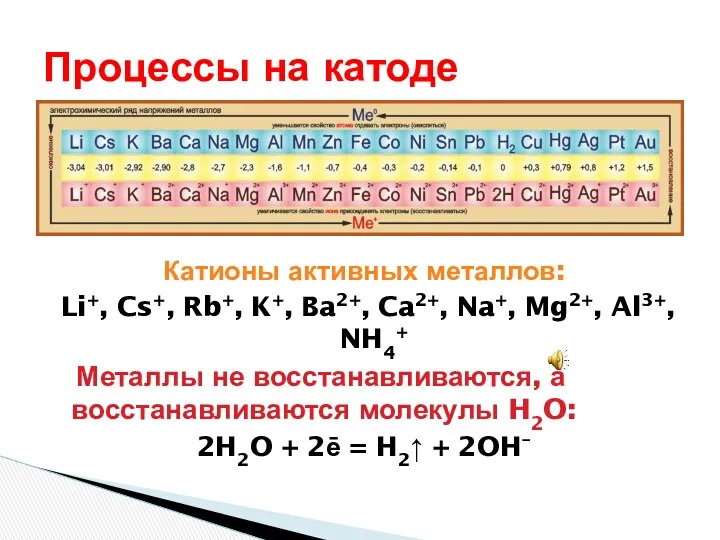
- 30. Процессы на катоде Катионы активных металлов: Li+, Cs+, Rb+, K+, Ba2+, Ca2+, Na+, Mg2+, Al3+, NH4+
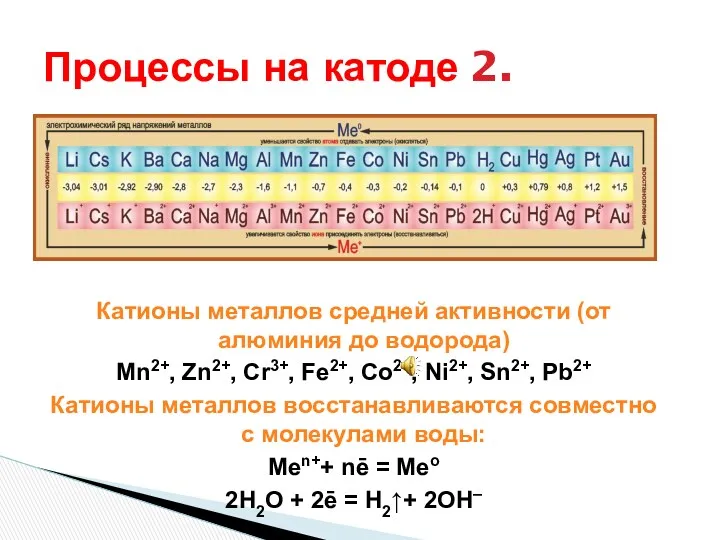
- 31. Процессы на катоде 2. Катионы металлов средней активности (от алюминия до водорода) Mn2+, Zn2+, Cr3+, Fe2+,
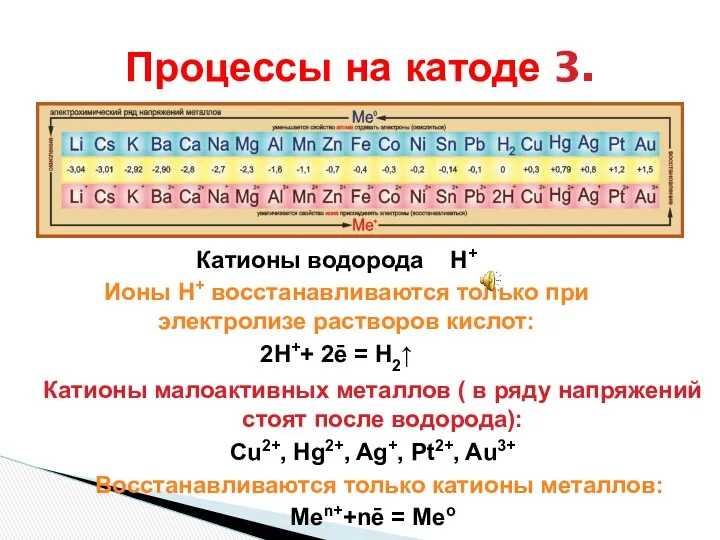
- 32. Процессы на катоде 3. Катионы водорода H+ Ионы H+ восстанавливаются только при электролизе растворов кислот: 2H++
- 33. Процессы на аноде 1-2 1) Анионы бескислородных кислот: I–, Br–, S2–, Cl– Окисляются кислотные остатки Am–
- 34. Процессы на аноде 3-4. 3) Анионы кислородсодержащих кислот: SO42–, NO3–, CO32–, PO43– Окисляются молекулы воды: 2H2O
- 36. Электролиз раствора NaCl Раствор NaCl (–) Катод ← Na+ Cl– → (+) Анод H2O H2O (–)
- 37. Если анод растворимый Анод растворимый (активный), изготовлен из Cu, Ag, Zn, Ni, Fe и др. металлы.
- 38. Если анод растворимый Анод растворимый. Электролиз раствора AgNO3 (анод растворимый – из Ag) (–) Катод: Ag+
- 39. Электролиз расплавов Расплав KOH = K+ + OH– (–) Катод: K+ + 1ē = Ko │х
- 40. Законы электролиза. Законы Фарадея. Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшее через
- 42. Скачать презентацию












![К(+)[Cu] 2Н+ + 2e- → Н2 (-)А Fe0- 2e-→Fe2+ 4Fe(OH)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/585398/slide-17.jpg)











 Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Способы производства железоуглеродистых сплавов
Способы производства железоуглеродистых сплавов Суспензии: получение, свойства
Суспензии: получение, свойства Соли (12 класс)
Соли (12 класс) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Химические опасности. Нитраты
Химические опасности. Нитраты Lipid metabolism
Lipid metabolism Контроль результатов обучения химии
Контроль результатов обучения химии Галогены. Строение атомов и молекул галогенов
Галогены. Строение атомов и молекул галогенов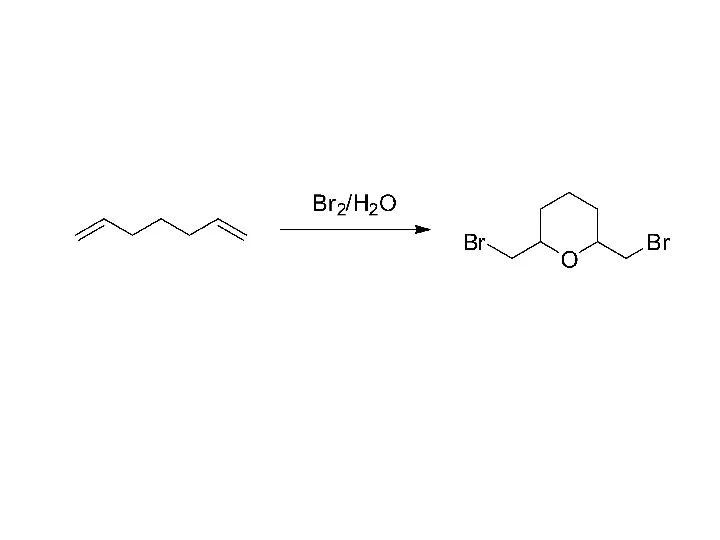 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Три состояния вещества
Три состояния вещества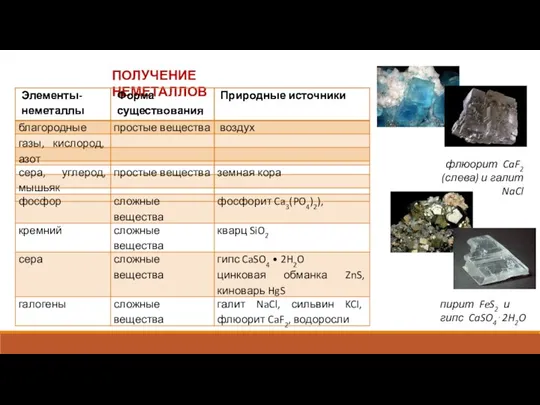 Получение неметаллов
Получение неметаллов Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Алюминий. Определите элемент
Алюминий. Определите элемент Оксид кальция (СаО)
Оксид кальция (СаО) Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция Растворы. Основные понятия и определения
Растворы. Основные понятия и определения Игра - викторина
Игра - викторина Лекция 2 Периодический закон
Лекция 2 Периодический закон Techniques for preparation of gaseous samples with a desired concentration of analyte
Techniques for preparation of gaseous samples with a desired concentration of analyte Химия в повседневной жизни человека
Химия в повседневной жизни человека Предмет органической химии
Предмет органической химии Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения Атом құрылысы
Атом құрылысы Химический элемент - водород
Химический элемент - водород Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Періодична система хімічних елементів
Періодична система хімічних елементів