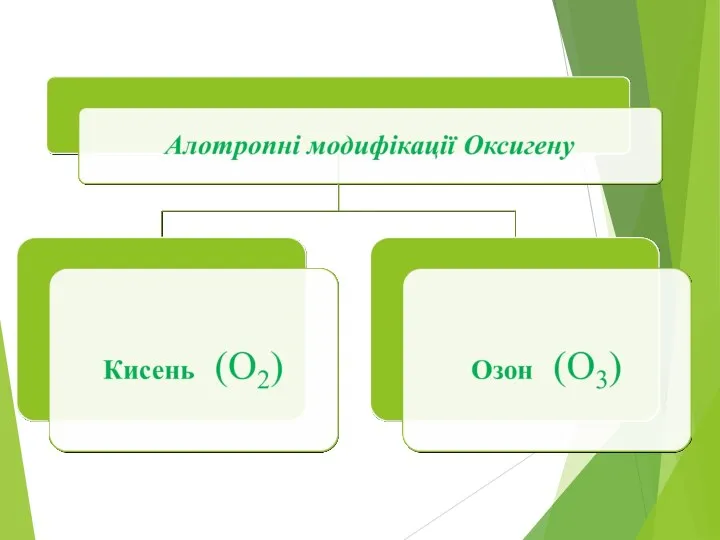
Слайд 2

Алотропія - явище існування хімічного елемента у вигляді двох або кількох
простих речовин, різних за властивостями і будовою.
Алотропними видозмінами (форми, модифікації) хімічного елемента – це прості речовини утворені одним і тим самим елементом.
Слайд 3
Слайд 4
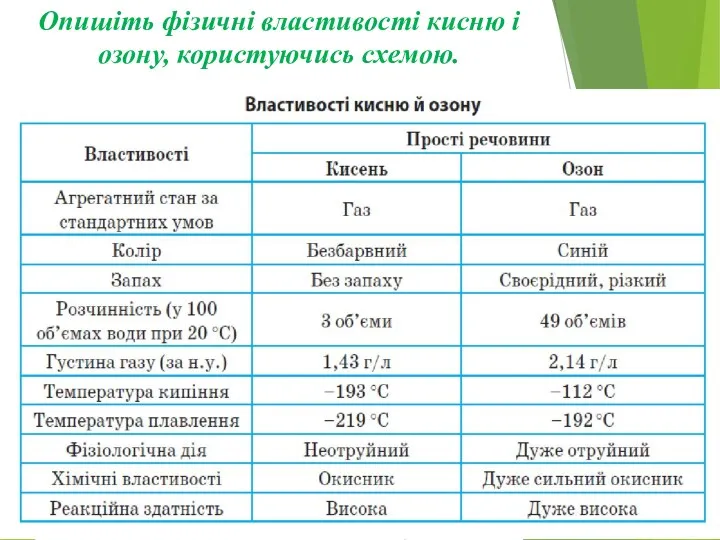
Опишіть фізичні властивості кисню і озону, користуючись схемою.
Слайд 5
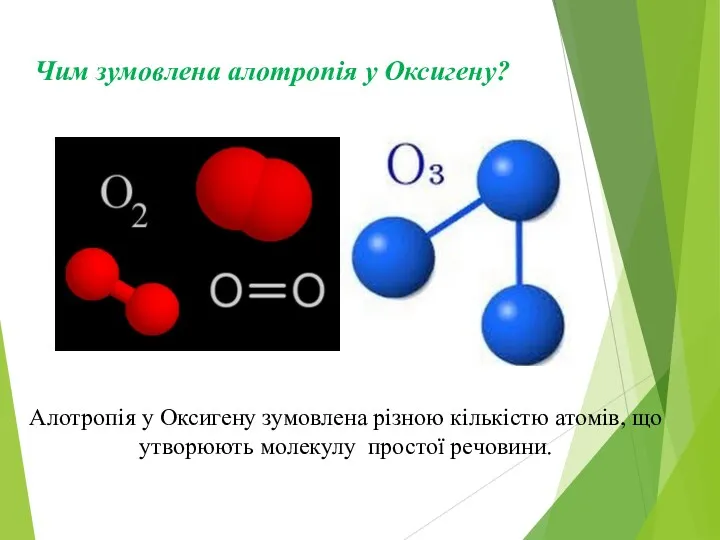
Чим зумовлена алотропія у Оксигену?
Алотропія у Оксигену зумовлена різною кількістю атомів,
що утворюють молекулу простої речовини.
Слайд 6
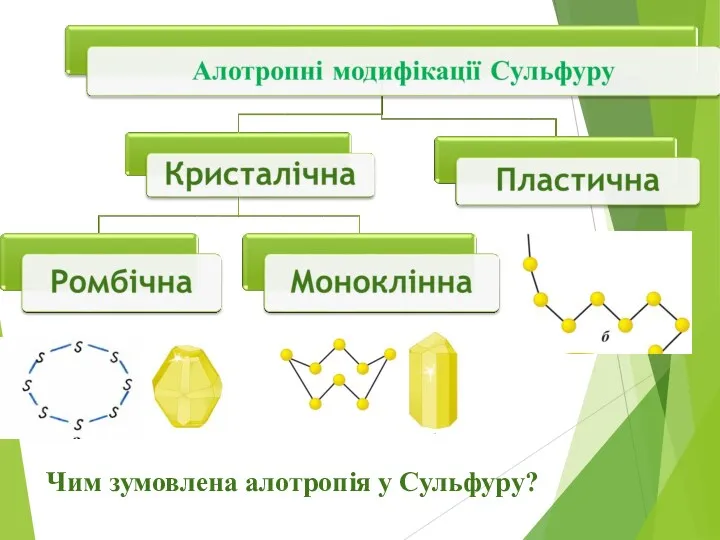
Чим зумовлена алотропія у Сульфуру?
Слайд 7

Слайд 8
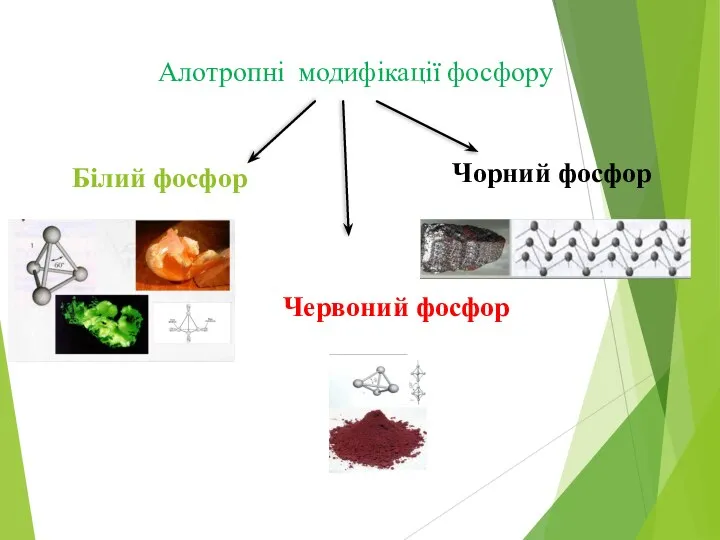
Алотропні модифікації фосфору
Білий фосфор
Червоний фосфор
Чорний фосфор
Слайд 9
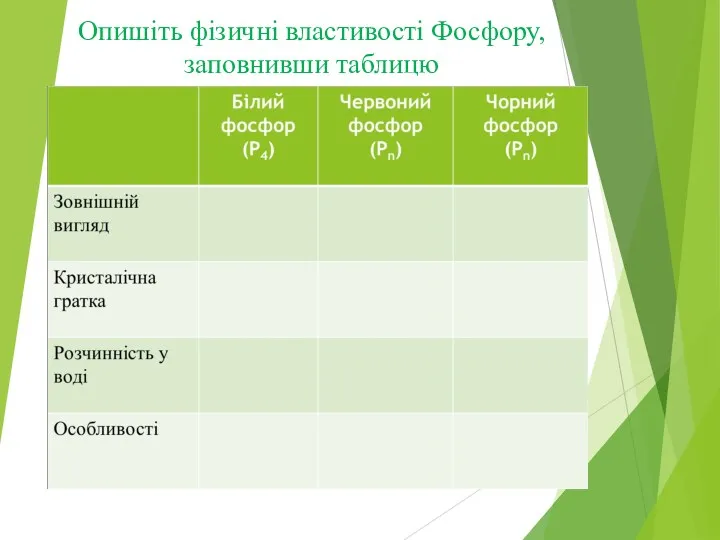
Опишіть фізичні властивості Фосфору, заповнивши таблицю
Слайд 10

Білий фосфор Р4
Білий, кристалічний порошок
Молекулярна кристалічна гратка.
Нерозчинний у воді.
Світиться.
Діелектрик.
Легкоплавкий.
Леткий.
Часниковий запах.
Отруйний
Слайд 11

Червоний фосфор Рn
Червоний порошок
Атомна кристалічна гратка.
Нерозчинний у воді.
Не світиться.
Діелектрик.
Нелеткий.
Без
запаху.
Не отруйний
Слайд 12

Чорний фосфор Рn
Чорний графітоподібний порошок
Атомна кристалічна гратка (шарувата, як у
графіта).
Нерозчинний у воді.
Не світиться.
Напівпровідник.
Масний на дотик.
Нелеткий.
Без запаху.
Не отруйний
Слайд 13

Слайд 14
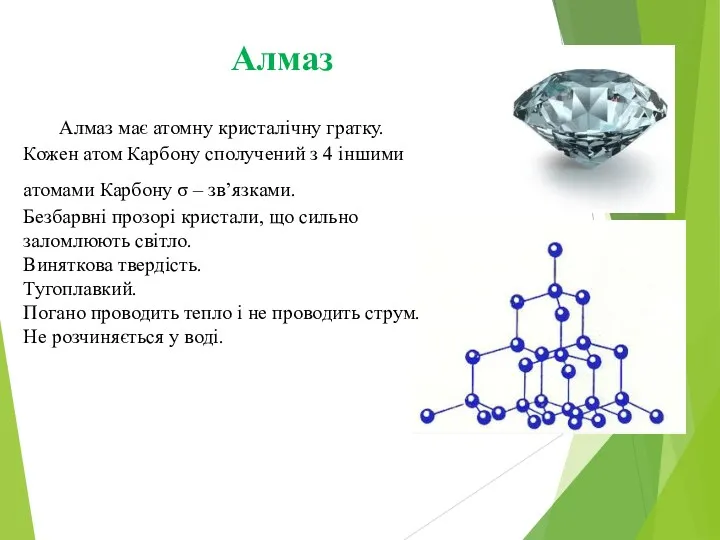
Алмаз
Алмаз має атомну кристалічну гратку. Кожен атом Карбону сполучений з
4 іншими атомами Карбону σ – зв’язками.
Безбарвні прозорі кристали, що сильно заломлюють світло.
Виняткова твердість.
Тугоплавкий.
Погано проводить тепло і не проводить струм.
Не розчиняється у воді.
Слайд 15

Застосування алмазу
Ювелірні вироби
(заломлює світло)
Для різання скла, шліфування, буріння
(дуже твердий)
Слайд 16
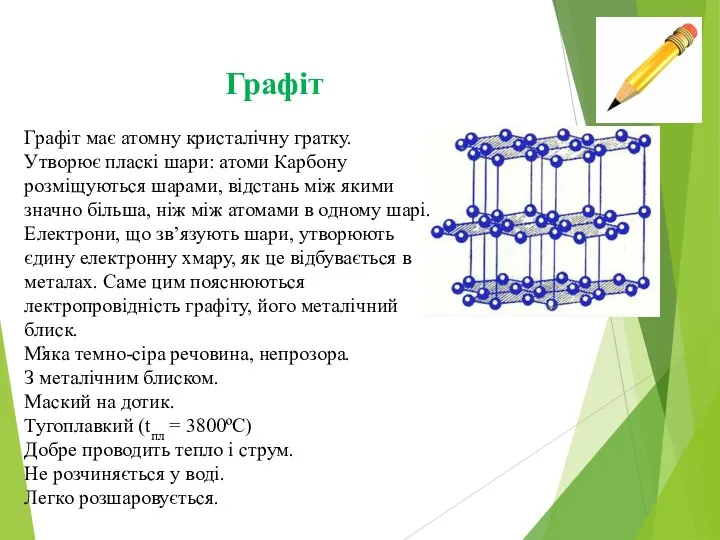
Графіт
Графіт має атомну кристалічну гратку.
Утворює пласкі шари: атоми Карбону
розміщуються шарами, відстань між якими значно більша, ніж між атомами в одному шарі. Електрони, що зв’язують шари, утворюють єдину електронну хмару, як це відбувається в металах. Саме цим пояснюються лектропровідність графіту, його металічний блиск.
М̕яка темно-сіра речовина, непрозора.
З металічним блиском.
Маский на дотик.
Тугоплавкий (tпл = 3800ºС)
Добре проводить тепло і струм.
Не розчиняється у воді.
Легко розшаровується.
Слайд 17

Застосування графіту
Грифелі для олівців
Графітові тиглі
Електроди
Мастило для машин
Добавка до фарби
Слайд 18

Карбін
Карбін складається з довгих ланцюгів атомів Карбону, сполучених між собою
подвійними або одинарними і потрійними зв’язками. Чорний дрібнокристалічний порошок.
Напівпровідник. Під дією світла його електропровідність зростає, тому карбін застосовують у фотоелементах.
За твердістю перевершує графіт, але м’якший за алмаз
Слайд 19

Фулерен (букибол)
Молекули фулерену мають форму сфери або еліпсоїда і побудовані з
п’яти- або шестикутників Карбону. Атоми вуглецю в молекулі фулерену пов'язані σ- і π-π-зв'язками


















 Элементы V группы главной подгруппы
Элементы V группы главной подгруппы Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Алкены. Этилен
Алкены. Этилен Природные источники углеводородов
Природные источники углеводородов Адсорбция
Адсорбция Формы минералов и их агрегатов
Формы минералов и их агрегатов Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Основные классы неорганических соединений
Основные классы неорганических соединений Химические элементы IV группы главной подгруппы
Химические элементы IV группы главной подгруппы Трифенилметановые красители
Трифенилметановые красители Азотсодержащие органические соединения
Азотсодержащие органические соединения Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 Жесткость воды
Жесткость воды Азо-, диазосоединения
Азо-, диазосоединения Вода. Практическая работа
Вода. Практическая работа Природные источники углеводородов
Природные источники углеводородов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основные понятия химии
Основные понятия химии Хімічні явища в побуті
Хімічні явища в побуті Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Каменный уголь
Каменный уголь Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома Коррозия металлов и способы ее устранения
Коррозия металлов и способы ее устранения Физические свойства карбоновых кислот. Общие химические свойства неорганических и органических кислот. 10 класс
Физические свойства карбоновых кислот. Общие химические свойства неорганических и органических кислот. 10 класс Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Супрамолекулярний контроль для дослідження реакційної здатності та каталізу
Супрамолекулярний контроль для дослідження реакційної здатності та каталізу Химические свойства алкенов
Химические свойства алкенов