Содержание
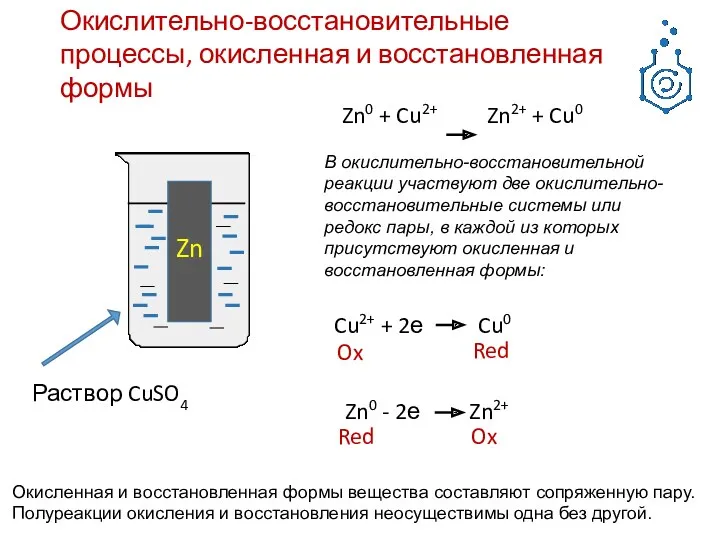
- 2. Раствор CuSO4 Zn Zn0 + Cu2+ Zn2+ + Cu0 Окислительно-восстановительные процессы, окисленная и восстановленная формы В
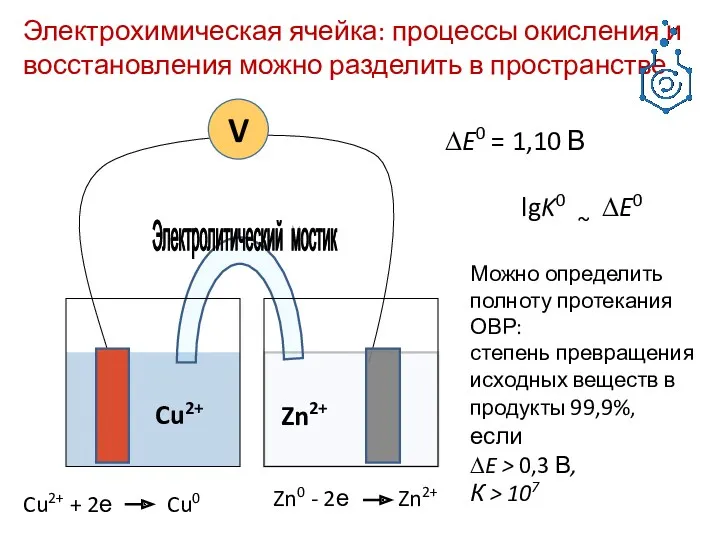
- 3. Zn2+ Cu2+ V Электрохимическая ячейка: процессы окисления и восстановления можно разделить в пространстве Cu2+ + 2е
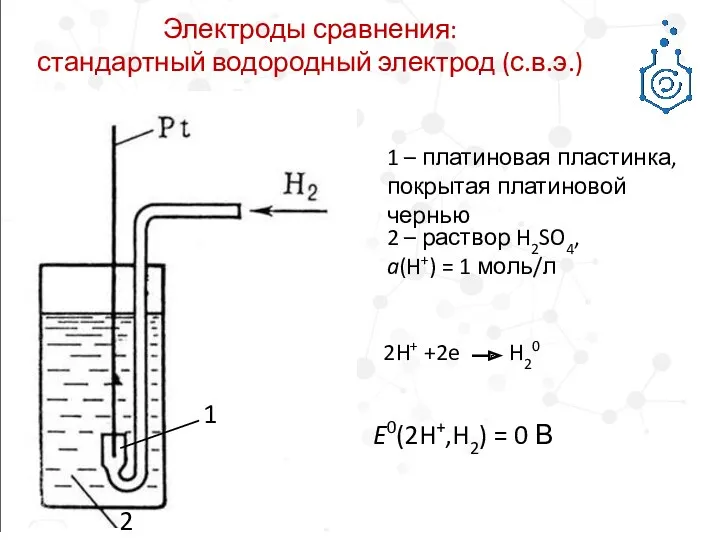
- 4. Электроды сравнения: стандартный водородный электрод (с.в.э.) 1 – платиновая пластинка, покрытая платиновой чернью 1 2 –
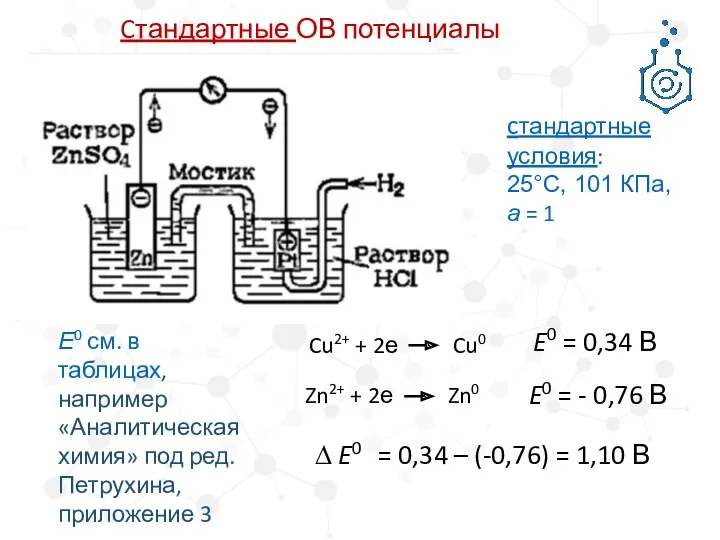
- 5. Cтандартные ОВ потенциалы cтандартные условия: 25°C, 101 КПа, а = 1 Cu2+ + 2е Cu0 Zn2+
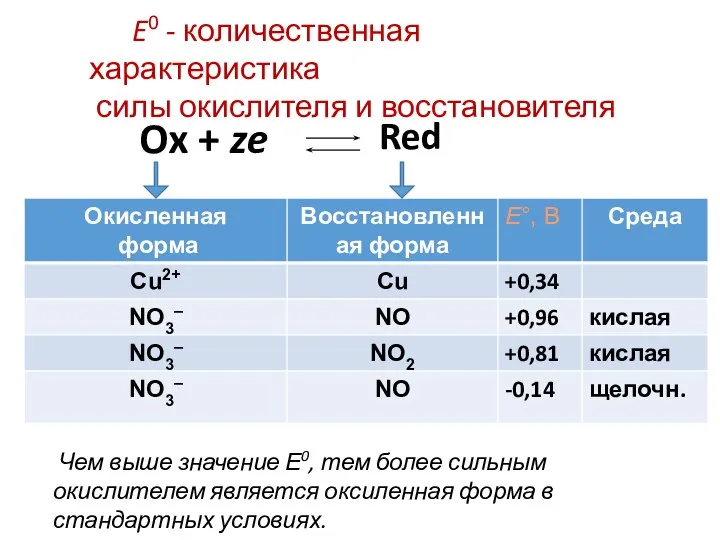
- 6. E0 - количественная характеристика силы окислителя и восстановителя Ox + ze Red Чем выше значение Е0,
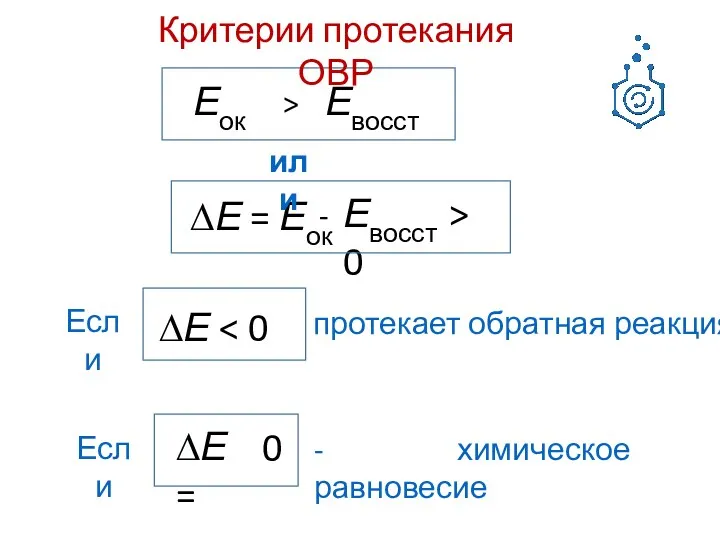
- 7. Еок Евосст > ∆Е = Еок Евосст > 0 - или ∆Е Если протекает обратная реакция
- 8. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНОГО ПОТЕНЦИАЛА 1.Соотношение концентраций - [ Ox ] / [
- 9. Если условия отличаются от стандартных: уравнение Нернста Для ОВ системы (полуреакции), выражаемой уравнением Ox + ne
- 10. Уравнение Нернста, примеры a) Cu2+ +2e Cu б) 2H+ +2e H2
- 11. в) Fe3+ + e Fe2+ Уравнение Нернста, примеры г) NO3- + 4H+ + 3e NO +
- 12. Семинар: примеры задач на использование уравнения Нернста 1. Рассчитать равновесный потенциал никелевой пластинки, опущенной в 0,01
- 13. 2. Рассчитать значение равновесного потенциала окислительно-восстановительной пары Ti3+ + e Ti2+ при соотношении концентраций окисленной и
- 14. 3. Рассчитать значение равновесного потенциала окислительно-восстановительной пары Cr2O72- + 14H+ + 6e 2Cr3+ + 7H2O при
- 15. Семинар: как определить направление протекания реакции? 3Cu(NO3)2 + 2NO + 4H2O 3Cu + 8HNO3 NO3– +
- 16. Семинар: как определить направление протекания реакции? 2IO3– + 12H+ + 10ē → I2 + 6H2O Br2
- 17. Семинар: как определить полноту протекания реакции? Полнота протекания ОВ реакции определяется разностью Е1 и Е2: Реакция
- 18. Реальный (формальный) потенциал ОВ системы Реальный (формальный) потенциал ОВ системы равен равновесному потенциалу при общих концентрациях
- 19. Реальный потенциал с учетом ионной силы раствора Например, для ОВ пары Fe3+ + e →Fe2+ I
- 20. Реальный потенциал в системах, в которых участвуют Н+ Расчет реального потенциала на примере окислительно-восстановительной пары: Cr2O72-
- 21. Ox + mH+ + ne → Red + … В общем случае: MnO4- + 8H+ +
- 22. Реальный потенциал с учетом побочных реакций комплексообразования Ион Fe3+ образует ряд комплексных соединений с ионом F-:
- 23. С учетом побочных реакций комплексообразования в общем случае: Если в комплекс связана окисленная форма: Если в
- 24. Как определить направление реакции между Cu2+/Cu+ и I2/2I- ? E0(Cu2+/Cu+) = 0,16 В ; E0(I2/2I-) =
- 25. Равновесная концентрация ионов Cu+: Ks(CuI) = [Cu+][I-], отсюда [Сu+]= Ks/[I-]. Реальный потенциал с учетом побочных реакций
- 26. Кривые ОВ титрования Рассмотрим титрование FeSO4 раствором KMnO4 в кислой среде: Fe3+ + e →Fe2+ MnO4-
- 27. Кривые ОВ титрования MnO4- + 8H+ + 5e →Mn2+ + 4H2O 3. Отитрованный раствор – потенциал
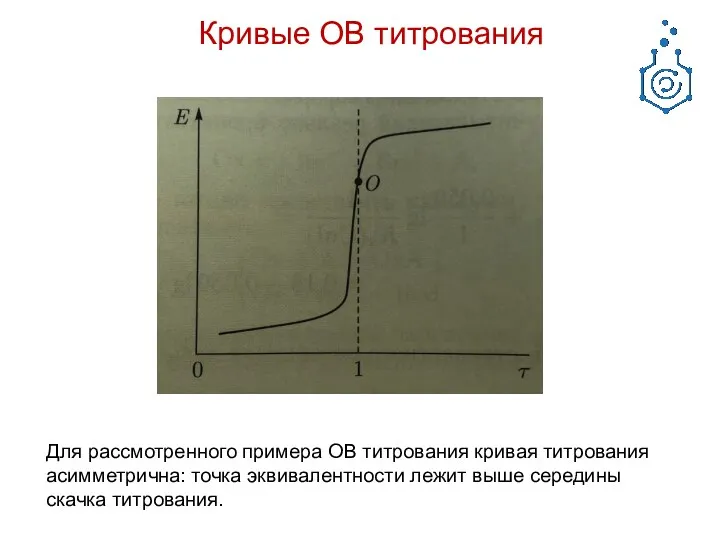
- 28. Кривые ОВ титрования Для рассмотренного примера ОВ титрования кривая титрования асимметрична: точка эквивалентности лежит выше середины
- 29. Подготовка к КР 4 Напишите формулу для расчета окислительно-восстановительного потенциала в точке эквивалентности. Чему равно значение
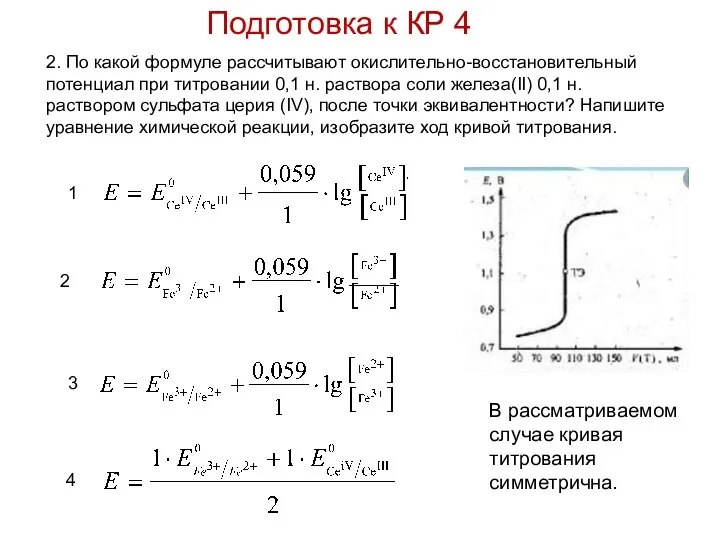
- 30. 2. По какой формуле рассчитывают окислительно-восстановительный потенциал при титровании 0,1 н. раствора соли железа(II) 0,1 н.
- 31. Подготовка к КР 4 3. Сколько граммов перманганата калия нужно взять, чтобы приготовить 1 л раствора
- 32. Стандартизация перманганата проводится по оксалат-ионам (Na2C2O4, (NH4)2C2O4, H2C2O4): 5H2C2O4 + 2KMnO4 + 3H2O = 2MnSO4 +
- 33. Перманганатометрия – прямое титрование
- 34. Перманганатометрия – определение окислителей
- 35. Это вещества, обладающие ОВ свойствами, у которых окисленная и восстановленная формы имеют разную окраску: IndOx +
- 37. Скачать презентацию

















![Равновесная концентрация ионов Cu+: Ks(CuI) = [Cu+][I-], отсюда [Сu+]= Ks/[I-].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/308574/slide-24.jpg)








 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей