Содержание
- 2. Алканы – углеводороды с общей формулой: СnH2n+2, в молекулах которых атомы связаны одинарными связями.
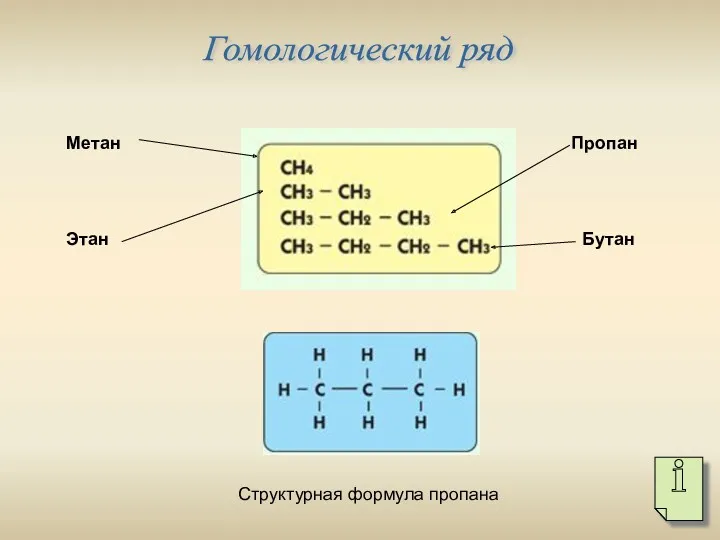
- 3. Гомологический ряд Метан Этан Пропан Бутан Структурная формула пропана
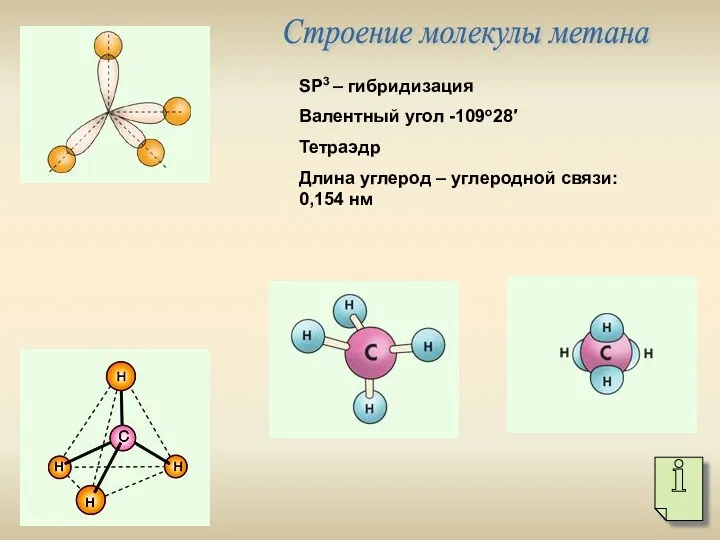
- 4. Строение молекулы метана SР3 – гибридизация Валентный угол -109о28′ Тетраэдр Длина углерод – углеродной связи: 0,154
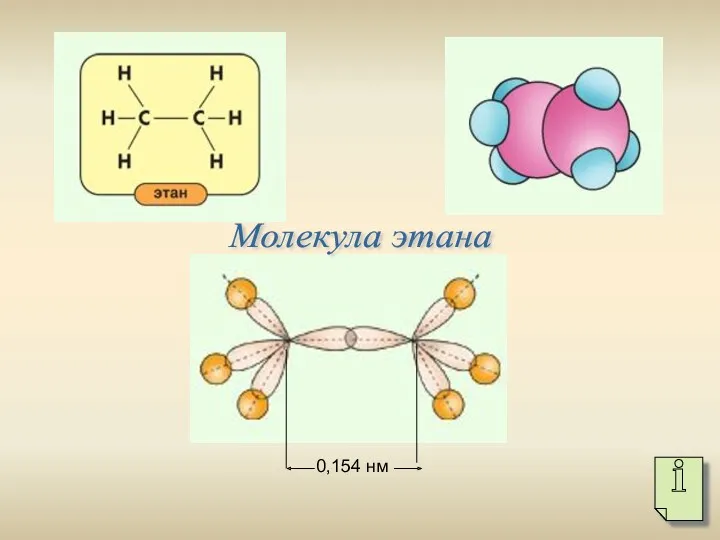
- 5. 0,154 нм Молекула этана
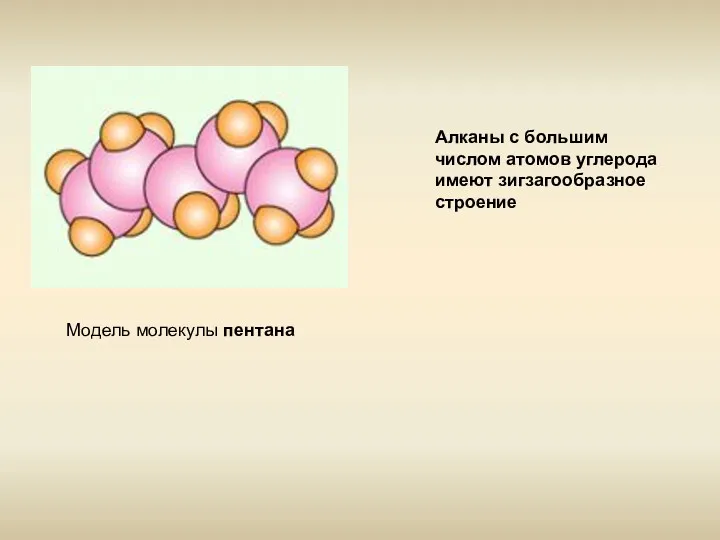
- 6. Модель молекулы пентана Алканы с большим числом атомов углерода имеют зигзагообразное строение
- 7. Изомерия Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной
- 8. Физические свойства Все алканы плохо растворимы в воде. С ростом молекулярной массы закономерно увеличиваются температуры кипения
- 9. Получение алканов 1 –выделение углеводородов из природного сырья 2- гидрирование циклоалканов и непредельных углеводородов 3- декарбоксилирование
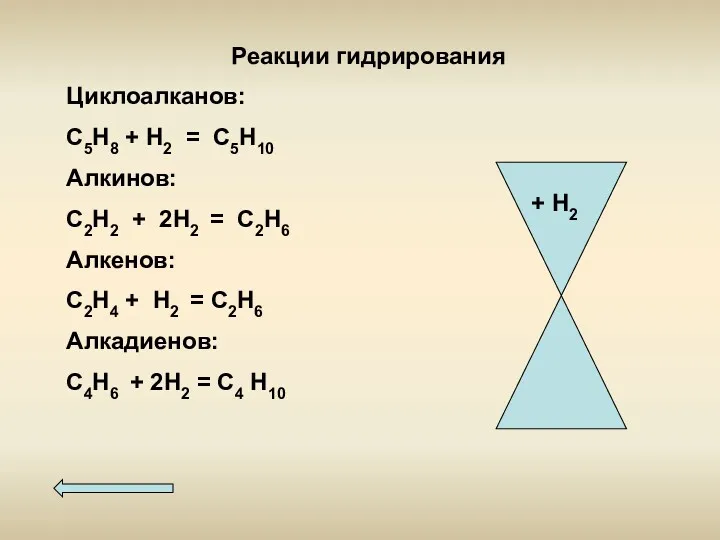
- 10. Реакции гидрирования Циклоалканов: С5Н8 + Н2 = С5Н10 Алкинов: С2Н2 + 2Н2 = С2Н6 Алкенов: С2Н4
- 11. Получение метана при сплавлении ацетата натрия со щелочью: t °C CH3COONa + NaOH ⎯⎯→ CH4 ⇑
- 12. Синтез Вюрца проводят с целью получения алканов с более длинной углеродной цепью. Например: получение этана из
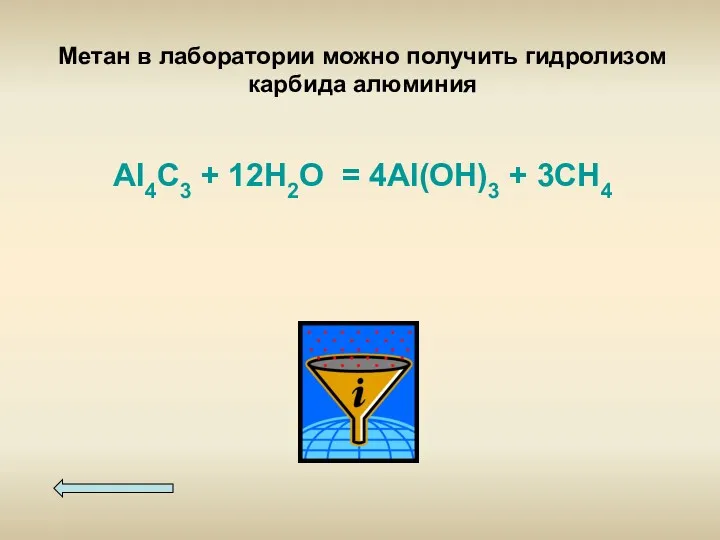
- 13. Метан в лаборатории можно получить гидролизом карбида алюминия Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
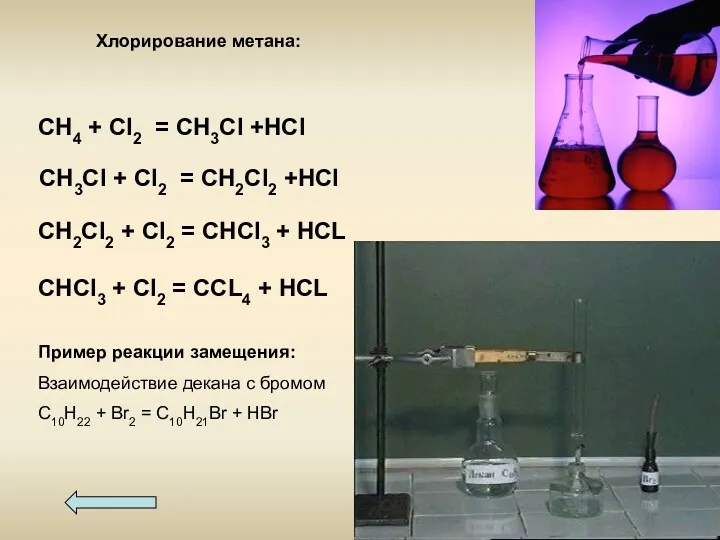
- 14. Химические свойства 1- реакции замещения 2- реакции дегидрирования 3- реакции горения 4 - реакции изомеризации 5-
- 15. Пример реакции замещения: Взаимодействие декана с бромом С10Н22 + Br2 = С10Н21Br + HBr CH4 +
- 16. При дегидрировании алканов образуются алкены и другие непредельные углеводороды. Например, дегидрирование пентана: С5Н10 С5Н8 + Н2
- 17. Все алканы горят с образованием углекислого газа и воды 2С4Н10 + 13О2 = 8СО2 + 10Н2О
- 18. Реакции изомеризации идут при нагревании и в присутствии катализатора Например: изомеризация пентана (с хлоридом алюминия) СН3
- 19. Термическое расщепление 1- крекинг (400-500 оС) Алкан новый алкан и алкен С20Н42 С10Н22 + С10Н20 2-
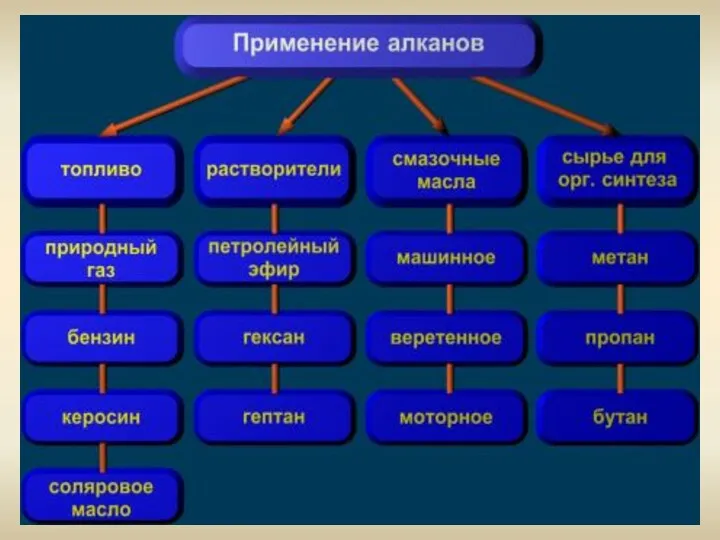
- 20. Применение Получение ацетилена Горючее для дизельных и турбореактивных двигателей Получение растворителей В металлургии А также сырьё
- 22. Проверка знаний Какие углеводороды относят к алканам? Запишите формулы возможных изомеров гексана и назовите их по
- 24. Скачать презентацию













 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки